凉茶渣替代象草对育肥牛空肠组织形态、屏障功能以及菌群结构的影响
2022-03-10孙小红罗君谊习欠云张永亮孙加节
李 玲 孙小红 连 旭 罗君谊 陈 婷 习欠云 张永亮 孙加节
(华南农业大学动物科学学院,广东省动物营养调控重点实验室,广州510642)
凉茶主要由凉粉草、鸡蛋花、金银花、菊花、夏枯草、布渣叶和甘草等7种植物性中草药煎制而成,凉茶渣成分与其原材料相近[1],主要包含7种酚酸类物质、6种黄酮苷类物质、3种皂苷类物质以及1种甾醇类物质[2],具有清热排毒、抗菌消炎的功效[3-4]。据初步统计,目前仅广东地区主要凉茶生产企业,日均可产生约千吨固废凉茶渣,采用焚烧、填埋的方式进行处理,不仅加剧环境污染,更是对中草药资源的严重浪费。如将凉茶渣作为非常规饲料资源进行开发,对缓解我国饲料资源紧缺将有很大益处[5]。试验表明,凉茶渣作为后备奶牛功能性粗饲料,能够部分缓解机体夏季热应激[6]。
肠道微生物群是一个稳定且复杂的生态系统,可以通过形成菌膜、促进肠道上皮细胞增殖分化等方式保护肠道健康[7]。因此,本文将凉茶渣作为育肥牛非常规粗饲料资源进行利用,探究其对育肥牛空肠组织形态、屏障功能以及菌群结构的影响,为凉茶渣饲料化利用提供技术数据。
1 材料与方法
1.1 试验设计及饲养管理
凉茶渣主要营养成分含量(除干物质外,其余指标均为干物质基础)[6]:干物质20.55%,中性洗涤纤维61.22%,酸性洗涤纤维40.29%,粗蛋白质9.78%,粗脂肪3.52%,粗灰分6.68%。
试验采用单因素随机分组设计,选用120头约18月龄、体况良好且体重[(487±29) kg]相近的西门塔尔杂交育肥牛,随机分为2个组,分别为对照组(CN组,饲喂基础饲粮)、试验组(RE组,50%凉茶渣替代部分象草),每组3个重复,每个重复20头牛。预试期7 d,正试期60 d。根据育肥肉牛现阶段营养需要与所在养殖场生产实际配制饲粮,试验饲粮组成及营养水平见表1。饲粮均由饲料搅拌车混合均匀,每天08:00和17:00定时喂料,自由饮水。牛舍每天清扫,定期进行消毒,保持清爽整洁。
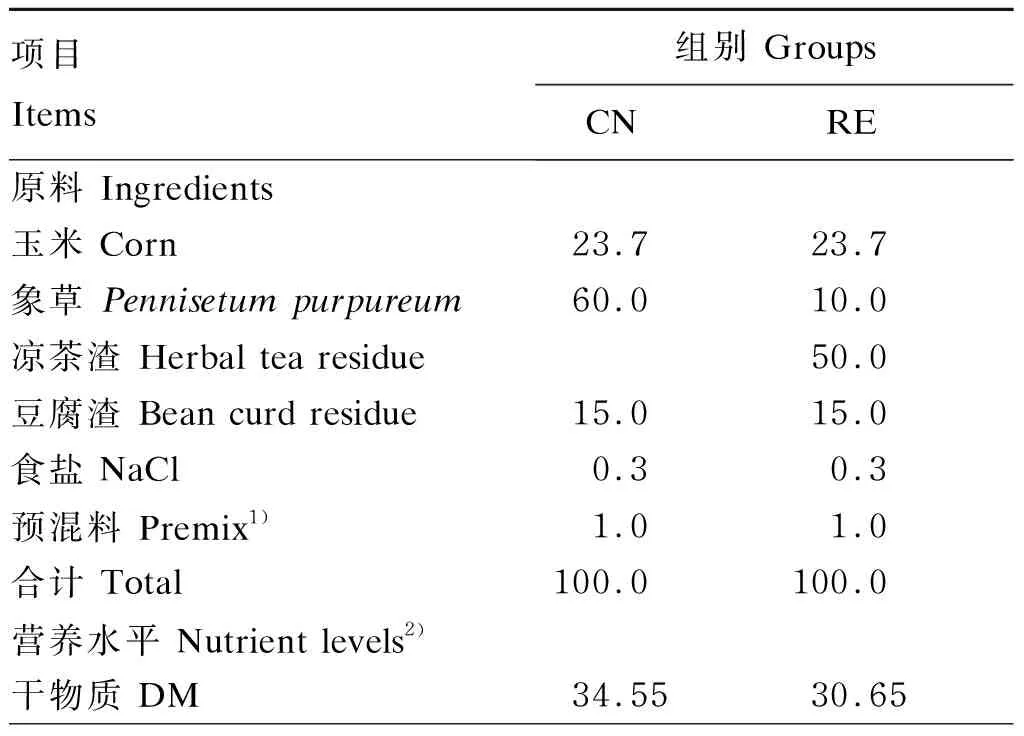
表1 试验饲粮组成及营养水平(干物质基础)
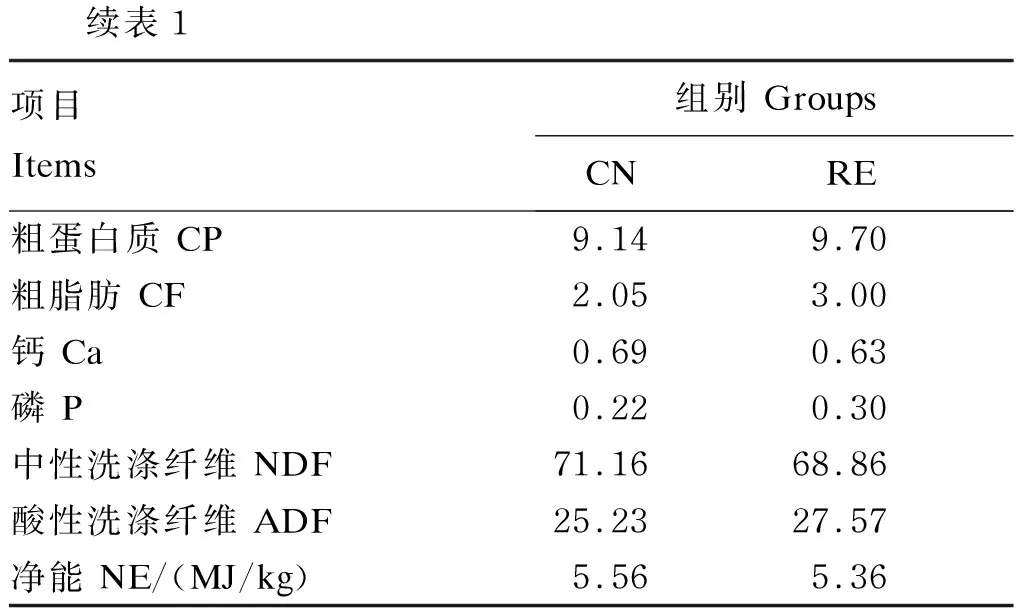
续表1项目Items组别 GroupsCNRE粗蛋白质 CP9.149.70粗脂肪 CF2.053.00钙 Ca 0.690.63磷 P 0.220.30中性洗涤纤维 NDF71.1668.86酸性洗涤纤维 ADF25.2327.57净能 NE/(MJ/kg)5.565.36
1.2 样品采集
试验期结束前1天,每组随机选取10头牛进行尾静脉采血,采取的血液在离心管中静置2 h,4 000 r/min离心10 min,分离出的血清于-20 ℃保存备用。试验牛屠宰前隔夜禁食16 h,每组随机选取10头,立即分离出肠道,分别取空肠组织、空肠内容物于离心管中,液氮速冻后放入-80 ℃冰箱冻存备用。
1.3 空肠组织切片染色
将空肠组织放入4%多聚甲醛溶液中固定24 h后,用0.01 mol/L磷酸盐缓冲液(PBS)溶液冲洗,再用浓度递增的乙醇脱水,二甲苯清洗,并包埋在石蜡中;切片后展平放置于载玻片上,再烘干;苏木精-伊红(HE)染色后用乙醇脱水,用二甲苯使切片透明,并用封固剂封固。使用Imagel软件测量空肠绒毛高度和隐窝深度。
1.4 血清免疫指标
血清中肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、转化生长因子-β(TGF-β)、D-乳酸(D-Lac)、二胺氧化酶(DAO)浓度采用南京建成生物工程研究所酶联免疫吸附测定(ELISA)试剂盒进行检测,操作过程严格按照试剂盒说明书进行。
1.5 荧光定量PCR(qRT-PCR)
取黄豆粒儿大小的空肠组织块并剪碎,用Trizol裂解法提取空肠组织样品RNA,并按照反转录试剂盒操作步骤合成cDNA。参照武笑天等[8]的引物序列,对肠道紧密连接蛋白闭合小环蛋白-1(zonula occludens-1,ZO-1)、闭锁蛋白(Occludin)、闭合蛋白-1(Claudin-1)进行qRT-PCR分析,引物购买于生工生物工程(上海)股份有限公司。
1.6 16S rRNA基因测序及注释分析
采用十二烷基硫酸钠(SDS)方法对空肠内容物基因组DNA进行提取,利用琼脂糖凝胶电泳判断检测DNA的纯度和浓度。对16S rDNA的V3~V4设计带Barcode的特异引物,利用高效高保真酶进行PCR,确保扩增效率和准确性。文库构建、上机测序与操作分类单元(operational taxonomic units,OTUs)聚类和物种注释,以及后续的组内Alpha多样性分析、组间Beta多样性分析及Pearson相关性分析由诺禾致源生物公司完成。
1.7 数据统计分析
空肠组织形态及血清免疫指标等试验数据采用Excel 2010进行初步整理,然后利用SPSS V17.0软件进行独立样本t检验,以P<0.05为差异显著性标准。利用MetaStat分析,在属水平上做2组间空肠微生物的置换检验(permutation test),得到P值,然后对P值进行修正,得到错误发现率(false discovery rate,FDR)值,以FDR<0.05为菌群差异显著性标准[9]。
2 结 果
2.1 凉茶渣对育肥牛空肠组织形态与屏障功能的影响
空肠组织HE染色结果见图1-A。由图1-B可见,空肠绒毛高度和隐窝深度测量结果表明,与CN组相比,RE组的空肠绒毛高度显著增加(P<0.05),空肠隐窝深度无显著差异(P>0.05)。由图1-C可见,血清中D-Lac和DAO浓度检测结果表明,与CN组相比,RE组的血清中D-Lac浓度显著降低(P<0.05),血清中DAO浓度有所下降,但差异不显著(P>0.05)。由图1-D可见,血清中炎症因子TNF-α、IL-6、IL-10、TGF-β浓度检测结果表明,与CN组相比,RE组血清中IL-6和TNF-α浓度均有所下降,但差异不显著(P>0.05)。由图1-E可见,为了进一步研究凉茶渣对肠道屏障功能的作用,利用RT-qPCR检测肠道紧密连接蛋白ZO-1、Occludin、Claudin-1的mRNA表达水平,与CN组相比,RE组的空肠紧密连接蛋白ZO-1的mRNA表达水平显著上调(P<0.05),Occludin、Claudin-1的mRNA表达水平均上调,但差异不显著(P>0.05)。
2.2 凉茶渣对育肥牛空肠菌群的影响
2.2.1 OTUs聚类和物种注释
根据Barcode序列拆分出各样本数据,使用FLASH(http://ccb.jhu.edu/software/FLASH/)对每个样本的reads进行拼接,平均每个样本得到原始Tags序列(85 403±2 052)条,参照Qiime(http://qiime.org/scripts/split_libraries_fastq.html)质量控制流程,每个样品获得Effective Tags序列(54 589±1 327)条。利用Uparse软件(http://www.drive5.com/uparse/)对所有样本的全部Effective Tags进行聚类,默认以97%的一致性将序列聚类成为OTUs,共得出3 999个有效OTUs片段,其中2组样品共有1 835个OTUs,CN和RE组中特有的OTUs数量分别为1 057和1 107个(图2-A)。根据物种注释结果,确定了20个样本中最大相对丰度排名前10的物种(图2-B),其中相对丰度最大的2个菌门是厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),分别为81.37%和8.00%。CN和RE组厚壁菌门相对丰度分别为85.79%、76.96%,变形菌门相对丰度分别为4.44%、11.57%;另外,CN和RE组拟杆菌门相对丰度差别较大,分别为0.54%和3.11%。即RE组厚壁菌门相对丰度较CN组有所减少,变形菌门、拟杆菌门相对丰度较CN组有所增加,但优势菌群在门水平上没有发生改变。且与CN组相比,RE组中厚壁菌门与拟杆菌门的比值(F/B)有所降低。
由图3可见,物种丰度聚类分析表明,在属水平上,CN组和RE组之间表现出显著差异的前10个菌属分别是罗姆布茨菌属(Romboutsia)、假丁酸弧菌(Pseudobutyrivibrio)、柠檬酸杆菌(Limnobacter)、黑水仙菌属(Melainabacteria)、艰难杆菌属(Mogibacterium)、马文伯里安菌(Marvinbryantia)、丁蓖麻球菌属(Butyricicoccus)、罗斯氏菌属(Rothia)、布劳特氏菌属(Blautia)。另外,与CN组相比,RE组Rothia、Blautia相对丰度显著增加(P<0.05),Romboutsia相对丰度显著减少(P<0.05)。

A:空肠组织HE染色 HE staining of jejunum tissue;B:凉茶渣对育肥牛空肠绒毛高度和隐窝深度的影响 effects of herbal tea residue on villus height and crypt depth of jejunum of fattening cattle;C:凉茶渣对育肥牛血清中D-Lac与DAO浓度的影响 effects of herbal tea residue on concentrations of D-Lac and DAO in serum of fattening cattle;D:凉茶渣对育肥牛血清免疫因子浓度的影响 effects of herbal tea residue on serum immune factor concentration of fattening cattle;E:凉茶渣对育肥牛空肠紧连接蛋白基因表达的影响 effect of herbal tea residue on gene expression of tight junction proteins in jejunum of fattening cattle。
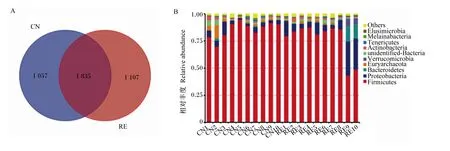
A:各组基于OTUs的韦恩图统计 Venn diagram statistics of each group based on OTUs;B:每个样品在门水平上的物种相对丰度柱形统计 column statistics of species relative abundance of each sample at phylum level。Firmicutes:厚壁菌门;Proteobacteria:变形菌门;Bacteroidetes:拟杆菌门;Euryarchaeota:广古菌门;Verrucomicrobia:疣微菌门;unidentified-Bacteria:未分类菌门;Actinobacteria:放线菌门;Tenericutes:柔壁菌门;Melainabacteria:黑水仙菌门;Elusimicrobia:迷踪菌门;Others:其他。
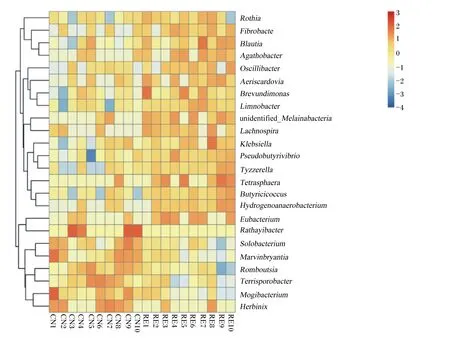
Rothia:罗斯氏菌属;Fibrobacte:纤维杆菌属;Blautia:布劳特氏菌属;Agathobacter:无杆菌属;Oscillibacter:颤螺旋菌属;Aeriscardovia:气斯卡多维亚氏菌属;Brevundimonas:短波单胞菌属;Limnobacter:柠檬酸杆菌属;unidentified_Melainabacteria:未分类黑水仙菌属;Lachnospira:毛螺菌属;Klebsiella:克雷伯氏菌属;Pseudobutyrivibrio:假丁酸弧菌;Tyzzerella:泰泽雷拉菌属;Tetrasphaera:四球虫属;Butyricicoccus:丁蓖麻球菌属;Hydrogenoanaerobacterium:氢厌氧小杆属;Eubacterium:真杆菌属;Rathayibacter:鸭舌草杆菌属;Solobacterium:梭菌属;Marvinbryantia:马文伯里安菌属;Romboutsia:罗姆布茨菌属;Terrisporobacter:土孢杆菌属;Mogibacterium:艰难杆菌属;Herbinix:赫宾尼菌属。
2.2.2 空肠菌群多样性研究
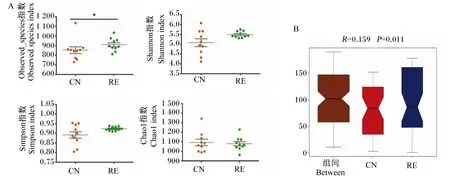
由图4-A可见,RE组的Observed_species指数显著高于CN组(P<0.05),表明RE组物种数目显著高于CN组,但是CN组和RE组之间Shannon、Simpson、Chao1指数均无显著差异(P>0.05)。Beta多样性分析是对不同组间样品的微生物群落构成进行比较分析,其中Anosim分析是一种非参数检验,用来检验组间的差异是否显著大于组内差异,从而判断分组是否有意义[10]。由图4-B可见,Anosim分析得出R=0.159,P=0.011,R值大于0小于1,且P值小于0.05,表明组间差异水平显著大于组内。
2.3 空肠菌群与其组织形态、屏障功能相关性分析
为了进一步鉴定与空肠组织形态、屏障功能显著相关的菌属,进行了Pearson相关性分析,此分析指2个变量之间的线性相关性,相关系数越接近1表明2个变量之间越相关。由图5可见,空肠绒毛高度与Blautia、Brevundimonas、Rothia、Tetrasphaera相对丰度呈显著正相关(P<0.05),相关系数范围为0.46~0.57;血清中D-Lac浓度与Romboutsia、Terrisporobacter相对丰度呈显著正相关(P<0.05),相关系数分别为0.56、0.62;血清中DAO浓度与赫宾尼菌属(Herbinix)、Terrisporobacter相对丰度呈显著正相关(P<0.05),相关系数分别为0.60、0.52;血清中IL-6浓度与气斯卡多维亚氏菌属(Aeriscardovia)相对丰度呈显著正相关(P=0.05),相关系数为-0.44;血清中IL-10浓度与Mogibacterium相对丰度呈显著负相关(P<0.05),相关系数分别为-0.53;紧密连接蛋白ZO-1的mRNA表达水平与Solobacterium相对丰度呈显著负相关(P<0.05),相关系数为-0.50;紧密连接蛋白Occludin的mRNA表达水平与Herbinix相对丰度呈显著负相关(P<0.05),相关系数为-0.46。
A:各组样本的Alpha指数统计 Alpha indexes statistics of each group;B:Anosim组间差异分析 Anosim analysis of differences between group。
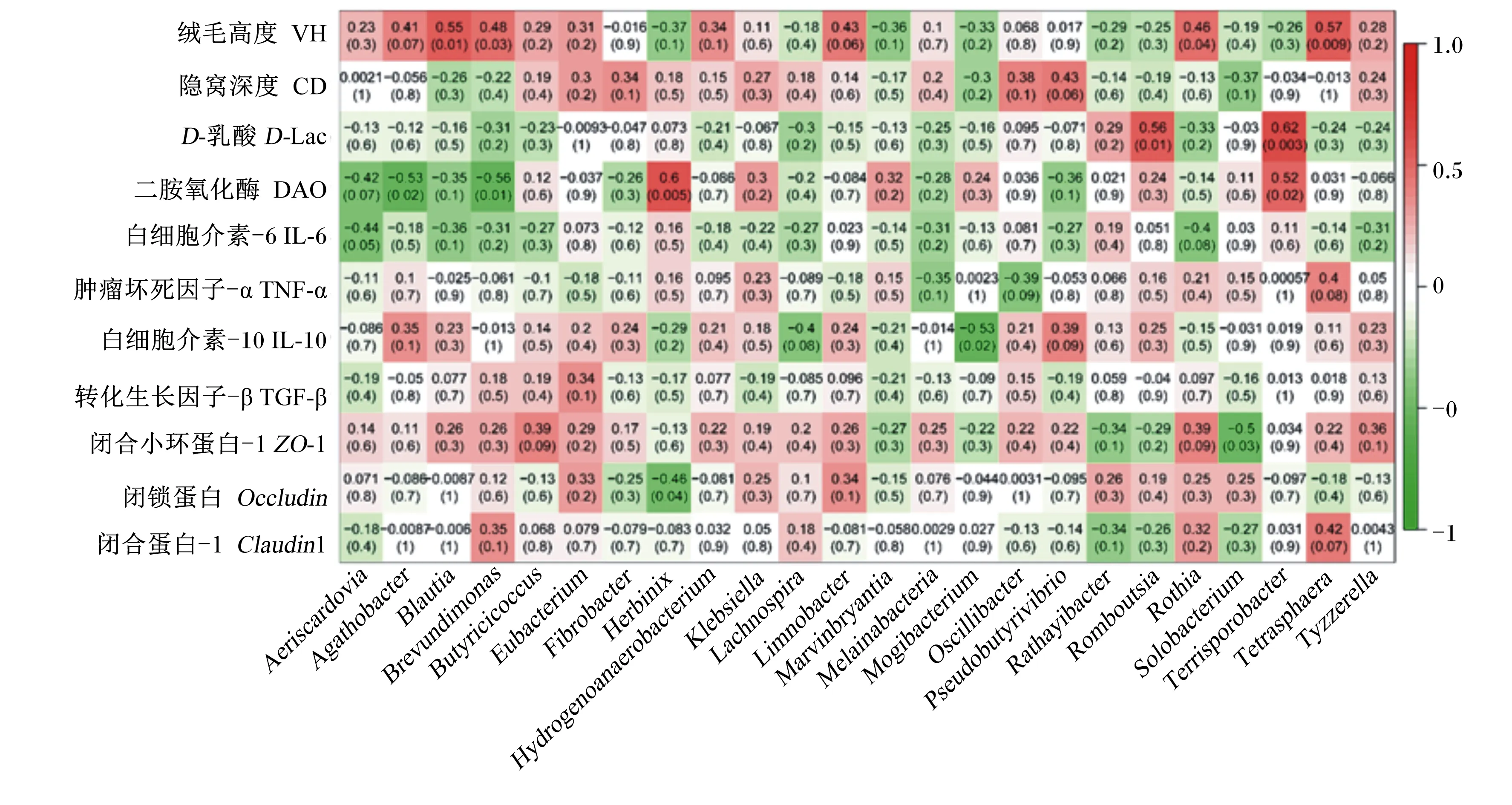
Aeriscardovia:气斯卡多维亚氏菌属;Agathobacter:无杆菌属;Blautia:布劳特氏菌属;Brevundimonas:短波单胞菌属;Butyricicoccus:丁蓖麻球菌属;Eubacterium:真杆菌属;Fibrobacte:纤维杆菌属;Herbinix:赫宾尼菌属;Hydrogenoanaerobacterium:氢厌氧小杆属;Klebsiella:克雷伯氏菌属;Lachnospira:毛螺菌属;Limnobacter:柠檬酸杆菌属;Marvinbryantia:马文伯里安菌属;Melainabacteria:黑水仙菌属;Mogibacterium:艰难杆菌属;Oscillibacter:颤螺旋菌属;Pseudobutyrivibrio:假丁酸弧菌属;Rathayibacter:鸭舌草杆菌属;Romboutsia:罗姆布茨菌属;Rothia:罗斯氏菌属;Solobacterium:梭菌属;Terrisporobacter:土孢杆菌属;Tetrasphaera:四球虫属;Tyzzerella:泰泽雷拉菌属。红色表示正相关,绿色表示负相关;每个单元格包含相应的相关性值(括号外)和P值(括号内)。Red means positive correlation, and green means negative correlation; each cell contains the correlation value (out brackets) and P-value (in brackets).
3 讨 论
3.1 凉茶渣对育肥牛空肠组织形态与屏障功能的影响
空肠是动物对饲粮营养成分进行消化与吸收的主要部位,其消化吸收作用主要依赖于肠上的环形皱襞、肠绒毛及绒毛表面的柱状上皮细胞等结构[11]。肠绒毛的存在极大地增加了小肠与食物的接触面积,绒毛高度越高,其消化吸收面积就越大;肠隐窝是肠上皮在绒毛根部下陷至固有层而形成的管状腺,肠隐窝深度代表细胞的生成率,隐窝越浅细胞成熟度越好,分泌功能越好。所以肠绒毛高度和隐窝深度是衡量动物消化吸收能力的2个重要指标[12-13],同时也是肠道机械屏障的依托结构。研究表明,饲粮中添加4%的中草药显著增加了大鼠后段小肠的绒毛高度,对小肠形态与功能的生长发育具有促进作用[14];另外在饲粮中添加中草药能够调理肠道,显著提高肉牛的表观消化率[15]。在本试验中,饲喂凉茶渣的育肥牛空肠绒毛高度显著升高,与前人的研究结果一致。因此推测,凉茶渣在一定程度上能够改变空肠组织形态,进而提高其消化吸收能力。
肠道的屏障功能主要依靠相邻肠道上皮细胞之间的紧密连接结构,对于动物健康至关重要,Occludins、Claudins、ZO-1这3种紧密连接蛋白是紧密连接结构中的关键部分[16-18]。D-Lac主要来自肠道,完整的肠黏膜可以防止D-Lac通过门脉循环进入血液[19],当肠道屏障功能受损时,肠道中大量的D-Lac会被释放到血液循环中[20]。DAO是一种细胞内酶,在哺乳动物小肠绒毛上皮中具有高活性,肠黏膜损伤后,血清DAO浓度会增加[21]。因此血清中的D-Lac和DAO浓度可以反映肠道屏障功能是否受损。研究表明,中草药饲料添加剂能够改善热应激肉牛的肠道炎症,修复肠道受损[15];中药渣能通过刺激ZO-1的表达来增强断奶仔猪肠上皮细胞的屏障功能,改善肠道环境[22]。在本试验中,饲喂凉茶渣的育肥牛血清中D-Lac浓度显著降低,空肠ZO-1的mRNA表达水平显著上调,与前人的研究结果一致。这表明凉茶渣能增强育肥牛空肠的屏障功能,改善肠道环境。
3.2 凉茶渣对育肥牛空肠菌群结构的影响
肠道菌群是机体肠道微生物的集合体,不仅参与机体消化和吸收营养物质的过程,而且能够抵抗病原菌的侵入,对机体健康具有至关重要的作用[23]。影响肠道菌群组成和多样性因素很多,主要包括饮食、环境和年龄,其中饮食在影响肠道菌群结构中尤为重要[24-26]。本研究结果中,OTUs聚类分析发现CN和RE组中特有的OTUs数量分别为1 057和1 107个,表明饲粮中添加凉茶渣使育肥牛空肠菌群物种数目有所增加。
根据物种注释结果,20个样本中最丰富的2个菌门是厚壁菌门和变形菌门,RE组厚壁菌门相对丰度较CN组有所减少,拟杆菌门、变形菌门相对丰度有所增加,且RE组厚壁菌门与拟杆菌门的比值有所降低。研究表明,牛肠道中的主要有益微生物是厚壁菌门和拟杆菌门[27],厚壁菌门内的瘤胃球菌可通过发酵纤维二糖和纤维素产生甲酸与乙酸[28],拟杆菌门的细菌可利用葡萄糖发酵产生乙酸、琥珀酸等[29]。厚壁菌门与拟杆菌门的比值是反映肠道菌群紊乱的重要指标,其升高对动物健康是不利的[30-31]。同时,厚壁菌门与拟杆菌门的比值也与机体的胖瘦程度有关,肥胖机体肠道菌群中厚壁菌门与拟杆菌门的比值更高[32]。变形菌门中包括很多病原菌,数量过多时会引发肠道炎症,但本试验结果表明RE组血清炎症因子浓度与CN组并无显著差异。此外,瘤胃酸中毒时期,瘤胃中厚壁菌门相对丰度增加,拟杆菌门相对丰度下降[33]。上述分析说明凉茶渣在一定程度上会影响肉牛的育肥效果,但是牛体内脂肪沉积过多会导致内分泌功能紊乱,无法正常供应机体所需的糖分[34]。因此从总体而言,凉茶渣能够维持育肥牛肠道菌群稳态,减少疾病的发生。
在属水平上,与CN组相比,RE组Rothia、Blautia相对丰度显著增加,Romboutsia相对丰度显著减少。Blautia是一种有益菌,其产生的丁酸酯可通过免疫调节来增强抗菌作用[35];Rothia能够降解饲料中的蛋白质,有助于肠道对营养物质的消化吸收[36],而Romboutsia是肠道菌群失衡的生物标志物[37]。这说明凉茶渣能够使育肥牛空肠菌群有益菌数量增加,有害菌数量减少,改善肠道稳态。
Alpha多样性分析反映了样品物种丰富度和多样性,RE组的Observed_species指数显著高于CN组,表明RE组菌群物种数目显著高于CN组。对于Beta多样性分析,Anosim方法得出R=0.159,P=0.011,表明组间微生物群落结构差异显著。Alpha、Beta多样性分析结果说明凉茶渣能够使育肥牛肠道菌群组成和相对丰度发生显著变化。
3.3 育肥牛空肠菌群与其组织形态、屏障功能的相关性
众多研究结果表明肠道菌群影响其组织形态和功能[38-39],而且肠道菌群的代谢产物对肠道健康也有重要的影响,比如代谢产物短链脂肪酸可以促进肠上皮细胞的增殖和分化,增加ZO-1和Occludin的mRNA表达水平,增强肠道屏障功能[40]。Pearson相关性分析结果中,空肠绒毛高度与Blautia、Brevundimonas、Rothia、Tetrasphaera相对丰度呈显著正相关。Blautia可能是通过代谢产物丁酸酯的抗菌作用减少肠道炎症[35],从而促进绒毛增长;Rothia可能是通过降解饲料蛋白为绒毛增长提供能量[36]。血清中D-Lac浓度与Romboutsia、Terrisporobacter相对丰度呈显著正相关,DAO浓度与Herbinix、Terrisporobacter相对丰度呈显著正相关。Romboutsia是肠道菌群失衡的生物标志物[37],Terrisporobacter与肠道炎症有关[41],从侧面论证了血清中D-Lac和DAO浓度可以反映肠道屏障功能是否受损。此外,肠道菌群的变化还使动物血清中炎症因子浓度、紧密连接蛋白基因的mRNA表达水平发生相应变化。这部分结果说明空肠菌群能通过自身或代谢产物对其组织形态、炎症反应、屏障功能产生一定程度的影响。
4 结 论
凉茶渣替代象草能够改变育肥牛空肠组织形态,增强空肠屏障功能,改善空肠菌群组成和相对丰度,促进肠道健康。
