间充质干细胞外泌体研究热点分析与前景展望
2022-03-09刘慧杨淑娇李玉霞
刘慧,杨淑娇,李玉霞
作为干细胞临床治疗最常用的细胞类型之一,间充质干细胞(MSCs)是基质来源的成体干细胞,主要存在于骨髓、牙髓、脂肪、脐带等结缔组织和器官间质中。近年的研究发现,移植后的干细胞能够成功迁移,并定向分化修补缺损组织的比例十分有限,且移植后产生治疗效应的时间与其所需的漫长的迁移分化时间不符,更支持 MSCs 通过旁分泌的机制来发挥作用。研究发现 MSCs 的作用机制是由于其旁分泌因子和外泌体/微囊泡的作用[1],其中可能主要由囊泡中包含的旁分泌因子介导[2]。细胞外囊泡(extracellular vesicles,EV)目前被认为是通过生物活性脂质、蛋白质和RNA 转移进行细胞间通讯的重要信使。外泌体直径为 30 ~150 nm,当多泡体与细胞膜融合时释放到细胞外,外泌体富含许多生物活性分子,如脂质、蛋白质、mRNA、转移 RNA(tRNA)、长链非编码 RNA(lncRNA)、微小 RNA(miRNA)和线粒体 DNA(mtDNA)[3]。外泌体被释放到细胞外,可以被微环境中的靶细胞吸收,也可以通过生物体液运送到远处[4]。
使用外泌体的优势在于可以避免 MSCs 的副作用,避免产生 MSCs 移植相关的潜在肺栓塞[5],以及干细胞的潜在分化作用。一般认为干细胞发挥作用,主要通过两种途径。第一种是细胞分化为基础的治疗:联合应用足够数量的外源性干细胞、生物活性支架和细胞因子以达到组织的修复与再生。第二种是无细胞治疗(以干细胞旁分泌外泌体为主)。细胞分泌的 EV 或者微囊泡是细胞相互交流的一种方式,作为干细胞旁分泌活动的重要方式,在组织再生中发挥重要作用。MSCs 的免疫调节作用是其独特能力,且初步数据表明,MSC 的一些免疫调节特性能转移到它们的外泌体中。MSCs 来源的外泌体可调控固有免疫与适应性免疫应答,通过抑制 T 淋巴细胞功能,降低 B 细胞活化、增殖与分泌,影响巨噬细胞分化与树突状细胞成熟,抑制自然杀伤细胞的细胞毒活性来发挥其免疫调控作用,从而提高MSCs 外泌体衍生药物递送载体的寿命和药物的生物利用度。而且,越来越多的证据显示 MSC 相比其他细胞能产生大量的外泌体。通过测量外泌体相关蛋白 CD81 的量来评估不同细胞系中外泌体的水平,发现 MSC 外泌体的产量最高,用MSCs 产生外泌体能降低外泌体的生产成本。因此 MSCs外泌体研究有望成为再生医学治疗方案的未来发展方向。
1 研究方法
对 Web of Science 核心数据库、临床试验数据库进行关键词的系统检索,然后利用文献分析软件VOSviewer1.6.16 版本进行数据分析。VOSviewer 是荷兰莱顿大学科技研究中心开发的一款建立于可视化技术的处理文献知识单元软件,主要面向文献数据,对科技文献进行网络可视化分析,以发现科学技术内容的热点与内在关系,获得可视化知识图谱,在文献数据知识图谱系统分析的基础上,总结关键领域文献研究进展。
2 文献分析结果
截至 2020年,在 Web of Science 数据库共检索出1550 篇相关文献,文献数据结果显示,间充质干细胞外泌体相关研究文章于 2007年开始出现,此后呈现缓慢增长趋势,并于 2017年出现相关文献的快速增长(图1)。其中我国以 774 篇相关文献居于首位,美国以 350 篇相关文献居于第二位,意大利以 103 篇文献居于第三位。

图1 2007 - 2020年间充质干细胞外泌体文献发表情况
2.1 间充质干细胞外泌体相关研究热点主题分析
通过 VOSviewer 对间充质干细胞外泌体相关文献的关键词进行分析,设定频次大于等于 5 次为高频关键词,建立共词矩阵并绘制关键词共现网络图谱。从高频关键词可以看出,该领域的研究热点聚集于间充质干细胞外泌体的促增殖与分化、作用机制、炎症调节、损伤修复、肿瘤之间的关系等方面(表1)。

表1 间充质干细胞外泌体研究高频关键词
2.2 关键词共现知识网络
通过 VOSviewer 进行关键词共现聚类分析,采用聚类视图进行关键词共现展示。在聚类视图中,每个节点代表1 个关键词,节点越大,说明该关键词共现的频次越高,1 个颜色代表1 个聚类,聚类是由共现频次高的关键词或术语构成,图中的连线代表连接的 2 个关键词至少有 1 次共现在 1 篇文献里,共现频次越高连接线越粗。通过对间充质干细胞外泌体相关文献关键词共现分析,共有 8 个聚类(图2,表2)。

表2 间充质干细胞外泌体相关研究主题关键词表

图2 间充质干细胞外泌体相关研究关键词共现聚类图
2.3 间充质干细胞外泌体领域研究趋势
间充质干细胞外泌体相关研究从 2017年进入快速期。结合时间,从该领域的文献关键词聚类(图3)可以看出,从 2007 - 2017年,间充质干细胞外泌体领域开展的主要是外泌体机制方面的基础研究;2017 - 2018年,主要进行的是外泌体表达、分化、生长、再生等方面的研究,并初步开始了外泌体在疾病治疗中的探索和尝试;2018年至今,随着对间充质干细胞外泌体的了解和研究,开始了外泌体用于更多疾病治疗中的探索,逐步开始了外泌体在心脏疾病、肾脏疾病、骨科疾病、炎症等相关疾病治疗中的尝试。
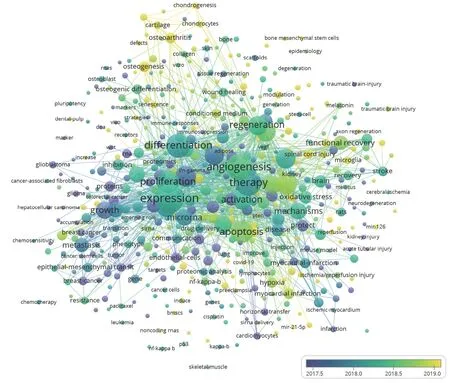
图3 间充质干细胞外泌体领域关键词共现聚类图(标签视图)
2.4 国家合作网络
从国家合作网络来看,在间充质干细胞外泌体研究方面,中国和美国合作最为密切(图4),除此之外,中国的主要合作国家还有德国、新加坡、澳大利亚等,美国的主要合作国家还有意大利、德国、法国、澳大利亚等。

图4 间充质干细胞外泌体相关研究国家合作网络
3 热点研究领域研究现状
通过主题词、共被引聚类分析结果显示肾脏疾病、再生修复、心脏疾病、骨科疾病、炎症为间充质干细胞外泌体研究热点领域。以下结合聚类节点文献,通过肾脏疾病、伤口愈合与再生修复、免疫调节等领域进展,以勾勒 MSCs 外泌体未来的发展。
3.1 肾脏疾病
间充质干细胞外泌体在急性肾损伤和慢性肾病实验动物中显示出潜在的治疗效应。患有肾缺血再灌注损伤的大鼠经静脉注射人脐带源性 MSCs(huMSCs)外泌体,通过增加促血管生成因子血管内皮生长因子(VEGF)表达,可以增加肾毛细血管密度并减少纤维化[6],脂肪间充质干细胞外泌体减轻实验动物肾脏炎症,有效降低肾静脉中 TNF-α、IL-6 和 IL-1β 促炎细胞因子水平,显示了外泌体的免疫调节潜力[7]。人骨髓间充质干细胞外泌体通过诱导肾小管细胞增殖可以加速 SCID 小鼠甘油诱导的急性肾损伤的形态和功能恢复,并增强肾小管上皮细胞对细胞凋亡的抵抗力[8]。人骨髓间充质干细胞衍生的外泌体含有胰岛素样生长因子-1 受体(IGF-1R)mRNA,促进受损肾小管细胞的外泌体增殖和修复[9]。MSCs 的三维培养使外泌体获得更高的产量,可以有效减轻顺铂诱导的小鼠急性肾损伤,表现为肾功能改善、肾小管病理变化减弱、炎症因子减少以及 T 细胞和巨噬细胞浸润受到抑制[10]。
3.2 伤口愈合和再生
间充质干细胞促进损伤修复、组织再生和抗衰老的能力非常显著,MSCs 外泌体也具有类似的潜力。通过介导细胞之间的相互作用并刺激细胞增殖再生,MSCs 外泌体可用于治疗多种疾病。例如,干细胞衍生的外泌体参与转移miRNA 并影响信号转导途径进入靶细胞,可作为 miRNA治疗与年龄相关的肌肉骨骼疾病[11],可以促进皮肤伤口愈合[12]和神经再生[13]。MSCs 外泌体或 EVs 通过激活相关受体和通路发挥作用,MSCs 外泌体通过激活 VEGF 受体和重要的促血管生成途径(SRC、AKT 和 ERK),从而加速后肢缺血的恢复[14]。同时 MSCs 外泌体或 EV 中的mRNAs 在组织再生和年龄相关疾病中发挥重要作用。然而,鉴于目前对 MSCs 外泌体的认识还不成熟,还需要进一步的研究来探索分子机制和信号通路,MSCs 外泌体的特异性和细胞间通讯需要更深入的讨论,并找出可能赋予MSCs 外泌体治疗特性的差异[15]。
3.3 免疫调节
MSCs 外泌体富含 MSC 来源的生物活性分子(mRNA和 miRNA、酶、细胞因子、趋化因子、免疫调节和生长因子),可调节免疫细胞的表型、功能、存活和归巢[16]。MSCs外泌体的免疫调节机制依赖于向炎症免疫细胞(M1 巨噬细胞、DC 和 Th1/Th17 细胞)传递免疫调节 miRNA 和免疫调节蛋白,使其表型转化为抗炎和免疫抑制细胞[17]。这些过程与先天性和适应性免疫细胞有关,其中巨噬细胞、CD4+Th1、Th17 和 Treg 细胞及其免疫调节 miRNA 至关重要。相关研究显示 MSCs 衍生的 EV 表达几种黏附分子(CD29、CD44 和 CD73),使得它们能够归巢到受伤和发炎的组织。在 AKI 小鼠模型中,MSC-EVs 主要积聚在发炎的肾脏中[18]。
3.4 治疗心脑血管疾病
心血管疾病是全球发病率和死亡率最高的疾病之一,在临床前研究中,MSCs 衍生的外泌体用于治疗心血管疾病(CVD),例如急性心肌梗死、脑卒中、肺动脉高压和败血性心肌病。MSCs 来源的外泌体在心肌再生中具有治疗潜力。通过防止心肌细胞凋亡、诱导缺血区域的新血管生成以及促进心脏干细胞(CSC)的存活、血管生成能力和自我更新能力来促进心肌再生。间充质干细胞 MSCs 疗法已被研究作为一种潜在的治疗选择,以帮助替换丢失的心肌细胞并改善心脏功能[19]。在大鼠心肌缺血损伤模型中,发现人脐带 MSC-exosomes 可减少心肌细胞纤维化,抑制细胞凋亡,促进增殖[20]。脂肪来源的 MSC(AdMSC)来源的外泌体导致 H9C2 细胞在体外缺氧/复氧(H/R)下的细胞活力显著增加,并且 AdMSC 衍生的外泌体给药保护缺血心肌免受心肌缺血再灌注的影响[21]。MSC 疗法在促进卒中恢复方面已显示出临床前和临床上的成功,并且 MSC 外泌体在各种卒中恢复的临床前模型中显示出前景。在创伤性脑损伤(TBI)的大鼠模型中,MSCs 外泌体的给药已被证明可以增强神经发生和血管生成,并改善空间学习和感觉运动功能恢复[22]。使用金纳米粒子作为标记剂跟踪鼻内给药外泌体的迁移和归巢模式,发现骨髓间充质干细胞外泌体MSC-exo 在给药后 96 小时内在脑疾病病理相关的小鼠模型大脑区域中特异性靶向并积累,而在健康对照中,它们在24 小时内显示出弥散迁移模式和清除。病理大脑中的神经炎症信号与 MSC-exo 积累高度相关显示归巢机制是炎症驱动[23]。
4 外泌体临床试验研究
目前全球共有十余项外泌体临床治疗研究,目前的研究重点为确定最佳剂量、外泌体给药的适当时间窗口以及达到最大疗效且无不良反应的给药途径。通过临床试验评估干细胞外泌体治疗方法在人类疾病治疗中的可行性和安全性。美国临床试验数据库(clinicaltrials.gov)共检索出 12 项临床数据(表3),其中,临床试验地址在中国的有 7 项,美国 2 项,伊朗 1 项,埃及 1 项,另外 1 项试验地址不详。在12 项临床试验中,试验方向主要集中于间充质干细胞外泌体在阿尔茨海默病、肺部感染、急性呼吸窘迫综合征、新冠病毒感染、干眼症等疾病方面的治疗作用。在 12 项临床试验中,申办方/合作方为瑞金医院/西比曼生物科技集团占了 5 项,其临床试验地址均为瑞金医院,试验分别为间充质干细胞外泌体在阿尔茨海默病、肺部感染、急性呼吸窘迫综合征、新冠病毒感染等的效果研究。由于新冠疫情的暴发,中国和美国分别开展了间充质干细胞外泌体治疗新冠病毒的临床试验研究,其中,中国方面是由瑞金医院、上海市公共卫生临床中心、武汉市金银潭医院、西比曼生物科技集团联合在瑞金医院开展的临床试验,美国由 AVEM HealthCare 在密森社区医院(Mission Community Hospital)开展。
5 小结
间充质干细胞通过其分泌的外泌体靶向组织受损细胞,恢复组织稳态并使细胞能够修复和再生,并具有免疫调节与炎症抑制能力。由于间充质干细胞外泌体具有诸多优势,取得了很多有希望的成果并已经进入临床试验阶段,未来必将在医学领域取得重大进展。但总的来说,生物治疗方案的探索还处于起步阶段。目前,间充质干细胞领域还存在一些瓶颈问题,如外泌体分离纯化的方法尚未形成适应于大规模药物制剂应用的规范方法,影响研究结果的可重复性。外泌体进入受体细胞后的转归、生物分布、药代动力学和靶向递送器官分布的特异性以及疾病的治疗机制尚未完全阐明。与单克隆抗体产品相比,其规模量产、成分异质性、保存需要冷链等因素均是产业化发展、用于临床标准化需要解决的问题。相信随着个性化和精准治疗的推进,间充质干细胞外泌体的临床应用也将随着干细胞领域的快速发展,取得更多突破。
