雌性牦牛主要生殖器官中DBI的表达与定位分析
2022-03-08王强龙潘阳阳闫翠霞张同享何翃闳徐庚全王立斌樊江峰余四九
王强龙,潘阳阳,闫翠霞,张同享,何翃闳,崔 燕,徐庚全,王立斌,樊江峰,余四九
(甘肃农业大学动物医学院 甘肃省牛羊胚胎工程技术研究中心,兰州 730070)
地西泮结合抑制因子(disazepam binding inhibitor,DBI)于1983从鼠的脑组织中分离纯化得到,与中、长链脂酰辅酶A具有高亲和力,在细胞内负责酰基辅酶A(Acyl-CoA)的转运和储存,进而调节脂肪酸的合成与代谢,因此又称为脂酰辅酶A结合蛋白(acyl-CoA binding protain,ACBP)[1-2]。研究表明,DBI在类固醇生成细胞中高度表达,可以通过与线粒体外膜上的受体(peripheral-type benzodia-zepine receptor, PBR) 结合促进胆固醇摄入线粒体并且转化为孕烯醇酮,从而调节类固醇激素生物合成与代谢[3-4]。报道称,ACBP是一种神经肽,能够抑制安定与γ-氨基丁酸结合的GABA受体[5],在人体中,ACBP是酰基辅酶A结合结构域(acyl-CoA-binding domain-containing,ACBD)家族的6个成员之一[6]。DBI作为高度保守蛋白,表达于各种类型细胞,是一个具有管家基因性质的因子[7],能对胆固醇的合成、胰岛素的分泌、脂肪酸的合成与代谢产生重要调节作用[8]。存在于真核生物和原核生物中,为细胞的生命活动提供重要的能源物质,保障细胞的正常生长。
牦牛(Bosgrunniens)常年生活在3 000~6 000 m的高寒低氧高海拔地区[9]。长期适应恶劣环境,能够充分利用高原牧区的物质资源,为当地牧民提供重要的生活保障和经济来源。同时,牦牛属季节性发情动物,7~10月份为发情季节[10],长期生活在年平均气温0 ℃的环境中[11]。而且,较低的胚胎着床率和产犊率以及较高的流产率等问题均可导致牦牛的繁殖力低下[10,12]。因此,如何有效提高牦牛繁殖率成为焦点问题。研究发现,DBI在类固醇激素生成和妊娠维持中发挥重要生理作用,其在自然流产绒毛组织中表达量较正常妊娠低[13]。报道称,DBI在中枢神经系统、垂体前叶、肾上腺皮质、甲状腺、肝、胸腺和睾丸中强烈表达[14],但目前未见有关雌性牦牛生殖方面的报道。
本研究以母牦牛作为试验动物,通过qPCR、Western blotting、IHC等技术检测DBI在牦牛生殖器官的表达情况,确定其是否参与了牦牛的生殖过程。这些结果对进一步研究牦牛DBI基因在高原哺乳动物生殖生理中的生物学功能具有重要意义。
1 材料与方法
1.1 材料
1.1.1 试验样品 在青海省西宁市定点屠宰场,选择5头健康牦牛,待劲动脉放血之后,快速采集不同时期(卵泡期、黄体期、妊娠期)的卵巢、输卵管和子宫组织,置于加双抗(青霉素、链霉素)的37 ℃生理盐水中,经过清洗,选择组织,部分置于液氮罐中,部分用10%的福尔马林溶液固定,带回实验室。
1.1.2 主要仪器、试剂 PCR仪(Eppendorf, 德国)、荧光定量PCR仪(Roche生物,上海)、动物组织RNA提取试剂盒、RIPA 裂解液(全式金,北京);Go ScriptTMReverse Transcription System购自Promega,Taq PCR Master Mix、StarPrep Gel Extraction Kit 购自 GenStar,SYBR Premix Dimer EraserTM(2×)、Anti- DBI antibody(ab232760, abcam, 英国);Goat Anti-rabbit IgG antibody (bs-0295G,博奥森,北京);DAB显色试剂盒(ZSGB-bio,ZILZ-9019);SP试剂盒(Bioss,北京)、4×蛋白上样Buffer、氯仿、异丙醇、甲醛、乙醇等其他试剂均为国产分析纯生化试剂。
1.2 方法
1.2.1 组织总RNA的提取和cDNA的合成 按照TransZol 操作说明提取牦牛卵巢、输卵管和子宫组织总RNA,通过1%琼脂糖凝胶电泳检测RNA的完整性,采用分光光度计检测RNA浓度,将OD260 nm/OD280 nm值控制在1.8~2.0;再参照两步法反转录试剂盒说明反转录合成 cDNA,-20 ℃保存备用。
1.2.2 引物设计与验证 设计qPCR验证引物DBI-F/R参考文献[13],引物由上海生工生物公司合成(表1)。以牦牛不同时期卵巢、输卵管和子宫cDNA为模板进行引物验证,体系为20 μL:cDNA 1 μL,上、下游引物各0.5 μL,Taq PCR mix 10 μL,Free water 8 μL;PCR反应条件:95 ℃ 3 min;95 ℃30 s,52.5 ℃ 30 s,72 ℃ 16 s,35个循环;72 ℃ 10 min, 4 ℃保存;反应结束后用1%的琼脂糖凝胶电泳检测反应产物。

表1 DBI基因和内参基因引物序列
1.2.3 qPCR检测DBImRNA的相对表达量 qPCR 反应体系为20 μL:cDNA 1 μL,上、下游引物各0.5 μL,2×Transtart Tip Green qPCR SuperMix 10 μL,Free water 8 μL。反应程序为:95 ℃预变性30 s;95 ℃变性5 s,52.5 ℃退火16 s,72 ℃延伸30 s,35个循环;样品重复4次。每个模板以β-actin为内参作为对照。程序运行结束,保存循环阈值(Ct),采用2-ΔΔCt方法进行相对表达量分析。
1.2.4 组织蛋白样品的制备 将牦牛卵巢、输卵管和子宫组织进行快速冷冻研磨,取110 mg组织样加入蛋白裂解液,置于冰盒内充分反应3 h,放入超速离心机,4 ℃12 000 r·min-1,离心操作10 min。 蛋白上样缓冲液与蛋白上清液按1∶3混合,100 ℃金属浴进行蛋白变性10 min,再冷却5 min, 变性操作完成后,样品置于-20 ℃保存待用。
1.2.5 Western blotting检测牦牛DBI蛋白的表达 制备蛋白分离胶(15%)、浓缩胶(5%),进行SDS-PAGE检测,将电压调至70 V待样品到达浓缩胶与分离胶界面,再将电压调至110 V直至完成,采用湿转膜法100 mA恒流转10 min (DBI) 或43 min (β-actin) 将蛋白转印至PVDF膜上,用PBST洗去膜上残留的转膜液,5%的脱脂牛奶封闭,置于摇床室温封闭3 h,用PBST清洗3次,每次5 min;加入DBI抗体(1∶3 000稀释),4 ℃孵育过夜,再用PBST清洗5次,每次5 min,加入二抗Goat Anti-rabbit IgG(1∶5 000稀释),37 ℃摇床孵育50 min,完成之后用PBST洗涤6次,每次10 min。操作完成之后在PVDF膜上滴加电化学发光液,避光孵育2 min,使用化学发光仪进行检测,根据成像结果,利用Image J灰度值分析DBI蛋白相对表达量。
1.2.6 IHC对牦牛DBI蛋白进行定位 将固定于福尔马林溶液的卵巢、输卵管和子宫样品切成(0.5×0.5×0.5) cm3大小,置于锥形瓶内,自来水冲洗24 h,上行梯度酒精脱水后,将组织用酒苯透明后浸蜡,最后进行包埋。使用切片机进行连续性切片,切片厚度设置为4 μm。切片干燥后,烘片机上60 ℃ 烘烤6 h, 再进行下行梯度酒精脱蜡水化,蒸馏水浸泡5 min,PBS浸泡10 min。抗原修复采用柠檬酸盐缓冲液微波热修复法(在0.01 mol·L-1的柠檬酸盐中缓缓放入载玻片,微波炉内煮沸,中火15 min),自然冷却至室温。用PBS清洗3次,每次5 min。利用3% H2O2溶液(SP 试剂盒)在37 ℃ 温箱内阻断 15 min,PBS清洗3次,每次5 min。在室温条件下,将载玻片置于湿盒内封闭液(SP试剂盒A液)封闭15 min,一抗(Anti- DBI antibody)1∶500 稀释后,4 ℃ 孵育过夜,阴性对照滴加PBS。PBS清洗3次,每次5 min。滴加二抗(SP试剂盒 B 液)后置于37 ℃温箱内孵育 15 min,再用PBS清洗3次,每次5 min。滴加三抗(SP试剂盒 C液)37 ℃温箱内孵育15 min。PBS清洗3次,每次5 min。在DAB 显色液(浓缩DAB溶液∶DAB底物液=1∶20)中进行显色(20 s),终止显色,置于苏木精复染90 s,盐酸酒精分化2 s,最后自来水冲洗返蓝 15 min, 梯度酒精脱水,滴加中性树脂封片,拍照。
1.2.7 数据处理与图像分析 将试验数据用SPSS21.0软件进行单因素方差分析和显著性分析,数据用“平均值±标准误”表示。P>0.05表示差异不显著,P<0.05表示差异显著。
2 结 果
2.1 PCR验证DBI短链引物
PCR扩增DBI产物大小为124 bp(图1),且条带单一,符合预期,说明引物特异性良好,可用于后续qPCR检测。

M.DNA相对分子质量标准;1.卵巢;2.输卵管;3.子宫M. 2 000 bp ladder; 1. Ovarian; 2. Fallopian tube; 3. Uterus图1 DBI荧光定量引物验证Fig.1 Verification of DBI fluorescent quantitative primers
2.2 qRT-PCR和Western blotting检测卵巢中DBI的表达
qPCR数据显示,DBImRNA在不同时期的卵巢组织中具有明显的表达量差异(图2A)。在妊娠期卵巢组织中表达量最高,黄体期次之,卵泡期最低。Western blotting结果分析表明,DBI蛋白在不同繁殖阶段卵巢组织中均有表达(图2B),不同时期的卵巢组织中具有明显的表达量差异(图2C),妊娠期表达量最高,卵泡期和黄体期较低。
2.3 qRT-PCR和Western blotting检测输卵管中DBI的表达
qPCR数据显示,DBImRNA在不同时期的输卵管组织中具有明显的表达量差异(图 3A)。在黄体期输卵管组织中表达量最高,卵泡期次之,妊娠期最低。Western blotting结果分析表明,DBI蛋白在不同繁殖阶段输卵管组织中均有表达(图3B),不同时期的输卵管组织中具有明显的表达量差异(图3C),黄体期输卵管表达量最高,卵泡期次之,妊娠期表达量较低。

A. DBI mRNA在卵泡期、黄体期和妊娠期卵巢中的表达;B. DBI蛋白在卵泡期、黄体期和妊娠期卵巢中的表达检测;C. DBI蛋白在卵泡期、黄体期和妊娠期卵巢中的表达。不同小写字母表示差异显著(P<0.05), 相同字母表示差异不显著(P>0.05),下同A. The expression of DBI mRNA in ovary at follicular, luteal and gestation stages; B. Expression detection of DBI protein in ovary at follicular, luteal and gestation stages; C. The expression of DBI protein in ovary at follicular, luteal and gestation syages. Different lowercase letters mean significant difference (P<0.05), and the same letters mean on significant difference (P>0.05), the same as below图2 DBI 在牦牛不同时期卵巢中的表达Fig.2 Expression of DBI in ovary of yaks at different stages

A. DBI mRNA在卵泡期、黄体期和妊娠期输卵管中的表达;B. DBI蛋白在卵泡期、黄体期和妊娠期输卵管中的表达检测;C. DBI蛋白在卵泡期、黄体期和妊娠期输卵管中的表达A. The expression of DBI mRNA in fallopian tube at follicular, luteal and gestation stages;B. Expression detection of DBI protein in fallopian tube at follicular, luteal and gestation stages;C. The expression of DBI protein in fallopian tube at follicular, luteal and gestation stages图3 DBI在牦牛不同时期输卵管中的表达Fig.3 Expression of DBI in fallopian tube of yaks at different stages
2.4 qRT-PCR和Western blotting检测子宫中DBI的表达
qPCR数据显示,DBImRNA在不同时期的子宫组织中具有明显的表达量差异(图4A)。在妊娠期子宫组织中表达量最高,黄体期次之,卵泡期最低。Western blotting结果分析表明,DBI蛋白在不同繁殖阶段子宫组织中均有表达(图4B),不同时期的子宫组织中具有明显的表达量差异(图4C),妊娠期子宫表达量最高,卵泡期和黄体期表达量较低。
2.5 免疫组织化学对牦牛DBI蛋白进行定位
通过IHC发现,DBI分子在卵巢中主要表达于卵巢生殖上皮、颗粒细胞、卵泡膜细胞和黄体细胞(图5);在输卵管中主要表达于黏膜上皮细胞(图6);在子宫中表达于基质细胞和子宫腺(图7)。

A. DBI mRNA在卵泡期、黄体期和妊娠期子宫中的表达;B. DBI蛋白在卵泡期、黄体期和妊娠期子宫中的表达检测;C. DBI蛋白在卵泡期、黄体期和妊娠期子宫中的表达A. The expression of DBI mRNA in uterus at follicular, luteal and gestation stages; B. Expression detection of DBI protein in uterus at follicular, luteal and gestation stages; C. The expression of DBI protein in uterus in follicular, luteal and gestation stages图4 DBI在牦牛不同时期子宫中的表达Fig.4 Expression of DBI in uterus of yaks at different stages

A.卵泡期卵巢;B. 黄体期卵巢;C. 妊娠期卵巢; D.阴性对照。SG. 颗粒层; CL. 颗粒细胞A. Ovary at follicular stage; B.Ovary at luteal stage; C. Ovary at pregnant stage; D. Negative control. SG. Granular layer; CL. Granulosa cells图5 DBI 蛋白在牦牛不同时期卵巢中的分布情况(大图200×,小图400×)Fig.5 Distribution of DBI protein in ovary of yaks at different stages(large figure 200×, small figure 400×)

A.卵泡期输卵管;B. 黄体期输卵管;C. 妊娠期输卵管; D.阴性对照。EM. 黏膜上皮A. Fallopian tube at follicular stage; B.Fallopian tube at luteal phase; C. Fallopian tube at pregnant stage; D. Negative control. EM. Mucosal epithelium图6 DBI 蛋白在牦牛不同时期输卵管中的分布情况(大图200×,小图400×)Fig.6 Distribution of DBI protein in fallopian tubes of yaks at different stages(large figure 200×, small figure 400×)
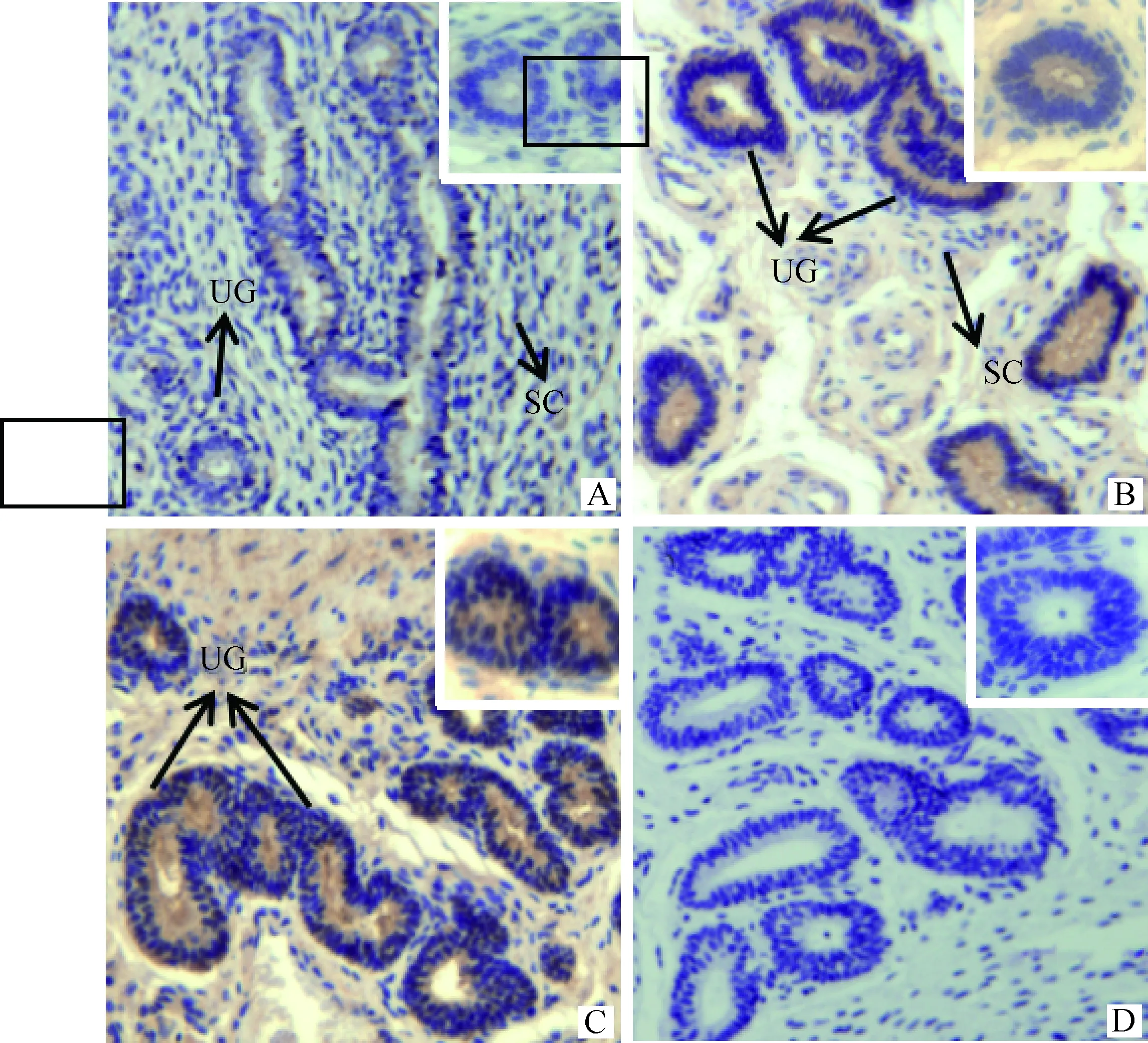
A.卵泡期子宫;B. 黄体期子宫;C. 妊娠期子宫; D.阴性对照。UG. 子宫腺; SC. 基质细胞A. Uterus at follicular phase; B. Uterus at luteal phase; C.Uterus at pregnant phase ; D. Negative control. UG. Uterus gland; SC. Stroma Cell图7 DBI 蛋白在牦牛不同时期子宫中的分布情况(大图200×,小图400×)Fig.7 Distribution of DBI protein in uterus of yaks at different stages(large figure 200×, small figure 400×)
3 讨 论
近年来,地西泮结合抑制因子(DBI)受到广泛关注,在人[13]、槟榔江水牛[15]、大鼠、猪、青鳉鱼[8]、非洲爪蟾和酵母等不同物种中均有研究。研究发现,DBI能够参与调控滋养细胞的合体化进程,自然流产可能与胎盘中DBI表达量低具有内在联系,说明DBI的高表达在动物妊娠维持过程中具有重要作用[13]。DBI能够与中、长链酰基辅酶A结合,参与磷脂、甘油酯、胆固醇的合成,以及类固醇激素的调节[16-17]。报道称,敲低DBI表达,类固醇激素合成酶表达量下降,如CYP11A1、HSD3β1、CYP19A1等,类固醇激素的生成也受到限制[13]。在哺乳动物代谢活性高的组织中DBI的表达量更高,如肝、脂肪组织、皮肤和外分泌腺体等[18]。
卵巢是重要的生殖器官,能够分泌生殖相关激素和排出卵子[19]。DBI在妊娠期卵巢中相对表达量最高,黄体期卵巢中相对表达量次之,卵泡期卵巢中的相对表达量最低,不同时期具有明显差异(P<0.05)。但在黄体期DBI蛋白表达存在延迟现象,可能在该时期DBI的表达受到其他激素的调控,造成基因和蛋白表达量不一致的现象。IHC结果表明,DBI主要分布于卵巢生殖上皮、颗粒细胞、卵泡膜细胞和黄体细胞。研究表明,原始卵泡中两个相邻颗粒细胞之间是缝隙连接,次级卵泡中颗粒细胞和卵膜之间是桥粒连接[20]。颗粒细胞向卵母细胞提供营养物质和能量,促进卵母细胞的发育[21]、成熟并维持卵母细胞的正常功能,因此颗粒细胞的状态必然会影响卵母细胞及胚胎质量,从而改变妊娠结局[22]。牦牛妊娠期间,孕激素含量升高,DBI可能受到孕激素反馈调节而表达量上升。DBI和细胞的脂质代谢密切相关,妊娠后期母体需要更多的营养物质以满足能量需要[23]。由此推测,DBI因子与卵巢物质代谢和孕激素合成相关。
输卵管是配子运输通道、受精和早期胚胎发育的场所[24-25],其功能受到雌激素的调控[26]。输卵管功能的失调会导致不孕、宫外孕、胚胎发育异常或雌性动物生产能力下降等[27]。输卵管的功能受到雌激素的影响,随着雌激素的变化,可引起输卵管黏膜在细胞及分子水平的改变,进而影响输卵管的功能[28]。DBI在输卵管不同繁殖时期存在明显差异,其中黄体期输卵管和卵泡期输卵管中DBI的表达量明显高于妊娠期。IHC结果表明,DBI的主要表达部位在输卵管黏膜上皮。雌激素和孕激素可以调控输卵管黏膜上皮细胞的生长、增殖,不同发情周期黏膜上皮细胞的数量和体积均不同[29]。雌激素的含量在生理范围内升高也可以促进输卵管发育,加强节律性收缩的振幅,促进输卵管运动,加速卵子在输卵管中的运行速度,有利于缩短精子与卵子相遇的时间[30]。研究表明,卵泡期血液中雌激素含量高,孕激素含量低,此时输卵管上皮细胞代谢活跃,分裂迅速,分泌细胞分泌能力增加;妊娠黄体形成后,血液中孕激素增多,而雌激素减少,导致输卵管黏膜上皮细胞生长缓慢,纤毛变短,分泌细胞分泌能力下降[31-32]。DBI蛋白可能受雌激素含量的影响参与输卵管上皮细胞的增殖。研究报道,输卵管上皮细胞可支持胚胎的体外发育,且优于其它类型的细胞[33],为早期胚胎发育提供营养物质,推测DBI可能与早期胚胎发育有关。
子宫是哺乳动物早期胚胎附植并发育的场所[34],其结构与功能常常处于变化之中。早期胚胎的成功附植需要子宫和胚胎之间进行极其精密的分子与细胞之间的信息交流[35],同时子宫内膜具备接受胚胎的状态[36-38]。学者认为,子宫的再生变化是由雌二醇引起,依靠孕酮来维持[39]。有研究表明,雌、孕激素的正常水平促进子宫内膜容受性,有利于胚泡植入及胎盘形成、对母体正常的妊娠维持与胎儿的生长发育具有重要作用[13]。DBI 在妊娠期子宫高表达,推测其与孕激素合成,妊娠维持之间存在联系。但是,DBImRNA在黄体期子宫显著高于卵泡期 (P<0.05),而DBI蛋白在黄体期和卵泡期子宫表达无明显差异(P>0.05),可能是由于DBImRNA在翻译过程中受其它因素的调控,存在延迟表达的现象。IHC结果发现,DBI在子宫基质细胞、子宫腺均有表达。研究发现,DBI可以影响滋养细胞的增殖能力,还能通过P450 scc影响滋养细胞合成类固醇激素基因的表达,且DBI低表达可能与自然流产有关[13]。这也进一步说明DBI在妊娠维持过程中具有十分重要的作用。由于雌激素与孕酮的协同作用[40],子宫发育得相当充分,尤其到了妊娠的后期,雌激素和孕酮的分泌同时增加,对子宫组织持续发挥作用,促使子宫腺的发育,为胎儿生长发育做好充足的准备。DBI在妊娠期的高表达量进一步说明DBI参与妊娠后期子宫内环境稳定的调节,营养物质的合成代谢,进而维持妊娠,防止发生流产。
4 结 论
本试验研究了DBI基因在牦牛卵巢、输卵管和子宫中的表达情况,但不同繁殖阶段其表达水平存在显著差异(P<0.05),说明DBI在不同繁殖阶段发挥重要生理作用。揭示DBI与牦牛卵泡早期发育、受精、早期胚胎附植以及妊娠维持存在密切联系,但其发挥作用的具体机制有待进一步的探索。
