卵黄抗体对鸽毛滴虫与白色念珠菌感染的治疗效果
2022-03-08蔡淯涵黄中佐严沛洁王李格李复煌
王 飞,张 禾,蔡淯涵,黄中佐,严沛洁,王李格,孙 鸿,李复煌,何 诚*
(1.中国农业大学动物医学院,北京 100193;2.北京市畜牧总站,北京 100107;3. 北京优帝鸽业有限公司,北京 100188)
鸽毛滴虫(Trichomonasgallinae,T.gallinae)属毛滴虫科(Trichomonadidae)、毛滴虫属(Trichomonas),感染鸽造成鸽口腔黏膜溃疡,呼吸困难[1-3]。白色念珠菌(Candidaalbicans)属隐球菌目、假丝菌属中的酵母样真菌,鸽感染后死亡率高达40%[4]。临床上防治毛滴虫主要依赖甲硝唑、地美硝唑等硝基咪唑类药物[5-6]。肉鸽白色念珠菌防治使用制霉菌素进行预防[7-8]。毛滴虫和白色念珠菌耐药现象日趋严重,严重威胁着食品安全[4]。
卵黄抗体在治疗消化道细菌、真菌以及寄生虫感染方面具有其独特的优势[9-10],关于肉鸽毛滴虫与白色念珠菌卵黄抗体的相关临床应用报道较少。因此,本项目制备鸽毛滴虫与白色念珠菌二联卵黄抗体粉,评价其治疗效果,旨在替代甲硝唑、制霉菌素的临床应用。
1 材料与方法
1.1 材料
180日龄产蛋母鸡,由涿州牧丰家禽有限公司提供。白羽王鸽,25~30日龄,购自北京顺义优帝鸽业有限责任公司。沙氏液体培养基、牛肝浸粉培养基、胎牛血清、763A佐剂、95%β-1,3/1,6葡聚糖、泊洛沙姆188均购自北京广达恒益公司。ab6753兔抗鸡IgY HRP酶标二抗购自Abcam公司。
1.2 毛滴虫、白色念珠菌的分离和鉴定
采集肉鸽口腔拭子,添加1 mL生理盐水,混匀,取100 μL接种牛肝浸液培养基,另取100 μL在沙氏琼脂培养皿上涂布,37 ℃培养24~48 h。毛滴虫培养液用吉姆萨染色和镜检,白色念珠菌进行革兰染色并镜检。
以特异性引物扩增基因组,毛滴虫ITS/5.8S基因引物序列:ITS/5.8S-F(5′-GAACCTGCCGTTGGATCAGT-3′),ITS/5.8S-R(5′-TTCAGT TCAGCGGGTCTTCC-3′)。白色念珠菌ITS1/4基因引物序列:F(5′-TCCGTAGGTGAACCTGCGG-3′),R(5′-TCCTCCGCTTATTGATATGC-3′),回收阳性条带,送北京华大基因有限公司测序验证。
1.3 二联灭活疫苗的制备
分别收集毛滴虫、白色念珠菌培养物,超声波破碎和加热灭活。将毛滴虫、白色念珠菌抗原分别稀释为4×106个·mL-1和4×108cfu·mL-1,抗原比例1∶1混合,添加0.2%的β-1,3/1,6葡聚糖制备水相,以法国赛比克763A佐剂为油相。抗原液与油相按3∶7的比例混合、乳化,转速为3 000 r·min-1,累积6 min,制备油佐剂疫苗。
1.4 卵黄抗体粉制备
以上述制备的二联灭活疫苗皮下注射180日龄产蛋母鸡,0.5 mL·只-1,间隔14 d,免疫 4次。收集免疫鸡蛋,用自制ELISA试剂盒检测卵黄抗体。收集卵黄抗体效价高的鸡蛋蛋黄,加入1.0%泊洛沙姆溶液(pH=7.2),4~8 ℃静置72 h,获得上清。去除上清液中的脂肪,使用30 kD的板式超滤器进行浓缩,浓缩后与麦芽糊精按一定比例混合,以真空低温连续干燥机制成粉剂。
1.5 ELISA检测毛滴虫与白色念珠菌抗体
将3次免疫后14 d的鸽血清作为阳性对照,对照组鸽血清作为阴性对照,对抗原包被浓度、一抗稀释度、一抗反应时间、二抗稀释度、二抗反应时间等参数进行优化。选取阳性值接近于1,且P/N最高的优化条件作为试剂盒推荐方法。
1.6 肉鸽人工感染和治疗试验
动物模型:30只25~30日龄健康白羽王鸽随机分为3组,每组10只肉鸽,1组肉鸽灌服生理盐水为对照,2组肉鸽分别灌服1×106个毛滴虫和1×108cfu白色念珠菌,连续5 d, 剖检肉鸽,观察口腔和嗉囊病理变化。
治疗试验:40只肉鸽随机分为8组,每组5只,4组人工感染1×106个毛滴虫,另外4组人工感染1×108cfu白色念珠菌,持续感染5 d后,4个毛滴虫感染组分别给予0.1 g甲硝唑·只-1,1 g卵黄抗体·只-1,0.5 g卵黄抗体·只-1,0 g卵黄抗体·只-1进行治疗。4个白色念珠菌感染组分别给予20万单位制霉菌素·只-1,1 g卵黄抗体·只-1,0.5 g卵黄抗体·只-1,0 g卵黄抗体·只-1进行治疗,连续治疗5 d。记录肉鸽的发病率以及死亡率。给药后第7天,采集口腔拭子,分离毛滴虫与白色念珠菌并进行计数。剖检和观察口腔、嗉囊黏膜的病理变化。
1.7 统计分析
原始数据用Excel 2010进行处理,运用IBM SPSS Statistics 22对数据进行单因素方差分析,利用t-test比较毛滴虫与白色念珠菌不同免疫次数间卵黄抗体水平差异以及给药后不同组别毛滴虫与白色念珠菌计数的差异,P<0.05表示有显著性差异,P<0.01表示差异极显著。
2 结 果
2.1 毛滴虫、白色念珠菌分离和鉴定
光学显微镜下毛滴虫呈椭圆形或梨形,前端有4根鞭毛,后方有1根鞭毛。白色念珠菌在培养基上呈现表面光滑的白色或乳白色菌落,革兰染色呈染色不均匀的椭圆形。用毛滴虫和白色念珠菌特异性引物扩增片段大小与目的片段大小相符,分别为400和500 bp左右,见图1A、B。阳性条带测序鉴定为毛滴虫与白色念珠菌。

A.毛滴虫ITS特异基因扩增结果;M.DNA相对分子质量标准,分离株1和2为毛滴虫阳性样本;B.白色念珠菌ITS1/4特异基因检测结果; M.DNA相对分子质量标准,分离株3和4为白色念珠菌阳性样本A.PCR result of ITS gene of Trichomonas gallinae;M.DNA marker, Isolates 1 and 2 were positive samples of Trichomonas gallinae;B. PCR result of ITS1/4 gene of Candida albicans;M. DNA marker,Isolates 3 and 4 were positive samples of Candida albicans图1 毛滴虫和白色念珠菌PCR鉴定结果Fig.1 PCR results of Trichomonas gallinae and Candida albicans
2.2 ELISA抗体检测方法建立
毛滴虫抗体的检测优化条件:抗原包被浓度为1×106个·mL-1;一抗稀释度为1∶100;一抗反应条件为37 ℃ 1 h;二抗稀释度为1∶20 000;二抗反应条件为37 ℃30 min。白色念珠菌ELISA法抗原包被浓度为1×107cfu·mL-1;二抗稀释度为1∶30 000;其余检测条件同毛滴虫ELISA检测方法。
优化的ELISA法检测蛋黄中毛滴虫抗体,结果见图2。第1次免疫后抗体上升(P<0.01),第2次免疫后抗体上升到高峰,OD值>0.9。第3次和第4次免疫后抗体增加的趋势低于第2次免疫。但与免疫前相比,免疫后抗体水平极显著上升(P<0.01)。免疫后抗体持续时间达到60 d,OD值>0.85。白色念珠菌抗体上升趋势与毛滴虫抗体相似。第2次免疫抗体达到高峰,平均OD值为0.66。与免疫前相比,免疫后抗体水平极显著上升(P<0.01),如图2所示。浓缩后毛滴虫和白色念珠菌抗体OD值分别可达2.95和2.65。
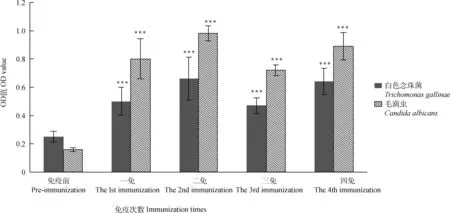
与免疫前相比,***. P<0.01Compared with pre-immunization,***. P<0.01图2 毛滴虫与白色念珠菌卵黄抗体检测Fig.2 Detecting yolk antibody against Trichomonas gallinae and Candida albicans
2.3 人工感染模型建立和治疗试验
动物模型:以分离的毛滴虫与白色念珠菌分别感染肉鸽,5 d后,毛滴虫接种组口腔发现黄色干酪物沉着,排黄绿色水样稀粪。剖检口腔和咽喉黏膜出现白色干酪样沉着物,嗉囊附着黄色结节,发病率为80%。白色念珠菌接种组鸽精神沉郁,排水样稀粪。嗉囊黏膜表面有一层白膜覆盖,局部有溃疡发生,发病率100%,死亡率30%,这显示毛滴虫和白色念珠菌人工感染肉鸽模型建立成功。
治疗试验:毛滴虫0.5 g卵黄抗体组肉鸽精神状态正常,个别肉鸽口腔和咽部黏膜有小溃疡灶。1 g卵黄抗体组剖检后口腔嗉囊无明显病变。白色念珠菌0.5 g卵黄抗体组肉鸽状态良好,个别有腹泻症状,发现肉鸽嗉囊小溃疡灶病变。相反,1 g卵黄抗体组剖检后口腔和嗉囊无明显病理变化。空白对照组和甲硝唑、制霉菌素治疗组肉鸽精神状态良好,口腔和嗉囊无明显病理病变。
依据报道的口腔和嗉囊病变评分指数[11],甲硝唑组和空白对照组评分为0,毛滴虫感染组口腔病变评分为2.2,卵黄抗体组与毛滴虫感染组口腔病变差异显著(P<0.05),其中,1 g卵黄抗体组差异极显著(P<0.01),病变评分为0.4。制霉菌素组和空白对照组嗉囊病变评分为0,卵黄抗体组和白色念珠菌感染组嗉囊病变差异显著(P<0.05)。白色念珠菌感染组评分为2.0,白色念珠菌1 g卵黄抗体组评分最低为0.2。口服不同剂量的卵黄抗体后,鸽毛滴虫病原载量显著降低,1 g卵黄抗体组(3.0×10个·拭子-1)、0.5 g卵黄抗体组(2.0×102.1个·拭子-1)与人工感染对照组(2.5×105个·拭子-1)相比差异极显著(P<0.01)和显著(P<0.05)。1 g卵黄抗体组与制霉菌素组白色念珠菌载量无显著差异,0.5 g卵黄抗体组与制霉菌素组差异显著(P<0.05)。1 g卵黄抗体组白色念珠菌载量(4.0×10 cfu·拭子-1)和0.5 g卵黄抗体组白色念珠菌载量(1.2×102.0cfu·拭子-1)较人工感染组(2.1×106cfu·拭子-1)极显著(P<0.01)降低。
3 讨 论
肉鸽口服卵黄抗体对人工感染毛滴虫、白色念珠菌都有良好的治疗效果,且呈现一定的剂量-疗效关系。1 g卵黄抗体组治疗毛滴虫感染的效果与甲硝唑治疗效果接近,治疗白色念珠菌感染的效果与制霉菌素的疗效无差别。本研究证明研制的口服抗体粉可以实现完全替代抗菌素,为肉鸽产业健康养殖提供一种新的替代产品。
二联抗体粉防治毛滴虫、白色念珠菌感染的机制:1)卵黄抗体经过口腔、嗉囊吸收后,直接作用于寄生的2种病原菌表面,抑制2种病原的增殖,减轻了病原的危害[12-13];2)二联抗体通过损伤的胃肠道黏膜直接吸收进入血液循环,直接抑制肺、肝中的毛滴虫,减少毛滴虫对肺和肝的损伤。抗体吸收后直接减轻白色念珠菌造成的菌血症[14]。二联抗体粉的优势:1)产蛋母鸡持续生产,降低生产成本和使用成本;其次,利用真空低温干燥技术制备的抗体粉,保持了抗体活性,方便存储和运输,可以实现抗体粉的产业化[15];2)抗体粉可以饮水,也可以添加到饲料中;3)抗体不会引起耐药性和副作用,是一种绿色可持续性的蛋白类抗体添加剂[9]。
4 结 论
成功制备出毛滴虫与白色念珠菌二联卵黄抗体粉,有望替代甲硝唑和制霉菌素等抗菌素,保证肉鸽食品安全。
