化生性乳腺癌与乳腺非特殊型浸润性导管癌超声及临床病理特征的对比分析
2022-03-08巩海燕杜丽雯栗翠英周文斌
巩海燕 杜丽雯 栗翠英 邓 晶 周文斌 王 慧
化生性乳腺癌(metaplastic breast carcinoma,MPBC)是一种罕见的具有侵袭性的乳腺癌,占浸润性乳腺癌的0.2%~5.0%[1];其可完全由化生成分构成,也可由非特殊型乳腺癌和化生成分混合构成。MPBC无明显特殊的临床表现,淋巴结转移少见,血行转移常见,预后较差,复发率较高[2]。其超声特征多以个案报道为主[3],对其超声特征及其鉴别诊断的报道较少。乳腺非特殊型浸润性导管癌(invasive ductal breast carcinoma of no special type,IDC-NOS)是乳腺癌的常见类型,MPBC与IDC-NOS的鉴别诊断对治疗计划制定和预后预测有重要的意义。本研究通过比较MPBC与IDC-NOS的病理及超声特征,旨在提高对MPBC的认识,为临床的治疗及预后评估提供影像学参考依据。
资料与方法
一、临床资料
选取2015年1月至2020年12月我院经手术病理证实的33例MPBC患者(MPBC组)和66例IDC-NOS患者(IDC-NOS组),均为女性,均为单发病灶。MPBC组患者年龄34~75岁,平均(53.8±10.4)岁;肿块最大径12~70 mm,平均(26.8±12.3)mm,其中>20 mm者23例;包括鳞状细胞癌22例,间叶分化化生癌9例,梭形细胞癌、纤维瘤病样癌各1例;所有患者均可扪及肿块,其中2例发现乳头溢液或溢血。IDC-NOS组患者年龄29~79岁,平均(52.3±11.5)岁;肿块最大径9~50 mm,平均(22.7±10.6)mm;其中62例可扪及肿块,1例发现乳头溢液或溢血。两组患者在年龄及扪及肿块、乳头溢液或溢血方面比较差异均无统计学意义。本研究经我院医学伦理委员会批准,所有患者均知情同意。
二、仪器与方法
1.超声检查:使用百胜MyLab Twice彩色多普勒超声诊断仪,LA523线阵探头,频率5~12 MHz。患者取仰卧位,双手上举,充分暴露双乳,全面检查双乳各个象限、乳晕区及腋下区,二维超声观察病灶位置、大小、形态、边缘、内部回声、后方回声、钙化、方位等;CDFI观察病灶内部及周边血流信号及分布,测量峰值流速、阻力指数,血流信号分级采用Adler半定量分析[4],判断标准:0级,肿块内无血流;Ⅰ级,少量血流,可见1~2处点状血流或短棒状血流;Ⅱ级,中等血流,可见3~4处点状血流或1根管壁清晰的血管;Ⅲ级,丰富血流,可见4处以上点状血流或2根以上管壁清晰的血管。同时要观察双侧腋窝淋巴结,包括淋巴结大小、形态、皮质厚度、淋巴门结构、血流分布等指标。根据BI-RADS标准[5]对其分级。
2.病理分子分型:所有患者均行雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体-2(Her-2)、Ki-67免疫组织化学检测。当Her-2表达“++”者,需进一步行FISH检测判断是否有基因扩增,基因扩增者为阳性(+),反之为阴性(-)。参考St.Gallen标准[6],根据免疫组化、FISH检测结果可将乳腺癌分为:①管腔上皮细胞(Luminal)型,其中Luminal A型:ER(+)/PR(+)、Her-2(-)、Ki-67<14%;Luminal B型:ER(+)/PR(+)、Her-2(-)、Ki-67≥14%,或ER(+)/PR(+)、Her-2(+)、任何水平Ki-67;②Her-2过表达型,ER(-)、PR(-)、Her-2(+)、任何水平Ki-67;③三阴型,ER(-)、PR(-)、Her-2(-)、任何水平Ki-67。
三、统计学处理
应用SPSS 17.0统计软件,计数资料以例或率表示,两组比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
结 果
一、两组超声特征比较
两组在肿块最大径、回声均匀度、方位、钙化、峰值流速、阻力指数、周边声晕、BI-RADS分类等比较差异均无统计学意义。MPBC组肿块边缘光整、形态规则、囊实性回声、后方回声增强占比(48.5%、42.4%、18.2%、45.5%)均明显高于IDC-NOS组(10.6%、13.6%、0、9.1%),差异均有统计学意义(均P<0.05)。见表1和图1,2。
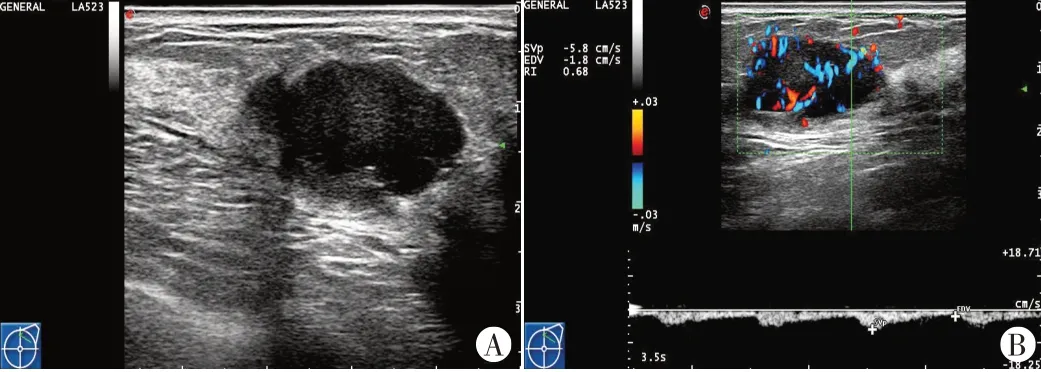
图1 左乳MPBC声像图
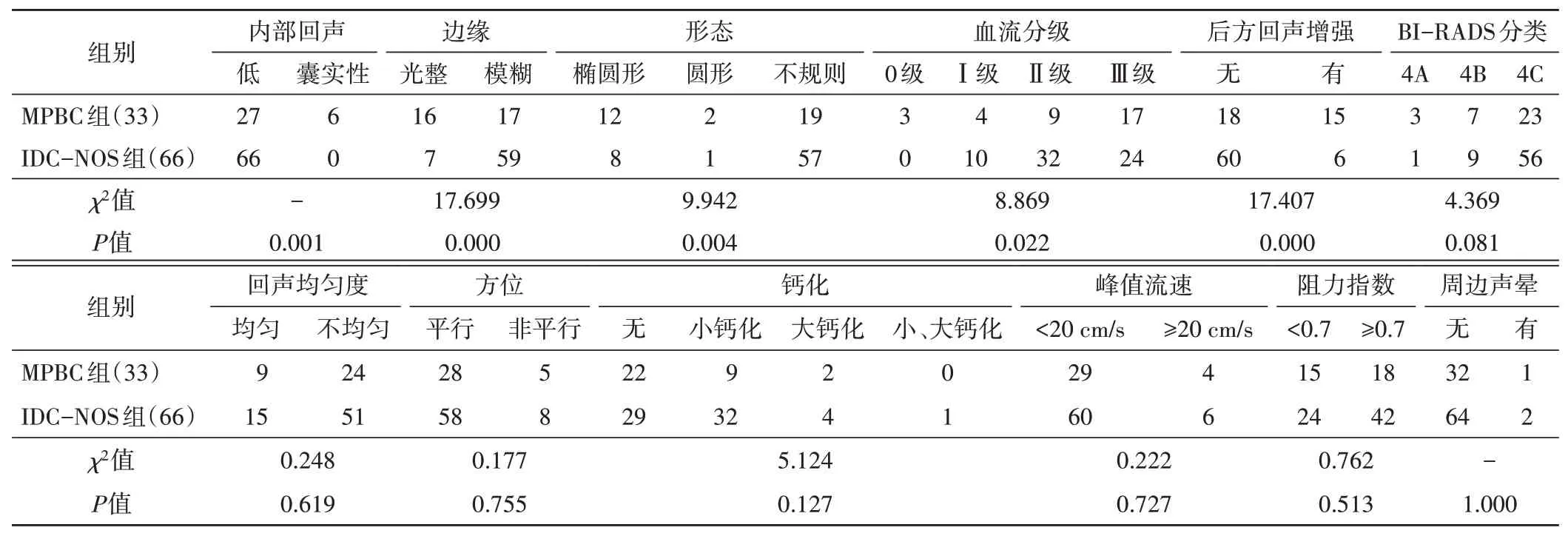
表1 MPBC组与IDC-NOS组超声特征比较 例
二、两组病理情况比较
1.两组淋巴结转移情况比较:MPBC组5例(15.2%)患者发生腋窝淋巴结转移,IDC-NOS组26例(39.4%)患者发生腋窝淋巴结转移,两组比较差异有统计学意义(P=0.021)。

图2 右乳IDC-NOS声像图
2.两组病理分子分型比较:MPBC组多表现为三阴型(20/33,60.6%),IDC-NOS组多表现为Luminal型(48/66,72.7%),其中Luminal B型居多(34/66,51.5%)。MPBC组、IDC-NOS组Ki-67表达水平分别为(59.4±21.9)%、(37.5±21.2)%,两组比较差异有统计学意义(t=4.797,P=0.000)。见表2。

表2 两组病理分子分型 例
讨 论
2012年WHO女性生殖系统肿瘤分类[7]中,根据组织形态学特征,MPBC被归入非特殊型化生癌,包括低级别腺鳞癌、纤维瘤病样癌、鳞状细胞癌、梭形细胞癌及间叶分化的化生癌。MPBC多在导管癌的基础上由腺上皮不同比例地向非腺间质组织转化,包含上皮组织、间叶组织或其他异质成分。其最常见的类型为鳞状细胞癌,本研究中鳞状细胞癌占66.7%。MPBC临床主要表现为可扪及肿块[8],但本研究中两组在扪及肿块、乳头溢液或溢血的临床表现方面比较差异均无统计学意义,说明无法从临床表现上进行鉴别诊断。本研究中,MPBC患者平均年龄(53.8±10.4)岁,多为绝经后妇女,且肿块最大径偏大,>20 mm者23例(69.7%),与Yoon等[9]报道相符。但两组在年龄、肿块最大径方面比较差异均无统计学意义,故也不能简单从年龄、肿块最大径方面进行鉴别。
目前关于MPBC超声特征的报道较少,MPBC与IDC-NOS的鉴别诊断方面的相关报道更少见。肿瘤的超声特征是以肿瘤的病理学表现为基础。MPBC肿块呈侵袭性生长[10],本研究中MPBC多表现出恶性肿瘤的征象,如边缘模糊、形态不规则、Adler分级Ⅱ~Ⅲ级、囊实性回声等,与Bian等[2]和Jia等[8]研究结论大致相符。以往研究[11]发现三阴型乳腺癌多表现出边缘光整征象,本研究与之相符。本研究中MPBC组肿块边缘光整、形态规则占比(48.5%、42.4%)均明显高于IDC-NOS组(10.6%、13.6%),差异均有统计学意义(均P<0.05),表明MPBC可表现出良性肿块特征,这也是临床极易漏诊的原因之一。既往研究[2-3]发现后方回声增强在MPBC中较常见,可能与肿块生长迅速致细胞出血坏死、细胞与间质比例等有关[12]。本研究中MPBC组肿块后方回声增强占比(45.5%)明显高于IDC-NOS组(9.1%),差异有统计学意义(P=0.000),故后方回声增强特征可作为二者鉴别诊断点。
肿瘤患者的预后预测主要依据肿瘤的临床病理评估。本研究IDC-NOS多表现为Luminal型(72.7%),MPBC多表现为三阴型(60.6%),因此MPBC具有侵袭性强、内分泌治疗反应差、预后差的特点[1,8]。本研究中MPBC组腋窝淋巴结转移仅占15.2%,低于IDC-NOS组(39.4%),差异有统计学意义(P<0.05);与以往研究[13]报道一致,可能与MPBC的肿瘤增殖机制有关。虽然腋窝淋巴结受累少,但MPBC与其他预后不良指标相关。Ki-67是一种反映肿瘤细胞增殖活性相关的蛋白质,其增殖水平越高,肿瘤侵袭性较强,预后较差[14]。本研究中MPBC组Ki-67表达水平高于IDC-NOS组,差异有统计学意义(P<0.05);与Aman等[15]研究报道一致。MPBC的增殖水平较高,进一步证明了MPBC具有较高的侵袭性。
综上所述,虽然MPBC与IDC-NOS临床表现相似,但超声医师可从边缘光整、形态规则、后方回声增强、囊实性回声等方面综合鉴别二者,为临床诊断提供影像学参考依据。
