微生物铁蛋白的研究进展
2022-03-07高启禹徐光翠崔彩霞张文博
高启禹 徐光翠 崔彩霞 张文博
(1. 河南新乡医学院生命科学技术学院 河南省遗传性疾病与分子靶向药物重点实验室培育基地,新乡 453003;2. 兰州大学生命科学学院,兰州 730000;3. 河南新乡医学院公共卫生学院,新乡 453003)
重金属离子(如铁、钴、镍、锌、铜、钼和钨)作为金属酶的组成部分在酶的功能体现中发挥着至关重要的作用。除了这些金属酶,一些细菌还可以合成金属结合蛋白,其中铁结合蛋白,即铁蛋白(ferritin)在铁的贮藏中意义重大,是一切生物体内最主要的铁储存蛋白,控制着游离铁在细胞中的储存[1-2]。
铁蛋白作为一个古老而庞大的蛋白家族,普遍存在于植物、动物及微生物体内,具有铁离子代谢、抗氧化胁迫及消除其他过量金属离子毒害作用的功能。1937年,最早由Laufberge[3]从马的脾脏中纯化分离获得,研究证实其具有耐酸碱(pH 2.0-12.0)和耐高温(70-75℃)的特性[4]。典型的微生物铁蛋白分子(FTN)是由24个亚基组成,外径约为12 nm,高度对称且中空(8 nm)的球形结构,基于四氧化三铁的铁核位于亚基衣壳中心,由数千个氢氧化铁分子和数百个磷酸盐分子以非均匀的结构形式组成,分子质量为450 kD。此外,还发现了包含细菌铁蛋白(bacterioferritin,BFR)、铁蛋白Encapsulins及DNA结合铁蛋白(DNA protection during starvation,Dps)等3种不同类型的铁蛋白分子结构,而且各种铁蛋白之间存在着大小差异[5]。比较动植物及微生物铁蛋白的亚基的组成发现,微生物铁蛋白和植物铁蛋白具有相同的亚基结构,但哺乳动物的铁蛋白有所不同,其结构中存在有重链H-型亚基和轻链L-型亚基,两者在不同的组织器官中以不同的比例组装成完整的铁蛋白。
铁蛋白Dps是在古生菌和细菌中发现的一类最小的DNA结合铁蛋白,具有正常氧化及存储铁离子的功能,还能够非特异性与DNA结合。通过将铁螯合在其核心的形式,为DNA提供物理保护和免受自由基介导的损害[6-7]。Encapsulins是迄今为止在细菌中发现的最大的一种铁蛋白,Encapsulins的亚基不含铁氧化酶中心,它能借助装载铁蛋白对铁离子进行氧化及存储,同时其内部往往还含有额外的铁蛋白样蛋白[8-9]。从原子水平上Encapsulins被细分为黏球菌铁蛋白、热袍菌纳米铁蛋白及类病毒嗜热火球菌铁蛋白。
这些铁蛋白要形成氧化铁颗粒需要一系列步骤,通常包括铁的补充、转运、氧化、成核和储存,并由氧化铁酶中心介导[10]。同时,在细胞内,铁蛋白与转铁蛋白(transferrin,Tf)、转铁蛋白受体(transferrin receptor,TfR)和二价金属转运蛋白等通过协同作用,维持着机体细胞的铁离子平衡[11]。
1 细菌铁蛋白的结构特点
由于在菌体内存在着Fenton反应所需要的Fe2+、过氧化氢及各种有机物,在不加约束的情况下,Fenton反应会产生大量的羟基自由基,而游离的自由基能够降解细胞内的脂、核酸和其他生物大分子,对细胞具有极强的氧化损伤作用[12]。因此,细胞为了保护自身免受Fenton反应的负作用影响,在涉及铁的氧化和矿化的反应过程中,将Fenton反应从细胞溶胶中分离并固定在蛋白质笼内发生。因此,所有铁蛋白的结构都具有相似性,这种笼状结构限定了发生这类化学反应的空间构造。
其次,形成致密的矿物铁心的能力是所有铁蛋白的典型特征,铁核中的铁应受到保护,在溶液中保持并具有生物可利用性,这种结构也决定了铁蛋白的主要功能。其中铁蛋白的亚铁氧化中心可以将Fe2+氧化为Fe3+,这种三价铁核被储藏在铁蛋白衣壳内,1分子的铁蛋白最多可储存4 500个Fe3+,而由12个亚基组成的Dps能在腔中容纳500个Fe3+[13]。当胞体内Fe2+的浓度不能满足正常需求时,Fe3+被还原剂还原为Fe2+并释放,以维持细胞的正常生长代谢,因此铁蛋白不仅具有消除因Fe2+产生的自由基的氧化损伤,而且调控着胞体内铁代谢的平衡。同时,研究证实细菌铁蛋白的结构和序列存在着高度保守的特性[14]。
典型的细菌铁蛋白FTN型与人类FTH结构类似,铁的催化氧化中心位于铁蛋白的4-螺旋束内,形成的空腔结构保证了铁原子的进入[15]。在24个亚单位组成的壳结构上,沿着三重对称轴有8个亲水孔,沿着四重对称轴上有6个疏水和不渗透孔。这些通道负责铁蛋白与外部环境中物质的交换,是各种离子和分子进出铁蛋白的必经通道。其中沿着三重对称轴形成的8个亲水孔是铁进入的主要通道,也控制着各种还原剂和螯合剂的进入[16]。铁蛋白亚基从N端起有A、B、C和D四个α-螺旋,在C端末端有一个E螺旋与螺旋束呈60度夹角构成铁蛋白亚基,AB、DE和BC链接处均有非螺旋区域(图 1)[17]。

图1 铁蛋白及铁储存的立体结构Fig.1 Ferritin and iron storage cellular compartments[17]
同时,Stillman等[18]研究发现,原核生物铁蛋白的亚铁氧化中心有A、B和C三个铁离子位点。GIu17、GIu50和His53构成了保守位点A,GIu94、GIu130形成B位点,其中A、B两个结合位点具有高度保守性。C位点由GIu49、GIu126、GIu129和GIu130四个残基组成,位于铁蛋白衣壳的内壁上,可通过残基GIu130的羧酸酯键与B连接(图2)。

图2 细菌铁蛋白的Fe2+氧化位点结构示意图Fig.2 Structural diagram of Fe2+ oxidation site of bacterial ferritin[18]
BFR的铁氧化物中心结构不同于FTN的铁氧化物中心结构,它更为对称和稳定,通过氧化Fe2+并将生成的Fe3+转移到中心空腔,近似于门栓的作用。此外,它在亚单位二聚体和邻近亚单位的界面上还有一个额外的孔,叫做B通道,铁可以借助B通道进入。
Dps的结构中保守功能是氧化酶和结合铁,由12个具有相同铁蛋白折叠的亚单位组成,外径约为9 nm,铁氧化物酶中心位于两个铁位点上的配体与两个二聚体之间的界面处,这与在FTN中观察到的情况相似[13]。
2 铁氧化酶中心的作用机制
铁在细胞内氮的固定、电子和氧的运输及脱氧核糖核苷酸的合成等生物化学反应中发挥着重要的功能。因此铁氧化酶活性中心的作用主要是快速吸收、氧化及存储游离的铁离子,维持铁在胞体内的平衡,同时铁氧粒子的形成使细胞能够精确控制铁离子的储存和动员[19]。其次在细胞内的铁在转录水平和翻译水平上调节铁蛋白的合成。
铁氧化酶活性中心的作用机制起始于1943年Granick等[20]对哺乳动物铁蛋白的研究。目前对于其工作机制的研究主要有两种模式,模式一中铁氧化酶中心作为反应基质,两个Fe2+结合到铁氧化酶中心作用位点,当它们被氧分子氧化后,Fe(Ⅲ)-O(H)- Fe(Ⅲ)作为整体同时离开中心位点,并为其余游离 Fe2+的氧化做准备。模式二中,当两个Fe2+被氧分子氧化后,Fe(Ⅲ)-O(H)- Fe(Ⅲ)依旧停留在铁氧化酶中心的反应位点,作为一个修复组分催化下一个反应的发生[5],如图3所示。
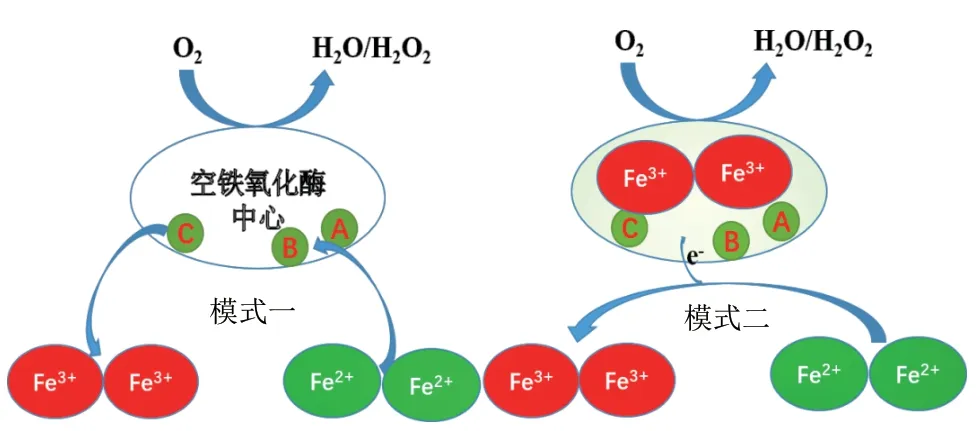
图3 铁氧化酶活性中心的作用机制Fig.3 Mechanism of ferroxidase center[5]
但Honarmand等[21]在嗜热火球菌中发现了另一种有别于以上两种工作机制的新模式,即当两个Fe2+在铁氧化酶中心被氧化后,Fe(Ⅲ)-O(H)-Fe(Ⅲ)会一直稳定地存在于铁氧化酶中心,在氧分子的参与下,新的Fe2+与Fe3+之间形成 Fe(Ⅲ)-O(H)-Fe(Ⅱ),Fe(Ⅲ)-O(H)-Fe(Ⅱ)能够驱动Fe3+的移位,使Fe3+被连续转入到铁蛋白核心,并且这种模式下的铁蛋白还具有氧化其他金属离子的能力。本课题组对分离于酸性矿山废水中的一株嗜酸嗜铁氧化亚铁硫杆菌BY3的抗砷特性分析中发现,Fe2+被氧化为Fe3+的过程中,能够将As3+氧化为As5+,而且其氧化能力与Fe2+的浓度呈正相关[22]。同时课题组围绕Fe2+的代谢途径,借助UniProt 对蛋白质序列分析及注释的全面性,以uniprot-taxonomy 920.fasta为背景库,对ferritin、iron oxidase、ferredoxinlike protein、ferredoxin、ferrochelatase、iron-sulfur cluster carrier protein、iron ABC transporter permease等目标蛋白导入Skyline后经理论酶切并优化酶切条件,筛选出特异肽段并进行了质谱DDA及PRM分析,从而为进一步揭示Fe2+的氧化过程在嗜酸嗜铁菌的生长生存中的作用提供了重要的理论参考。
同时,借助定点突变技术详细研究了铁氧化酶活性中心中A、B、C在细菌铁蛋白中的作用[23]。研究证实A、B和C位点的氨基酸替换会导致嗜热火球菌铁蛋白(PfFtn)和大肠杆菌铁蛋白(EcFtnA)的Fe2+氧化速率降低,同时在细菌铁蛋白的晶体结构中发现,A、B位点始终被金属离子完全占据,而C位点在不同细菌中具有不同的空间构象。在已经获得的脱硫弧菌(Desulfovibrio desulfuricans)、大肠杆菌(Escherichia coli)、棕色固氮菌(Azotobacter vinelandii)和铜绿假单胞菌(Pseudomonas aeruginosa)的晶体结构中,对其铁氧化酶中心进行分析结构时发现,C位点会出现Fe2+占据或空位现象,表明C位点可能作为一个短暂的铁结合位点存在。因此在铁氧化酶活性中心中,A、B位点是Fe2+快速氧化的必要因素,而C位点并非Fe2+快速氧化的必要条件,一定程度上调控着Fe2+/ Fe3+被转移到铁蛋白内或从铁蛋白中移出[24]。
3 铁的调控与释放机制
虽然人们对传统铁蛋白中的铁吸收和氧化有比较清楚的了解,但对铁调控机制的研究仍存在争议,Fe3+如何从铁氧化酶中被移除还尚不清楚。有研究认为铁蛋白调控铁的主要途径与蛋白质的水解降解有关,包括铁蛋白分子进入溶酶体,然后在水解酶的作用下氢氧化铁核心暴露并溶解[25-26]。La 等[27]借助铁蛋白的放射性铁标记及诱导表达发现,铁蛋白中铁的调控不是通过对细胞内还原剂或螯合剂的细胞浓度进行调节,而是依靠铁蛋白和二价金属离子转运体(divalent metal transporter 1,DMT1)协同运动到溶酶体。在溶酶体中,铁蛋白自身降解及暴露铁氢化物晶体并在溶酶体中溶解,还原的铁被运输回胞浆后通过细胞中的DMT1释放或再次储存在铁蛋白中。
在缺铁的条件下,铁蛋白在真核细胞中循环的半衰期约为19-24 h,但在富含铁的环境中循环的半衰期要长得多,这表明细胞中铁的调控极其严格,但仍然不清楚铁蛋白的蛋白水解是否是铁从蛋白中释放的唯一机制,以及是否存在其他辅助的铁调控机制,使细胞能够及时获得铁。但目前公认的铁蛋白中铁释放通道位于铁蛋白三重轴通道的C-D螺旋铰链区,而该区域又是铁的入口(图4)。虽然三重轴通道的孔径大约只有4Å,但在结构上具有一定的空间柔性,这种柔性特点能够使一些稍大于孔径的物质进入铁蛋白腔内[28-29]。
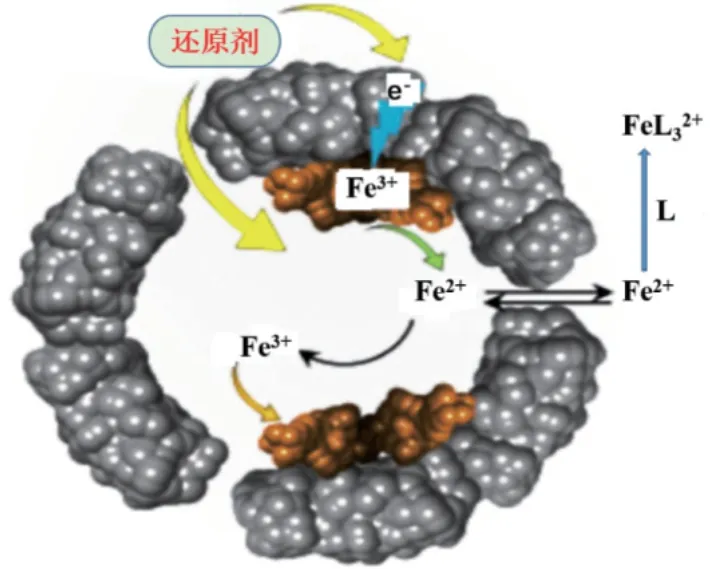
图4 铁蛋白中铁的氧化还原机制Fig.4 Redox mechanism of iron in ferritin[28]
研究表明,细菌也可以通过铁输出系统来控制细胞内的铁稳态。Sankari等[30]发现在根瘤菌(Bardyrhizobium japonicum)中有一种膜蛋白MbfA,在高铁条件下被表达,发挥着将金属从细胞质中导出的功能。MbfA含有一个N端铁蛋白样结构域,能够参与铁的结合和输出。同时在枯草芽孢杆菌(Bacillus subtilis)中发现了一种铁转运蛋白PfeT,它的失活抑制了菌体在高铁环境下的生长。在鼠伤寒沙门氏菌(Salmonella typhimurium)中也有铁输出蛋白的报道,称为柠檬酸亚铁外排转运蛋白(MdtD),在大肠杆菌(E. coli)中胎球蛋白A(FetA)和胎球蛋白B(FetB)的过度表达降低了细胞内铁的水平,增强了对氧化损伤的抵抗力[31]。
4 铁的储存
铁蛋白将大量的Fe2+氧化并储存在其内部的现象被称为铁的生物矿化(mineralization),这种生物矿化机理导致了Fe2+在铁蛋白中的氧化沉淀,但铁的氧化沉淀在细胞内的具体反应途径尚不清楚,主要包括生物矿化途径(公式1、2)和去毒反应途径(公式3),各反应途径的选择主要与细胞内Fe2+的浓度有关,在Fe2+高浓度的条件下,铁的氧化沉淀可能主要以生物矿化途径为主,但去毒反应途径也同时存在[32-34]。
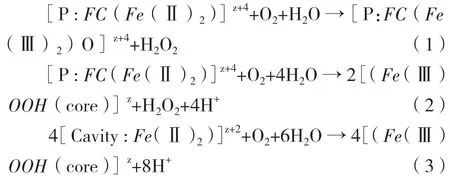
在细菌铁蛋白的研究中证实细菌至少可以表达3种铁蛋白。其中Dps更依赖于以H2O2作为氧化剂。但FTN和BFR在不同生物体内的作用似乎不同,如研究证实FTN是大肠杆菌最主要的铁储存铁蛋白,而在沙门氏菌中最主要的铁储存铁蛋白为BFR[35]。其次铜绿假单胞菌的BFR需要与邻近基因Bfd编码的铁氧还蛋白的共同作用才能完成铁在体外的快速还原与释放[36]。
Andrews认为[37],当铁进入细胞后,不会被细胞全部快速利用,部分铁被储存在铁蛋白和铁样蛋白中。这部分铁不参与正常的细胞代谢进程,以一种备用铁库的形式存在,当细胞可利用的外源铁不足时进行铁的补充,同时备用铁库储存铁的模式也对细胞具有重要的保护,降低了细胞由于铁过量引起的氧化损伤。谭潇等[38]利用基因工程技术克隆了鲍曼不动杆菌铁蛋白(abferritin)基因,证实基因的表达产物能够增强大肠杆菌抵抗氧化应激的能力。
但对于铁在胞体内的存储研究中,McHugh等[39]认为包被蛋白可能是原核生物中最大的铁储存细胞器,其直径为24-32 nm,能够积累多达30 000个铁原子。这种包被蛋白已从嗜热火球菌(Pyrococcus furiosus)和黄色黏液球菌(Myxococcus xanthus)中分离和结晶。这类蛋白结构与病毒形状类似,包被物本身没有铁氧化酶活性,但可以由包被在空腔中的特殊运送蛋白EncFTN提供。EncFTN中有一个由4螺旋束组成的铁蛋白样折叠,各亚基组装成一个盘状结构,该结构中包含有5个铁氧化酶活性位点,各位点与衣壳结构上的铁蛋白孔并列,以产生一种能够在空腔内吸引、氧化和矿化铁的复合物。目前已在包被蛋白中观察到多达14个铁核,它们一起积累的铁是典型铁蛋白分子的10倍。同时包被蛋白还携带有其他与铁无关的反应酶[40]。通过对包被蛋白的基因组分析发现,其基因组包含有FTN样和Dps样基因,但在包囊内发现含有可见的铁沉淀物,因此包被蛋白与EncFTN在铁稳态下的作用机理仍待进一步研究。
5 铁蛋白的分子改造
铁蛋白独特的八面体空间结构已成为研究蛋白质结构及自组装的重要模型,可以通过对铁蛋白的各种氨基酸突变和改造来分析亚基各个区域或不同氨基酸残基对铁蛋白功能及自组装的影响[41-43]。张瑜等[44]在大肠杆菌铁蛋白亚基的N端增加了6个组氨酸残基后,突变蛋白的二级结构并未发生明显改变,但在结构上却不能形成24聚体的壳状结构,在溶液中也只能以二聚体的形式存在,其热力学稳定性有一定的下降。因此他们认为,N端的延长可能导致铁蛋白单体构型发生了改变,使壳状结构的组装无法正常进行。
其次铁蛋白的外表面可用于连接具有特殊功能的配体,内表面可作为纳米反应器用于纳米复合材料的合成,亚基之间的接触面则可用于指导铁蛋白的解聚与重组、合成不同亚基比例的铁蛋白及打破铁蛋白的对称性结构[45]。
同时,当铁蛋白中各位点或位点邻近氨基酸发生突变时,都会对蛋白原来的作用属性产生很大影响。Liu等[46]采用易错PCR的方法构建了大肠杆菌的FTN突变体库,并将其导入已敲除铁蛋白的野生菌株中发现,野生型细胞对外加磁场吸附活性有了明显提高,而突变位点位于蛋白亚基的B-型通道内。进一步研究表明在B位点附近发生的突变使通道入口的极性氨基酸数量减少,提高了铁离子的进入能力。
6 铁蛋白的应用
6.1 笼状结构是重要的纳米材料载体
各种功能单元的微型化及其在纳米技术中的应用是一个重要且被日益关注的研究领域,它结合了物理、化学、生物学和医学等多种学科。实现这一应用目标的一种策略是使用笼状结构(cage structure protein,CSP)配合物生产单分散纳米颗粒(nanoparticles,NPs),其大小约为5-100 nm,通常形成一种类似于含铁硫簇的铁硫样蛋白[47]。目前其应用主要涉及临床微量血清铁蛋白检查、生物体的铁营养补充及生物纳米材料研发等方面[48]。
CSP制备铁硫样蛋白主要有两个优点:一方面CSP生成的NPs的大小和形状是明确的,具有窄的尺寸分布;另一方面CSP的外表面可以使用配体(如蛋白质、肽和药物分子),增强了它们在生物纳米技术和生物医学应用中的潜力,能够靶向载药于肿瘤处进行成像和治疗。其次在电子设备应用中,Dps因其固有的潜力而易于在表面组装成2D晶体[49-50]。
6.2 复合体组装的优良工具
FTN具有依赖于溶液酸碱度及盐浓度的自组装特性。研究发现当FTN处于pH<2或溶液NaCl浓度大于100 mmol/L的环境条件下时,铁蛋白的笼状结构被解离成单体,但在调节pH>7或将NaCl浓度降低后,解离的单体又自组装形成球状结构,可以在蛋白笼内产生不同大小的纳米颗粒(图5)。因此借助铁蛋白的自组装特性,可进行药物或其他物质的目的性装载,具有重要的应用价值[51]。Mazzucchelli等[52]利用铁蛋白在低pH值下分解和在高pH值重新组装的特性,成功制备了奥拉帕尼纳米颗粒,经体外实验验证,奥拉帕尼纳米药物对癌细胞的生长有显著的抑制效果,能使癌细胞存活率下降至60%。但研究也发现铁蛋白在80℃、6 mol/L尿素或盐酸胍或1%(W/V)十二烷基硫酸钠下稳定[53]。
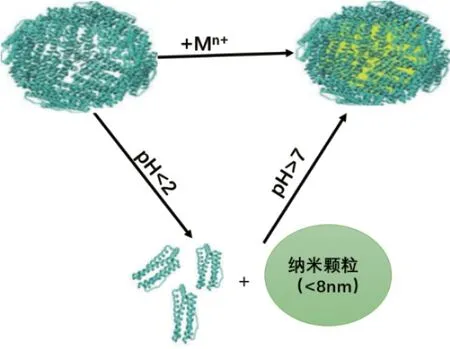
图5 铁蛋白内腔中纳米粒子的合成Fig.5 Synthesis of nanoparticles inside the ferritin inner cavity[51]
同时根据铁蛋白的自组装特点,结合基因工程技术,已构建了具有不同功能的杂合铁蛋白以及不同铁蛋白间的结构转化。Williams 等[54]发现铁蛋白氨基酸序列中的细微取代会导致蛋白质之间的转化,当12亚基的Dps的第47位苯丙氨酸突变为谷氨酸后,12亚基蛋白变为铁蛋白样24亚基聚合体。结果证明了相关蛋白亚家族之间会发生突变切换的新假说。
7 总结与展望
铁蛋白作为生物体重要的铁储存与调控蛋白,在维持细胞铁代谢平衡及保护细胞正常生理功能的体现中发挥着重要作用,同时FTN作为细胞天然形成的磁性纳米颗粒,将在核磁成像及铁蛋白分子改造中发挥其独特优势[55],因此了解铁蛋白中铁的调控与释放、铁的储存机制,将进一步揭示铁元素在生物体中的生理及生化功能。而围绕铁蛋白的笼状结构构建纳米载体,是未来纳米药物材料的研究方向之一,其独特的笼状结构是未来研究蛋白质结构及自组装的重要工具。同时借助铁蛋白的分子结构,采用生物修饰和化学修饰技术进行多种分子骨架的设计,能够实现高精度的靶向操作和多功能化的开发与应用。
迄今为止,科学家获得的微生物铁蛋白晶体极其有限,围绕蛋白晶体的制备与结构的分析,将有助于进一步探索结构与性质之间的关系,也为微生物铁蛋白功能的挖掘创造条件。与此同时,融合现代分子生物学及生物信息学技术,采用多数据源分析微生物铁蛋白与其他蛋白之间的相互作用,能够更加深入地揭示在多途径的代谢过程中铁蛋白的代谢机制,从而为相关应用奠定基础。
