原位酶谱技术在土壤酶活性研究中的应用进展
2022-03-07许佳扬魏晓梦张煦博杜剑卿吴伊波崔骁勇
郭 澍,许佳扬,魏晓梦,张煦博,杜剑卿, 4,吴伊波,崔骁勇,4,*
1 中国科学院大学生命科学学院,北京 100049 2 中国科学院大学资源与环境学院,北京 100190 3 中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室, 长沙 410125 4 中国科学院燕山地球关键带与地表通量观测研究站, 北京 101408 5 宁波大学土木与环境工程学院, 宁波 315211
土壤酶是陆地生态系统物质转化及元素循环的重要参与者与驱动者[1—2]。由于土壤酶对土壤理化性质及环境因子的变化有较高的敏感性,因此其种类多样性及活性不仅可以反映土壤的健康状况和肥力水平,也是表征土壤微环境中植物、微生物的状态和变化的敏感指标[3—5]。
关于土壤酶活性的研究已经有较长的历史,传统方法中最常用的是荧光法和分光光度法。这些方法都需要破坏性取样,存在样品运输和保存困难、前处理过程繁琐、测定周期长等缺点,导致酶活性测定结果的精度低、误差大[6]。所以要想对土壤酶活性时空分布进行精细化研究,就亟需一种先进的可视化技术[7]。而土壤原位酶谱技术是对土壤酶活性及其二维分布进行原位可视化和定量的一种新研究技术,发端于20世纪60年代生物学和医学,在近些年引入土壤生态学后即引起了广泛关注,主要应用于植物根际土壤酶活性研究,以揭示植物-植物及植物-土壤微生物的相互作用,探究变化环境下土壤质量变化(如干扰、胁迫及土壤恢复等)以及土壤微生物群落组成、活性和功能的改变[6]。
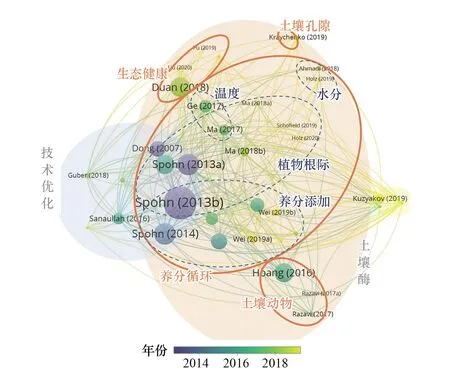
图1 土壤原位酶谱技术及其在相关领域研究中的应用现状Fig.1 In situ soil zymography and its application in relative fields
为了直观展示原位酶谱技术的应用现状,在Web of Science中以“Rhizosphere”及“Insitusoil zymography”为关键词检索,剔除不相关文献后筛选出土壤原位酶谱技术及其应用的有关36篇文献并归类,结果表明土壤原位酶谱技术已经从早期植物根际的酶活性探索研究,逐渐应用到土壤养分循环、生态健康检测、土壤结构性改良及土壤动物活动等相关研究领域(图1)。但其还存在:(1)操作方法混乱;(2)应用领域较为分散,缺乏系统性梳理难以借鉴等问题。这些问题共同制约了土壤原位酶谱技术向多学科领域的拓展。鉴于此,本文概述了土壤原位酶谱技术的发展过程和优缺点,梳理了其在植物根际养分循环、土壤生态健康检测、土壤动物及土壤孔隙等领域研究中的应用现状,结合其在各领域研究应用中的优缺点,分析了土壤原位酶谱技术的发展趋势,以期为推进土壤酶学研究的发展以及生态学微观和宏观研究的整合提供新的思路。
1 土壤原位酶谱技术的优化
土壤原位酶谱技术的操作方法为通过在土壤样品表面贴附一张被待测酶的特异性荧光标记底物的饱和溶液浸泡过的膜,使底物与土壤酶接触,反应后生成荧光产物,分析紫外线照射下的荧光图像就可以得到土壤表面该酶的活性及其空间分布的信息[8],目前应用较多的荧光产物有4-甲基伞形酮(4-methylumbelliferyl, MUF)和7-氨基- 4-甲基香豆素(7-amido- 4-methylcoumarin, AMC)。随着土壤原位酶谱的应用不断扩展,该技术本身也在不断优化。
1.1 底物载体的选择
原位酶谱技术的操作理念最早源于免疫印迹(Western blot)——一种将细胞或组织中的蛋白质通过电泳的形式从凝胶转移到固相支持物NC膜(硝酸纤维素薄膜)或PVDF(聚偏二氟乙烯膜)膜上,然后用特异性抗体检测某特定抗原的一种蛋白质检测技术[9]。之后,Grierson 等[10]将其引入土壤酶学研究中,使用硝酸纤维膜作为底物溶液的载体和底物-土壤反应的表面,并以此为基础对根际土壤磷酸酶进行原位检测。但是由于底物及其荧光产物在膜上的扩散速率慢,导致图像的灵敏度低,绝对定量较为困难[6,10]。此后的研究改用滤纸、色谱层析纸等介质,虽然提高了溶质的扩散速率,但是又出现了荧光产物弥散严重,使得图像的分辨率低、空间表达能力较差等问题[11]。为了解决以上问题,Spohn 等[12]在室内培养实验中,尝试采用在膜-土表面间增置1 mm厚的凝胶层的方式来限制底物和荧光产物的扩散速率,既避免了此前将荧光底物直接掺入凝胶的制备过程中,因凝胶溶解的温度较高而导致的荧光底物部分分解的问题,也防止了土壤颗粒沾染到图像表面,从而明显提高了图像的分辨率。
但使用凝胶作为底物扩散介质的原位酶谱法也有诸多不足。该方法在膜与土壤间以凝胶为传质媒介,底物或酶都可以在凝胶中直接扩散,并残留在凝胶中,这不仅会降低酶谱图像的分辨率,还可能会低估土壤酶的活性[13]。正因为此,Razavi等[14]提出了将浸泡过荧光底物的聚酰胺膜直接覆于土壤表面的改进方法。由于在60 min内MUF和AMC荧光的淬灭可以忽略,在相同条件下直接酶谱法的热点区域对总酶活性的贡献(6.8±0.1)%明显大于凝胶酶谱法(3.3±0.8)%,且得到的酶活性分布更为集中,荧光强度更强,图像的对比度更高[14]。对植物根际β-葡萄糖苷酶活性的一项比较研究也发现,直接覆膜的酶谱法得到的酶活性较使用凝胶的酶谱法更为集中于根际,其空间表达性更强[15]。总体上看,与凝胶酶谱法相比,直接酶谱法受扩散的干扰更小,得到的酶活性分布更准确,绝对定量更精确,因而近年来得到了更广泛的应用[16—18]。
1.2 酶活性定量方法的发展
土壤原位酶谱法的酶活性定量过程如下:对含有一系列不同浓度的酶作用产物的聚酰胺膜成像,以成像的灰度值与物质浓度做标准曲线,据此将土壤样品所得酶谱图像中的灰度值转化为对应的酶活性。而酶种类的选择和操作过程会直接影响到标准曲线的绘制[12—13]。例如Spohn等[12]的研究发现,部分酶活性测定方法(如测定蛋白酶活性的考马斯亮蓝法)的标准曲线是非线性的,可能并不适合应用于土壤酶活性的原位酶谱法定量。为了使定量结果更有说服力,Razavi 等[14]提出了构建基于膜吸收的溶液浓度和体积、膜面积的综合指标,再与相应的灰度值建立标准曲线的方法。为了简化标准曲线的制作过程又不影响结果的精度,Giles 等[16]发展出了新的测定流程,将浸泡过溶液的膜干燥后,根据单位面积膜上的荧光信号强度和灰度值的关系作标准曲线,并通过选择适当的曝光时间、使用动态范围更大的数字传感器等方法提高标准曲线的准确度。在实际操作中,含饱和底物的膜与土壤的接触常常并不十分紧密,使得原位酶谱技术往往会低估土壤中酶的活性[19]。针对荧光产物在实际土壤样品的酶谱膜中分布不均匀的特点,Guber 等[20]提出了一种比均匀膜定量方法更好的半均匀膜定量法,避免了传统膜称重时底物挥发带来的误差,并发现绘制标准曲线时半均匀膜定量法MUF的浓度与荧光强度呈现分段线性关系,断点在约0.008 pmol/像素处。该研究结果大大拓宽了原位酶谱技术的可用底物范围,对土壤原位酶谱技术的推广有重要价值。
2 基于原位酶谱技术的土壤酶活性研究进展
2.1 植物根际土壤酶活性及其主要影响因子
土壤酶是根际物质周转和养分代谢的重要催化剂与参与者,是根际微生物群落组成、活性和功能变化的敏感指标。而土壤原位酶谱技术可以直观、准确的展示酶活性沿根系的分布及其时空变化,对于理解土壤理化因子及植物生理特性对土壤-根系-土壤微生物相互作用具有十分重要的意义[8]。
2.1.1植物根系发育和根形态
根际沉积物包括脱落的根冠和表皮细胞、死亡和裂解的根细胞、根排放的气体、根被动和主动分泌的溶质(根分泌物)以及来自根表的胶状物质(黏液)[21—23],分解根际沉积物和土壤有机质(Soil organic matter, SOM)的酶的数量和种类都随时间和植物物种的变化而变化[23]。例如,豆科植物根际土壤中的酶从根表向外的分布范围(根际范围)普遍大于禾本科植物,但酶的活性却显著低于禾本科植物[17,24]。此外,根际土壤酶的活性沿豆科植物根系的分布较均一,而在禾本科植物则表现出明显的部位差异性,例如包括β-葡萄糖苷酶等在内的多种酶的活性及其根际效应范围从豆科植物根基部到根尖大体呈均匀分布,仅在接近根尖时范围逐渐减弱,这些酶在禾本科植物则是在根尖或根基部酶活性范围及活性有最大值[14,17]。当然,即使是同一科属的不同植物种,根际酶活性的分布也可能存在明显的差异[14,17,25]。例如,小麦根际四种酶(β-葡萄糖苷酶、纤维二糖水解酶、亮氨酸氨基肽酶和酸性磷酸酶)的活性高,但范围窄;玉米根际酶的活性低但范围大[17],这可能是植物生存策略不同的结果。
植物和微生物都需要吸收氮、磷等营养物质,而大多数生态系统土壤养分供应水平通常有限,导致植物与微生物在根际发生强烈的养分竞争。在缺乏外源养分输入时,植物通常通过根系形态学策略来克服养分限制[25],包括改变根的粗细、侧根和根毛的数量等,进而改变根际土壤酶的活性及其范围。由于主根、侧根和根毛的形态结构和功能不同,根际沉积物的种类、数量和分布也各不相同[17, 26]。相比于老而粗的主根,侧根和根毛有更大的根表面积,提高了根分泌物的渗出量和作用范围[27—28]。Giles 等[16]以大麦为材料,通过改进酶谱的曝光时间,得到了更准确的定量结果,发现根际磷酸酶活性与根毛的长度呈线性关系。Ma 等[18]检测了β-葡萄糖苷酶等酶在扁豆、玉米和小麦根际的酶活分布范围,发现根毛显著影响了土壤酶在根际的活性分布范围,而根的粗细对酶的比活性(单位根表面积的酶活性)的影响大,例如在小麦根上有根毛的区段β-葡萄糖苷酶的根际范围比没有根毛的区段宽1.5倍。在土壤磷缺乏时,排根(具密集根毛的侧根)能极为有效地扩大磷酸酶活性的根际范围,也可以提高磷酸酶的比活性[18, 25]。所以,植物形成高度分枝的侧根和长而密集的根毛可能是扩大酶活性的根际范围和获取养分的有效策略。
由于不同酶的功能和根际过程(如根分泌有机物等)不同,其根际范围和比活性也随酶的种类不同而不同,即使在根表同一部位各种土壤酶的根际范围也可能相去甚远。例如,在贫瘠的亚表层黄土或淋溶土基质中生长的盆栽玉米、小麦、扁豆和羽扇豆的酸性磷酸酶的根际范围是β-葡萄糖苷酶、纤维素水解酶和亮氨酸氨肽酶的1.5—2倍[14, 18, 25],其中C循环相关的酶(β-葡萄糖苷酶和纤维二糖水解酶)的根际范围最小(1—1.5 mm),而磷酸酶的根际范围可达2.5—3.5 mm[14]。其原因可能有:磷酸酶的来源广泛,植物和微生物都可以产生;环境中不同营养成分的供求状况也会影响各种胞外酶的生产和分布[29],各种生物对磷的需求量大,但是土壤P的供应通常相当有限。由于酸性磷酸酶在低pH时活性更高,植物可以通过释放质子、调节根际土壤的pH等,控制磷酸酶在其根际的活性及分布范围,以满足自身的需求[30]。上述研究还发现,酶的比活性与根际范围并不一定是正相关的。例如,碱性磷酸酶的活性范围虽然显著大于酸性磷酸酶,但酸性磷酸酶在根际的比活性明显大于碱性磷酸酶[24]。
所以,不同植物种类,根系的不同部分,甚至在根系的不同发育阶段,根际土壤酶活性的强弱、沿剖面的分布和根系作用范围都有所不同。而土壤原位酶谱技术因其直观的空间表达性,改变了对植物根际土壤酶活性的传统认知,揭示了不同植物物种及其生理状态对酶活性大小及其沿根系分布影响的差异性,对深入、准确地认识植物生理及植物-土壤反馈具有重要的意义。
2.1.2施肥
土壤中胞外酶的活性与植物、微生物所需资源的可给性往往呈负相关关系,其中磷酸酶最为突出,而由于土壤氮素转化过程复杂,氮转化相关酶与土壤有效氮的关系较弱[29, 31]。施用速效肥料改变了资源的可给性,进而影响了植物及微生物胞外酶的释放。例如,土壤原位酶谱研究表明,施用磷肥不仅不会刺激磷酸酶的活性,反而可能使其降低[24]。此外,酸性磷酸酶和碱性磷酸酶对速效磷肥的响应并不一致。添加速效磷肥后无论根际还是非根际土壤中的碱性磷酸酶活性都有明显下降[24],但根际土壤中的酸性磷酸酶活性只略微降低[25]或者不受影响[24,31-32]。这一现象在越贫瘠的土壤中越明显,原因在于酸性磷酸酶主要来自植物根系,而碱性磷酸酶主要由土壤微生物分泌,而相比于植物根系,产生碱性磷酸酶的土壤微生物受磷可利用性的影响更大[12]。贫磷土壤根际的酸性和碱性磷酸酶的活性均高于富磷土壤,分别高出53%和27%,而在非根际区土壤中两种磷酸酶活性没有差异[32],且受施磷的影响小;但是施磷后根际区土壤磷酸酶活性相比于非根际土壤大幅降低,伴随着根际酶活性的范围变宽0—2 mm[25]。
施用速效肥料一方面可能会抑制植物和微生物为获取该养分而分泌的胞外酶的活性,另一方面也可能间接增加其他酶的活性及根际范围。例如,施用过磷酸钙会解除植物及土壤微生物的“磷限制”状态[32],为维持元素的化学计量平衡,它们会将更多资源投入到获取生存所需的其他限制性养分上,因而间接地促进了β-葡萄糖苷酶、纤维素酶等C、N周转相关酶类的分泌,增强了根际和非根际土壤中的酶活性,扩大了酶的根际范围[33]。
相比于速效肥,缓释肥料及间接养分添加会广泛刺激生长于贫瘠土壤的植物和微生物分泌胞外酶。例如将牛粪施加到土壤中以后,与C、N、P获取有关的酶的活性及根际范围普遍增大[34]。秸秆还田是农田生态系统常见的间接养分添加措施,其对土壤酶的影响与死亡根系的作用类似。大部分作物收获后,死亡的根系会遗留在土壤中,使得短时间内集中向土壤输入碳源[13],包括高聚物(如纤维素和木聚糖[35])和低分子有机物,使根-碎屑层成为微生物和土壤酶活性的热区[25, 36—37]。但与施用缓释类肥料后酶活性的变化模式不同,在死根分解过程中,土壤酶活性会出现先升高后下降的现象[34]。在植物地上部收割后,根尖渗出物增加,直接促进了根际微生物活性的提高[13, 22, 38];纤维素酶[13]、丙氨酸氨基肽酶[39]、磷酸酶[40]、亮氨酸氨基肽酶和几丁质酶[13]首先只在植物根尖处表现出酶活性,随后范围扩大,逐渐扩展到整个根系周边,并在某一时刻达到最大值,即热点时刻。此后随着渗出物及低分子量有机物释放量减少,酶活性及其范围逐渐回落[33]。
借助原位酶谱技术的研究揭示了肥料种类在植物根际释放的差异性及植物根系吸收利用的不均匀性的同时,展示了其对根际土壤中不同种酶的活性的真实影响,为传统农田施肥管理提供了新的思路。
2.1.3土壤水分变化
土壤水分是养分运输的载体,也是土壤中酶与底物反应的重要介质。Holz等[41]采用土壤原位酶谱方法研究发现,土壤容积含水量通过影响酶和底物的扩散进而影响土壤酶活性。无论是外源添加磷酸酶的灭菌土壤还是种植有大麦的土壤,扩散模型都能解释土壤含水量变化引起的磷酸酶活性变异的60%。土壤复湿后磷酸酶活性快速回复到原有水平,进一步说明了土壤含水量是酶活性的重要控制因子。土壤含水量也影响磷酸酶在根际与非根际土壤中的分布,由于根系分泌的黏液等物质的作用[42],不仅在土壤干旱过程中根际区含水量一直高于非根际区,而且根际区含水量降低更为缓慢,当土壤容积含水量从接近饱和降低到5%时,非根际区含水量降幅为87%,而根际区仅改变了74%;与之相对应的是,在40%土壤含水量时根际与非根际土壤中磷酸酶活性的比值为10,而遭遇干旱胁迫时,其比值提高到了63[41],此时植物根系会通过分泌黏液提高根际的保水性[43],但是当土壤复湿时,根际含水量恢复的速度同样也滞后于非根际区[42,44]。Ahmadi等[45]利用原位酶谱技术发现向土壤中添加表面活性剂可以提高根际的润湿性,扩大酶活性范围。进行六次干旱-复湿循环后,与未施加表面活性剂的对照处理相比,土壤中施加了表面活性剂的玉米根表0—0.5 mm范围内β-葡萄糖苷酶和磷酸酶活性分别增加了4.3倍和1.9倍,酶的活性范围(酶活性比土体高出至少10%)分别提高到原来的1.46倍和1.2倍[45]。该研究说明表面活性剂降低了根际的疏水性,促进了土壤复湿时根际的再润湿,根际水分含量的增加刺激了微生物活性和酶的扩散能力,进而增大了酶的活性及其在根际的活性范围[46]。以上研究揭示了土壤水分对土壤酶活性的影响方式,也展现了表面活性剂在干旱土壤中活化和获取养分的应用潜力[45—46]。
2.1.4土壤温度变化
温度变化可直接改变酶的构象灵活性,也可以间接影响微生物活性及群落变化,进而作用于土壤及根际的酶活性[47—48]。利用土壤酶谱技术原位研究温度变化对土壤酶活性的影响,有助于更透彻地了解土壤酶对气候变化响应的微观空间特征。
在一定的温度范围内,酶活性一般随着温度的升高而增大。农业大棚实验发现,玉米根际磷酸酶、纤维素酶和亮氨酸氨肽酶的酶活性热区面积在30℃下最大[48],温度较高时酶活性的热点区域增加得更快,扩展得更广,其原因可能与温度高时有机物分解速度较快[49—50],酶和底物的扩散速度也较快有关[51]。同样,水稻根系原位酶谱实验显示,几丁质酶和磷酸酶的活性都随温度的升高(从18℃到25℃)而增加,且被测酶在根-土界面的温度敏感性Q10>1(约为1.3—1.4),明显高于非根际土壤(Q10约为1),说明全球变暖可能导致根际的养分周转速度的提升快于非根际土壤[52]。该研究还显示,酶的根际范围基本上不受温度变化的影响[52]。所以,原位酶谱更准确的揭示了温度变化对根际土壤酶活性的影响的机制。
2.2 在土壤生态健康检测中的应用
土壤酶活性常用于监测重金属污染对生态系统健康的影响,其中磷酸酶活性对重金属胁迫敏感,被广泛用作土壤中重金属毒性的指示指标[53—55]。在锌/铅矿产地不同程度受铅、锌、镉、铜污染的土壤上种植苜蓿,直接酶谱法显示随着污染程度的增加,β-葡萄糖苷酶和磷酸酶的活性升高,热区面积所占比例增加,其中β-葡萄糖苷酶的热区面积比例从0.1%提高到了0.9%,磷酸酶的从3.4%增加到了7.1%[53]。与上述结果不同,在Pu 等[56]开展的玉米铜胁迫实验中,向土壤施加硫酸铜显著降低了土壤N-乙酰葡萄糖胺酶、β-葡萄糖苷酶和磷酸酶的活性,加入纳米氧化铜也导致催化几丁质水解的N-乙酰-β-D-葡萄糖苷酶(4-methylumbelliferyl N-acetyl-β-D-glucosaminide, NAG)活性略微下降。可能的原因为:(1)植物之间在生存策略和抗胁迫机理上存在差别,例如豆科植物与根瘤菌共生可以缓解自身的铜胁迫压力[53];(2)几丁质是真菌细胞壁的主要组成成分,纳米氧化铜对真菌有毒,可能导致真菌数量降低,NAG酶的底物减少,活性下降[56]。
传统的取样测定土壤酶活性的方法也能进行土壤生态健康检测,但是使用土壤原位酶谱技术可以有助于更加直观的理解污染下真实土壤酶的活性及范围变化,相比于潜在酶活性更加准确、真实。但以上这些不同的研究结论说明人们对于土壤重金属污染对土壤酶的影响机制的认识仍旧不足,而土壤原位酶谱的结果无法解释其内在机理[53]。所以,要想全面的理解生态污染的原因、提出应对措施,应在例如植物应对策略及微生物等方面进行更加深入的研究。
2.3 在土壤动物与土壤酶活性关系研究中的应用
土壤原位酶谱法也已被广泛应用于研究土壤动物对土壤酶活性的影响,包括蚯蚓[57]、线虫[58]等。
蚯蚓形成的孔隙系统被称为蚓触圈(Drilosphere),是土壤微生物活动的“热区”之一[59],蚯蚓的粪便、黏液、尿液中含有多糖、氨基酸和蛋白质等易分解的物质[60—61],其路径通道内微生物活性较高,能加速碳、氮、磷的转化和再分配。另外,蚯蚓的肠道也能分泌酶,如磷酸酶等[62]。Hoang等[57]通过原位酶谱法研究显示,蚯蚓通道内壁的β-葡萄糖苷酶、纤维二糖水解酶、木聚糖酶、几丁质酶和酸性磷酸酶活性都明显大于无蚯蚓活动土壤。不同酶的活性范围相差较大,如β-葡萄糖苷酶的热区面积是无蚯蚓活动土壤的13.8 倍,几丁质酶约为10.2倍,酸性磷酸酶则仅为2.4倍,提示蚯蚓通道内与碳、氮循环相关的酶的活性变化大于促进磷循环的酶。土壤原位酶谱法展示蚯蚓洞穴是多种酶的热区,更清晰的展示了蚯蚓的活动对土壤酶活性和物质循环的促进作用。
线虫是重要的小型土壤动物,部分线虫会寄生在农作物体内,它们通过刺穿和破坏细胞壁侵染根部,在根内活动并导致整个根部感染,进而改变植物根分泌物的数量和组成,影响根际酶活性[63]。原位酶谱结果显示,线虫侵染促进了多叶羽扇豆的根向土壤中释放碳,使根际纤维二糖水解酶的分布范围变窄,从1—1.5 mm下降到0.5—0.8 mm,热区面积与总面积之比也下降到了原来的1/20[58]。线虫诱发的植物根结是水解酶的热点(占侵染根系总活性的0.1%),也是吸引真菌和细菌等土壤微生物的资源富集区[64],线虫与生活在植物体内的其他病原体之间的养分竞争激烈。因为受线虫侵染的植物提升了对磷的需求[65],故而与纤维二糖水解酶相反,磷酸酶的活性有所提高,磷酸酶的根际范围增加,从3—3.5 mm增加到4—4.5 mm,且热区面积在总面积中的占比上升了5倍[58]。验证了土壤线虫对根际微生物的重要影响。
所以,原位酶谱技术对于揭示土壤动物-植物-微生物的相互关系具有十分重要的作用,但由于土壤环境的复杂性及土壤动物的迁移能力较强等因素,目前仍无法准确模拟土壤动物的运动轨迹[63],所以原位酶谱技术暂时还难以准确评估土壤动物对土壤酶活性、微生物及物质循环的整体影响。
2.4 土壤孔隙对土壤酶影响的原位酶谱研究
土壤孔隙是指土粒之间、团聚体之间以及团聚体内部的微小孔洞,是容纳水分和空气的空间,也是植物根系伸展和土壤动物、微生物活动的场所。土壤孔隙度的大小会直接影响土壤的保水性和通气性,创造独特的水、气空间,从而间接影响土壤微生物及土壤酶的活性。Kravchenko 等[66]将土壤原位酶谱技术结合X射线μCT技术,发现在非根际区土壤孔隙在60—180 μm范围内时酶活性(磷酸酶、纤维素酶、木质素酶、几丁质酶和亮氨酸氨基肽酶)最高,这验证了非根际区域微生物栖息的最佳孔隙范围,直接证实了土壤物理结构对微生物的生存的重要性,为非根际区的酶学研究和微生物研究提供了良好的理论基础。
3 研究展望
土壤原位酶谱技术借助其无损、原位的特点和空间分辨率优势克服了传统土壤酶学技术的不足[12],可直观地展示各种因素影响下酶活性沿根的分布及其时空变化[8]。正因为如此,该技术引入后,已从技术讨论和根际研究逐渐拓展到探究酶活性与土壤理化、土壤动物的关系、揭示其机理的重要研究中。原位酶谱技术已在根际酶活性研究中运用成熟,但在非根际环境中应用仍然较少(如图1),且缺乏系统性,难以评估各研究中偶然因素的影响,所得结论缺乏普适性,难以直接借鉴。此外,土壤原位酶谱技术也有自身的局限性,例如结果的准确性仍受到质疑[19],且目前还只能研究有活性、难降解、可扩散的酶[52,67]及迁移能力较弱的物种[63]。因此, 未来的研究应当进一步解决所存在的技术问题,扩展其应用范围,包括但不限于以下几个方面:
(1)改进方法过程。传统的采样测定土壤酶活性的方法有搅拌过程,因而土壤酶与底物能够充分接触[7]。但是在土壤原位酶谱方法中,荧光图像的形成依赖于以下几个接触和扩散过程:底物从膜向外扩散、膜和土壤酶接触、反应产物(如MUF)到达膜,因土壤表面的凹凸不平,膜往往难以与土壤表面良好接触,导致酶谱图像只能表达出一小部分土壤表面的酶活性[8]。Guber等[19]的研究表明,覆膜与土壤仅有3.4%—36.5%的接触面积,模型模拟显示土壤原位酶谱只表现了直接或通过溶液间接接触膜的那部分土壤中酶活性的20%。所以,有必要改进土壤原位酶谱的技术规程,提高结果的准确性,并推进土壤原位酶谱技术的标准化。
(2)拓展可测定的酶的种类。早期由于技术的限制,土壤原位酶谱法测定的主要是高活性、难降解的胞外酶[52, 67],以水解酶为主。直接酶谱法的提出及分段线性拟合酶活性标准曲线方法的建立,使酶学与原位酶谱技术的结合成为可能,为原位测定更多种类的土壤酶提供了基础。
(3)探究根系互作。植物种内和种间相互作用是生态系统生物关系的重要组成部分,包括地上和地下相互作用两部分。因为地上部分易于观察和测定,所以此前的研究重点关注植物地上部分的竞争,而忽略了地下过程。而随着近年来分子生物学技术的应用和发展,越来越多的研究表明植物间的相互关系受地下根际过程的制约和调节[68]。例如,有研究发现根系分泌物不仅可以增强种间协作、提高豆科植物的结瘤和固氮能力[69],而且还在植物的相互作用中发挥着重要的信号传导作用[70]。与此同时,植物间的相互作用会通过根际来影响土壤养分的循环,根际过程也可显著影响许多生态过程与生态系统服务功能。所以对植物间根际土壤空间的各种酶活性的研究有助于深入理解植物种内与种间关系,乃至更高层次上的生态学过程和问题,有望成为未来植物学、土壤学、生态学和环境科学等学科的前沿研究领域[71]。
综上所述,虽然目前土壤原位酶谱方法还存在技术缺陷,应用范围较窄,研究结果的精度有待提升,但该技术的优势和潜力巨大,未来随着科技的整体发展,相信原位酶谱技术也会不断改进,特别是与其他技术结合,在揭示土壤“黑箱”中的物质周转、养分转化、污染物消解等关键过程的研究中发挥更大的作用,成为多学科交叉研究的重要手段。
