NOD样受体C5对肝癌细胞SMMC-7721凋亡及核转录因子-κB表达的影响
2022-03-06王海燕赵润根肖高健
王海燕 赵润根 肖高健
(河南平煤集团总医院消化内科,平顶山 467000)
肝癌具有高发生率和死亡率[1-2]。肝癌病理过程较复杂,其中肝慢性炎症因素得到学者们的认可。研究表明,核转录因子-κB(nuclear factorκB,NF-κB)在炎症诱发肝癌中起重要作用[3],其可参与免疫、炎症、癌变等多种生理病理过程[4-5]。机体中多种有效的抗凋亡基因可被NF-κB激活,且激活NF-κB可使细胞对凋亡失去敏感性,从而产生抗凋亡作用,促进肝癌的发生发展[6]。最新研究报道称,天然免疫系统中的NOD样受体(NOD-like receptor,NLP)家族成员之一,NLRC5的蛋白分子直接与先天免疫细胞NF-κB信号通路中IKKα和IKKβ结合,从而抑制其磷酸化,能够有效调控免疫细胞活性,以避免炎症反应不断增加造成对机体本身的伤害[7-8]。研究显示,NLRC5可通过调控NF-κB炎症体通路和基因的表达来调节机体免疫功能[9-10],但NLRC5具体作用机制尚未有明确报道。因此,本研究通过向肝癌细胞株SMMC-7721转染NLRC5 miRNA,并分析NLRC5对肝癌细胞的凋亡和增殖能力的影响,探究其对NF-κB的调控作用。
1 材料和方法
1.1 实验细胞
本实验所用有正常的肝细胞株HL-7702和人肝癌细胞株SMMC-7721均购自中国典型培养物宝藏中心。
1.2 试剂和仪器
NLRC5(Abcam公司);NF-κB抗体(美国PTG);TRIzol Reagent 试剂(美国 Invitrogen公司);RNA提取试剂盒(TaKaRa Bio公司);逆转录以及qPT-PCR试剂盒(广州Gene Copoeia公司);全自动酶标仪(美国 Thermo Fisher 公司);凝胶电泳仪、半干转仪、湿干转仪(美国伯乐生物公司);台式冷冻离心机(德国 Eppndorf 公司)。
1.3 细胞培养
HL-7702、SMMC-7721细胞在RPMI-1640培养基中培养,培养基中均补充有10% FBS和双抗青霉素(100 UI/mL)-链霉素(100 μg/mL),于37℃、5% CO2的加湿培养箱中培养,细胞贴壁生长,每天更换培养液1次,2~3 d传代1次,取对数生长的细胞用于实验。
1.4 细胞转染和分组
所有操作按照细胞转染的步骤严格进行。按1∶30的比例在培养基中加入转染液,并将其混匀后静置,10 min后将人源pEGFP-C2-NLRC5重组质粒载体和空质粒载体(Vector)均加入到含有转染液的培养基中,将其混匀后静置,10 min后让其发生反应生成复合体。将以上配置好的复合体全部铺到6孔板内,轻轻晃动后加入细胞的悬浮液,混匀后用培养箱进行培养。
将SMMC-7721细胞分为3组。NLRC5组:在SMMC-7721细胞中转染siRNA pEGFP-C2-NLRC5重组质粒载体后进行培养;Vector组:在SMMC-7721细胞中转染空质粒载体后进行培养;对照组:单纯SMMC-7721细胞不做任何处理,正常培养。采用qRT-PCR检测NLRC5的转染以及表达效率。
1.4 qRT-PCR检测HL-7702和SMMC-7721细胞中NLRC5的表达
分别取出HL-7702细胞和SMMC-7721细胞,用TRIzol进行裂解,对总RNA进行提取,所有的逆转录反应按照说明书进行,所得到的cDNA进行荧光实验。按照反应的条件严格进行扩增,变性3 s 95℃,变性10 s 95℃,退火30 s 60℃,共40个循环。取平均值后得到Ct值,计算方法用2-△△Ct法进行分析(表1)。

表1 引物序列
1.5 流式细胞术检测细胞凋亡
取转染后的3组肝癌细胞,使用4℃的恒温离心机对细胞进行离心处理,5 min后收集经过离心处理的细胞;收集3组细胞后,在细胞中加入100 μL Binding Buffer重悬细胞,随后加入5 μL Annexin V-FITC和5 μL的PI溶液,轻轻把所有溶液混匀;在避光环境下室温孵育,15 min后再次加入400 μL Binding Buffer重悬细胞,最后用流式细胞仪对肝癌细胞的凋亡情况进行检测。
1.6 MTT检测细胞增殖能力
比较3组细胞在传代后3、6、9、12、24、48 h SMMC-7721细胞的增殖情况。接种细胞于96孔板内,分别培养细胞12、48、72 h,添加20 μL MTT溶液于孔板的每孔中,培养箱孵育4 h,弃掉培养基,将100 μL 二甲基亚砜加入每孔中,终止反应。将孔板置于无光条件下并涡旋10 min,酶标仪检测490 nm波长下各孔吸光度值,以空白孔为参照来评估细胞增殖能力。
1.7 免疫印迹检测细胞NF-κB的蛋白表达
取转染后的3组细胞进行裂解,并提取核蛋白,并对核蛋白的浓度进行测量,分装后,保存在-20℃的环境中。将提取出的蛋白溶液和缓冲溶液进行混匀,按照4∶1的比例进行,为使蛋白质变性,需将蛋白溶液全部进行煮沸处置。在电泳板内加50 μg蛋白样品。全部转移到PVDF膜上,再把脱脂奶粉加入,封闭1 h。加入一抗(NF-κB,1∶100)后,进行TTBS洗涤,最后加入二抗(1∶100)对溶液进行稀释,再在常温的环境中封闭1 h。取出PVDF膜,TTBS漂洗,DAB显色后数码相机照相。
1.8 qRT-PCR检测细胞NF-κB mRNA的表达
取转染后的3组细胞,用TRIzol进行总RNA的提取,逆转录按照说明书严格进行,将逆转后所得的cDNA进行荧光反应实验。所有反应严格按照反应的条件进行扩增,变性4 min 94℃,变性30 s 94℃,变性40 s 50℃,变性40 s 72℃,退火7 min 72℃,共40个循环。取得的平均值后得到Ct值,计算方法用2-△△Ct法进行分析,引物序列见表1。
1.9 统计学处理
采用SPSS 19.0统计学软件进行分析,计量资料用±s表示,多组间数据比较采用单因素方差分析,两组间比较采用t检验,结果以P<0.05表示差异具有统计学意义。
2 结果
2.1 NLRC5 mRNA的表达
与正常肝细胞HL-7702相比,肝癌细胞SMMC-7721中的NLRC5 mRNA表达显著升高(P<0.05)(图1)。对照组和Vector组细胞中NLRC5 mRNA相比较,差异无统计学意义(P>0.05);与对照组、Vector组相比较,NLRC5组细胞中NLRC5 mRNA的表达显著降低(P<0.05)(图2)。

图1 正常肝细胞和肝癌细胞中NLRC5 mRNA表达比较
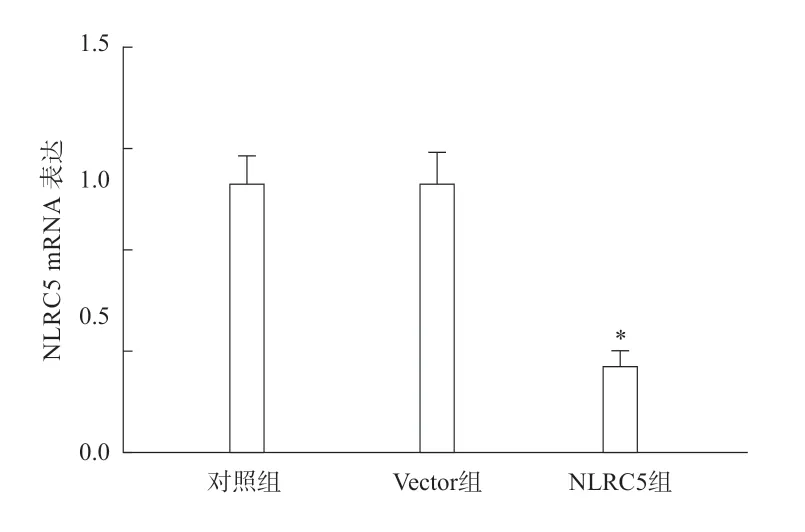
图2 3组细胞中NLRC5 mRNA的表达变化
2.2 肝癌细胞凋亡变化
与对照组相比,Vector组细胞凋亡率无显著差异(P>0.05);与对照组、Vector组相比,NLRC5组细胞凋亡率显著增加(P<0.05)(图3)。

图3 3组肝癌细胞的凋亡变化(A)及比较(B)
2.3 肝癌细胞增殖能力的变化
与对照组相比,Vector组细胞的增殖能力无变化(P>0.05);而NLRC5组细胞的增殖能力显著低于对照组和Vector组(P<0.05)(图4)。
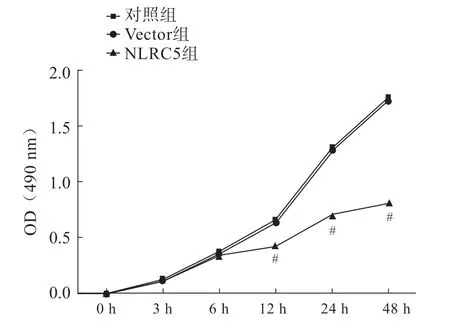
图4 3组肝癌细胞增殖能力的变化
2.4 细胞NF-κB蛋白表达的变化
与Vector组相比,NLRC5组细胞中的NF-κB蛋白表达显著增多(P<0.05);对照组和Vector组细胞中NF-κB蛋白比无显著差异(P>0.05)(图5)。
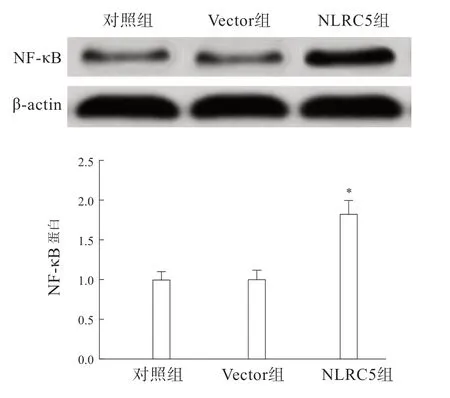
图5 3组细胞中NF-κB蛋白表达的变化
2.5 细胞中NF-κB mRNA表达的变化
与对照组、Vector组相比,NLRC5组细胞中NF-κB mRNA的表达(0.43±0.05)显著升高(P<0.05),对照组(0.12±0.02)和Vector组(0.13±0.03)细胞中NF-κB mRNA表达无显著差异(P>0.05)。
3 讨论
肝癌是世界上常见肿瘤之一, 每年约有70多万人死于肝细胞癌,其死亡率位居恶性肿瘤第2位[11-12]。肝癌的发生发展是多基因、多因素、多生物阶段共同作用的结果[13]。目前在临床上通常采用外科手术的方法对肝癌进行治疗,但患者手术后还会有复发和转移的可能,这对肝癌的治疗和预后情况产生严重的影响,但当中晚期的肝癌患者不具备临床手术的条件时,目前还没发现其他的有效治疗方法。在过去几十年,肝癌患者存活率并没有显著提高。因此,需要找到更好的肝癌治疗手段和药物。天然免疫是抗病原体感染的第一道防御屏障,在防御外来微生物入侵的同时持续监控入侵病原体的环境[14]。天然免疫系统通过多种不同模式识别病原体,对免疫反应进行有效激活。NLRs是目前最新发现的细胞内识别受体家族,其中包括5个亚家族,在人体中有23个成员,在动物中有34个成员[15]。最近研究表明,NLRs参与许多免疫调节过程和很多其他疾病,其在疾病中的作用也引起了很大的关注。此外也有研究表明,NLRs的激活与结肠癌、乳腺癌和肝癌等多种类型的癌症有密切关系[16]。作为NLRs成员之一的NLRC5被发现在先天免疫调节中有着重要的作用,但具体扮演什么角色尚不清楚。
本研究通过向SMMC-7721细胞中转染siRNA pEGFP-C2-NLRC5重组质粒载体和空质粒载体进行培养,NLRC5 mRNA比较结果显示,正常的肝细胞中NLRC5 mRNA呈低表达,在肝癌SMMC-7721细胞中高表达;转染后3组细胞中NLRC5组中的表达显著低于对照组和Vector组,可见NLRC5参与肝癌的发生和发展。肝癌是一种高侵袭、高转移性癌症,临床治疗又面临易复发、转移,从而使临床治疗效果难以得到提高。目前对于肝癌细胞增殖和转移进行有效的抑制成为了治疗肝癌的热点。因此,本实验研究结果显示,NLRC5组肝癌细胞的凋亡数量显著多于对照组和Vector组,而肝癌细胞的增殖能力显著降低;对照组和Vector组细胞的凋亡数量和增殖能力没有显著的差异。以上实验结果表明,NLRC5可以调控肝癌细胞的凋亡和增殖能力。汪欢等[17]研究显示,NLRC5肝癌细胞中高表达,并促进肝癌细胞的迁移和侵袭,在肝癌的发生和发展中起到促进作用。
目前为止,NF-κB是公认的一种具有转录激活的蛋白质,属于NF-κB/Rel家族中的重要成员[18]。在动物中发现,NF-κB主要是由p50和p65两个多肽链单位组成,NF-κB通常在细胞中的表达相对稳定,是一种极容易被诱导的二聚体。在炎症反应中,NF-κB是最为重要的转录因子。最近文献报道NLRC5可有效调控NF-κB的活性[19]。有研究表明,NLRC5对NF-κB可进行负向调控,同时负调控干扰素-I信号的发生途径[20]。在机体的多种免疫反应中,NLRC5起主要的介导作用,但其在机体的免疫调节中具体的反应机制还未见明确的报道。NLRC5通过调控I类主要组织相容性复合体的转录表达,进而影响细胞内病原体特异性CD8+T细胞的激活与增殖,从而有效清除病原菌。研究证实,小鼠组织中均有NLRC5表达,但在造血细胞中的表达最高,同时免疫组织中NLRC5 mRNA的表达相对较高。可见,在机体的免疫和防御中,NLRC5起到一定的调节作用[21]。本研究通过免疫印迹和qRT-PCR检测显示,NLRC5组细胞中的NF-κB的蛋白和mRNA表达均显著增高,可见低表达NLRC5可增加肝癌细胞中NF-κB的表达,NLRC5对NF-κB可进行负向调控。Liu等[19]研究显示,在HEK293T细胞中过表达的NLRC5抑制NF-κB和干扰素信号通路,这种关系很可能是转录抑制所导致,也再次证实了NLRC5可负向调控NF-κB信号通路,从而对过激的炎症反应进行有效抑制。
综上,低表达NLRC5可促进肝癌细胞凋亡,其机制可能与负调控NF-κB有关,进而对肝癌的发生发展起到抑制作用。
