酒糟腐熟专用液态复合菌剂发酵条件研究
2022-03-05何颂捷秦世蓉
马 倩,何颂捷,陈 静,左 勇,*,秦世蓉,宋 华,胡 琨
(1.四川师范大学生命科学院,四川 成都 610101;2.自贡检验检测院,四川 自贡 643200;3.固态发酵资源利用四川省重点实验室,四川 宜宾 644000;4.四川施利旺农业科技开发有限公司,四川 宜宾 644000)
酒糟中富含氮、磷、钾等物质,可作为有机肥的生产原料,利用其生产的有机肥中氮、磷、有机质含量可分别达3%、1%、70%。有研究表明,用酒糟生产的有机肥,与其他微生物菌剂合施,其肥效高于复合肥和普通有机肥[1-2]。不同施肥处理对土壤微生物数量和酶活性的影响差异显著,一方面表现为酒糟生物有机肥+微生物菌剂>普通有机肥>复合肥的趋势[3];另一方面表现为随酒糟生物有机肥施肥量的增加,土壤微生物数量和酶活显著提高,产量也随之增加[4]。另外,酒糟和微生物菌剂作为功能微生物的载体,赋予土壤大量的微生物源,起到了“接种”的作用[5]。在拔节期,土壤真菌数量随酒糟生物有机肥施用量的变化趋势表明,酒糟生物有机肥不但能增加土壤细菌、放线菌的数量,还能降低土壤有害真菌的数量,改善微生物结构和功能,提高微生物多样性,从而实现土壤微生物生态平衡[6-7]。
国内外学者就这一课题展开了大量研究[8]。2008年,法国农业科学院教授Parnaudeau等[9]研究发现稀释或浓缩的酒糟均可作为有机肥,提高土壤肥效,并且酒糟在腐熟过程中的发酵作用对肥效有显著增强作用。2014年,曹建兰等[10]利用白酒丢糟发酵生产有机肥时,发现功能微生物对酒糟进行二次发酵生产有机肥的方法是可行的,其研究结果表明酒糟可以作为基质生产生物有机肥,但存在酒糟腐熟周期较长的问题。2017年,林金新等[11]采用多菌种混合固态发酵白酒丢糟,利用不同微生物之间的协同作用,增加腐殖质的含量,提高肥效。
白酒酒糟中含有丰富的纤维素[2],施用酒糟生物肥后易出现二次发酵而导致烧苗的现象,不利于白酒丢糟有机肥的使用和推广,而白酒丢糟中含有的大量微生物对酒糟腐熟具有重要作用,因此将能高效降解酒糟的功能菌进行复配,用以制备酒糟腐熟活菌制剂,最终基于酒糟腐熟活菌制剂开发酒糟有机肥。
1 材料与方法
1.1 实验材料
1.1.1 菌种
贝莱斯芽孢杆菌诱变菌种(UN-5)、里氏木霉,实验室保存;酒糟来自宜宾某酒企业。
1.1.2 主要试剂
羧甲基纤维素钠、3,5-二硝基水杨酸、氯化钠、硫酸铵,成都市科龙化工试剂厂;琼脂粉、冰醋酸、苯酚,成都科隆化工试剂厂;氢氧化钠,重庆川东化工集团有限公司。
1.1.3 仪器设备
STARTER2C pH计:奥豪斯仪器(上海)有限公司;T6紫外分光光度计:北京普析通用仪器有限责任公司;YXQ-LS-75S11压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;ME104E/02电子天平:托利多仪器(上海)有限公司;HWS-12电热恒温水浴锅:上海乔欣科学仪器有限公司;GZ-250-HS11恒温恒湿培养箱:韶关市广智科技设备有限公司;THZ-98A恒温振荡器:上海一恒科学仪器有限公司。
1.2 实验方法
1.2.1 菌种活化
将UN-5和里氏木霉接种到PDA培养基平板上,37℃条件下静置恒温培养2~3 d。
1.2.2 菌悬液的制备
将活化好的菌种接种到PDA液体培养基中,37℃、150 r/min条件下振荡培养24 h。
1.2.3 生长曲线绘制
采用光电比浊法测定原始菌株的生长曲线[12]:菌株在37℃、150 r/min条件下发酵培养24 h,吸取2 mL菌液,每4 h在波长540 nm条件下测定OD540值,绘制菌株UN-5和里氏木霉生长曲线。
1.2.4 纤维素酶活性曲线的绘制
纤维素酶活的测定:将菌液接种至250 mL液体发酵培养基中,在37℃、150 r/min条件下发酵培养24 h,吸取2 mL菌液,12000 r/min离心5 min,取上清液,即为粗酶液[13]。取0.5 mL粗酶液,加入1.5 mL 1% CMC缓冲液,50℃水浴30 min,加入3 mL DNS溶液,沸水浴10 min,迅速冷却后定容至10 mL。对照组加0.5 mL灭活的粗酶液代替粗酶液,其他条件不变,540 nm波长条件下测定OD540值。
1.2.5 拮抗实验
采用平板对峙法:将UN-5和里氏木霉菌悬液两两交叉划线接种于羧甲基纤维素钠培养基上[14],37℃恒温培养2 d,观察培养基上十字交叉处是否出现由于菌种相互抑制而导致菌落缩小或消失的现象,以此判断菌种之间是否存在拮抗作用[15]。
1.2.6 耐酸性实验
配置不同pH(2.0、3.0、4.0、5.0、6.0)的羧甲基纤维素钠培养基,取5 mL待测菌悬液分别接种于培养基上,37℃恒温培养24 h[16]。用紫外分光光度计测定培养前、后的OD540值[17],以培养前、后的OD540值之差表示菌种的耐酸性(差值越大说明耐酸性越强)。
1.2.7 菌剂有效活菌数的测定
将菌悬液用10倍梯度稀释法分别稀释至10-9、10-8和10-73个梯度,每个梯度分别取0.1 mL涂布于羧甲基纤维素钠培养基,并做3个平行,与涂布无菌水的平板对比(复合菌剂的有效活菌数以数量级最大的表示)[18]。
1.2.8 复合菌剂的制备
按照1.2.1和1.2.2的方法分别制备菌株UN-5和里氏木霉菌悬液,根据1.2.4~1.2.7的实验结果将活性处于较高阶段的UN-5和里氏木霉按一定配比混合,制备成酒糟腐熟发酵液态复合菌剂,通过单因素和正交实验,对复合菌剂的制备条件进行优化[19]。
(1)菌种配比对菌剂酶活的影响:制备单菌种菌悬液,按1∶1、1∶2、1∶3、2∶1和3∶1比例将单菌种菌悬液进行混合,37℃恒温培养2 d,测定复合菌剂纤维素酶活。
(2)培养基pH对菌剂酶活的影响:调整培养基的pH分别至2.0、3.0、4.0、5.0和6.0,于37℃恒温培养2 d,UN-5和里氏木霉按2∶1混合,测定复合菌剂纤维素酶活。
(3)培养时间对酶活的影响:制备单菌种菌悬液,UN-5和里氏木霉按2∶1混合,于37℃下分别培养12、24、36、48和60 h,测定纤维素酶活。
(4)复合菌剂的制备条件优化:在菌种配比、培养基pH和培养时间单因素实验结果的基础上进行正交实验,实验选取以上3个因素,以复合菌剂的纤维素酶活为指标,采用L9(34)正交实验设计对复合菌剂制备条件进行优化[20],采用SPSS 19.0数据处理系统对正交实验数据进行一般线性模型分析[21]。
根据单因素实验结果,对影响菌剂酶活的几个因素即菌种配比、培养pH和培养时间为实验因素,以纤维素酶活为实验指标设计正交实验,见表1。

表1 复合菌剂制备正交实验因素与水平
2 结果与分析
2.1 生物量和酶活性曲线
从图1可知,生长曲线和酶活性曲线都是先增长,达到峰值后稍有下降直至平衡。培养前4 h菌体还处于迟缓期生长繁殖缓慢阶段,4 h后菌体浓度快速增加,在12 h左右进入对数期,菌体浓度增长速率加快,超过24 h后菌群增殖和死亡数量趋于平衡进入稳定期,OD540值缓慢增加。随后,菌群进入衰亡期,生理代谢活动趋于停滞,酶活开始下降且OD540值趋于平稳。UN-5在培养至24 h之前,纤维素酶活随培养时间而增加;培养24 h后由于发酵液中底物消耗较多和产物的反馈抑制,酶活缓慢下降一段时间后达到平衡,在培养24 h左右时UN-5纤维素酶活达到最高,为105.8 U,达到最高后酶活和生物量都稍有下降后趋于平稳。
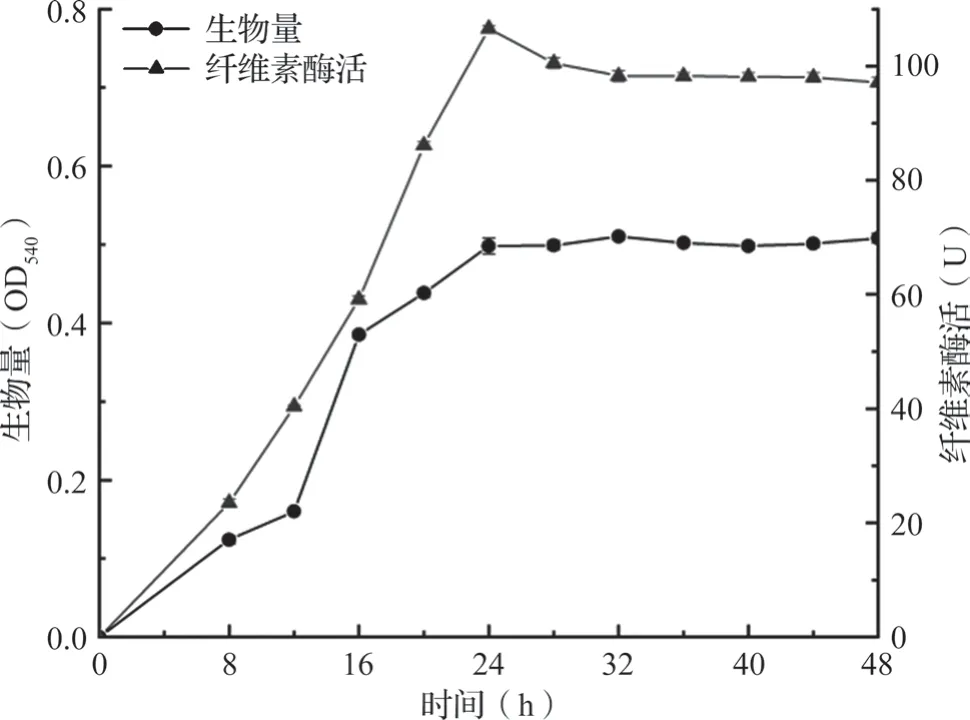
图1 UN-5菌株生长曲线和酶活性曲线
由图2可知,前期里氏木霉较UN-5生长速率缓慢,达到衰亡期的时间更长,在32 h后才进入衰亡期,酶活表现也随生物量的增加而增加,在28 h左右酶活达到最高,为53.5 U;由于里氏木霉为霉菌,因此衰亡较快,达到衰亡期后酶活也呈下降趋势。

图2 里氏木霉生长曲线和酶活性曲线
2.2 拮抗及耐酸性实验结果
进行拮抗实验是为了探明两株菌共存时二者是否存在拮抗作用,影响微生物的生长及活性,从而影响复合菌剂对酒糟腐熟发酵的效果。结果(图3)表明,菌株UN-5和里氏木霉在平板上生长交叉处未出现明显的菌落萎缩或消失现象,表明两株菌之间不存在拮抗作用,可进一步用于复合菌剂的制备。

图3 拮抗实验结果
对两株菌的耐酸性进行实验,结果(图4)表明,两株菌在低pH下仍能生长,但相较于pH较高的环境,生长明显受到了抑制。其中UN-5菌株比里氏木霉的耐酸性更强,在pH 2.0时仍能正常生长,而里氏木霉在pH 2.0时则无法生长。原始酒糟的pH在3.0~4.0,通过耐酸性实验表明UN-5和里氏木霉有较强的耐酸性,两株菌适合投入到酒糟的腐熟发酵中使用。
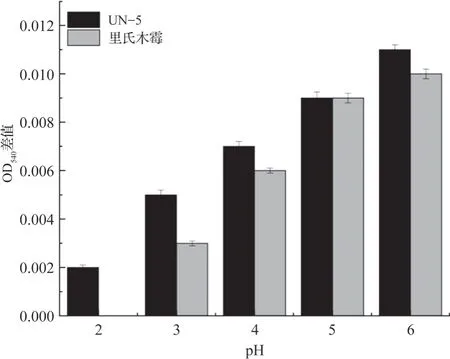
图4 耐酸性实验结果
2.3 菌种配比对菌剂纤维素酶活的影响
UN-5为贝莱斯芽孢杆菌经复合诱变的突变株,里氏木霉属于霉菌,由于两种菌的增菌时间、菌株大小、纤维素酶活不同,对两株菌不同配比混合发酵液纤维素酶活进行测定。结果(图5)表明,UN-5比例大时,复合菌剂酶活较高;UN-5比例减小,复合菌剂酶活也随之下降。当UN-5∶里氏木霉高于2∶1时,复合菌剂的酶活高于单独UN-5酶活;当比例小于1∶1时,复合菌剂的酶活低于UN-5菌株单独酶活,高于里氏木霉单独酶活;当比例为2∶1时,复合菌剂酶活最高,为120.66 U;当比例为3∶1时,复合菌剂酶活略微下降,因此初步判断UN-5∶里氏木霉最佳比例在1∶1~3∶1。

图5 不同菌种配比对纤维素酶活的影响
2.4 培养基pH对菌剂纤维素酶活的影响
培养基pH对复合菌剂纤维素酶活的影响结果如图6所示。复合菌剂酶活随pH升高而增强。当pH为2.0时,强酸环境抑制了菌株的活性,复合菌剂的纤维素酶活较低,仅为16.86 U。随着pH增加,酸性环境对菌株的抑制作用减小,菌剂的酶活随之增强,当pH为4.0~7.0时,酶活增强效果不如pH为2.0~4.0时明显,考虑到酒糟中呈酸性环境,选择培养基pH为4.0~5.0来确定最优发酵pH。

图6 培养基pH对纤维素酶活的影响
2.5 培养时间对酶活的影响
两株菌混合发酵时培养时间对制成的复合菌剂酶活的影响结果如图7所示。复合菌剂纤维素酶活变化曲线趋势与单菌液酶活曲线相似,由于两种菌的相互作用,在培养8~24 h酶活增加较快,在混合培养24 h时酶活达到最高,为110.65 U。培养超过32 h后由于底物消耗较多和产物的反馈抑制,复合菌剂的酶活开始下降,故确定复合菌剂的最佳培养时间范围为24~32 h。

图7 培养时间对纤维素酶活的影响
2.6 生物有机肥中有效活菌数
生物有机肥有效活菌数是评价微生物肥料质量的关键指标,在酒糟制备有机肥的过程中加入微生物菌剂有利于提高成品中有效活菌数的含量。
如图8所示,经堆肥腐熟后,投用UN-5的有机肥中有效活菌数达到了0.5 亿/g,投用里氏木霉的有机肥中有效活菌数为0.4 亿/g左右。由于里氏木霉是霉菌,单个菌体较大,同体积内的有效活菌数较UN-5少,投用复合菌剂中有效活菌数只有1.3 亿/g左右。

图8 单菌种和复合菌剂有机肥中有效活菌数
2.7 正交实验结果
根据单因素实验结果,选择影响菌剂酶活的几个关键因素,菌种配比、培养pH和培养时间为实验因素,以纤维素酶活为实验指标,采用L9(34)正交表进行正交实验,结果见表2。

表2 复合菌剂制备条件优化正交实验结果
由表2可见,采用极差法分析正交实验(极差越大对纤维素酶活影响越大),对纤维素酶活影响由高到低为C因素>B因素>A因素。从各因素水平均值可见,A2、B2、C2均值最高,最佳组合为A2B2C2。由表3可见,A因素、B因素、C因素对纤维素酶活影响在0.05水平达到显著(P<0.05),影响由高到低依次为C因素、B因素、A因素,与极差分析结果一致。根据正交实验结果,取A2、B2和C2进行验证实验,得到复合菌剂纤维素酶活为125.24 U,符合方差分析结果,且有效活菌数达到10.3亿/g。

表3 方差分析
综上,考虑实验误差,对纤维素酶活影响由高到低依次是培养基pH、菌种配比、培养时间;从各因素水平均值可见,A2、B2、C2均值最高,最佳组合为A2B2C2,即培养时间28 h、菌种配比2.5∶1、培养基pH为5.0时,制得复合菌剂纤维素酶活最高。
3 结论
对UN-5和里氏木霉的复配研究结果表明:菌株UN-5和里氏木霉之间不存在拮抗作用,且两株菌均有较强的耐酸性,单菌在培养24 h左右时,纤维素酶活性达到最高水平,分别为105.8和53.5 U。通过单因素和正交实验优化复合菌剂制备条件,结果表明,对复合菌剂酶活影响强弱顺序为:培养基pH>菌种配比>培养时间,得到复合菌剂最佳制备条件为UN-5∶里氏木霉为2.5∶1、培养基pH为5.0、培养时间为28 h。经此条件制备的复合菌剂纤维素酶活达125.24 U,有效活菌数为10.3 亿/g,可直接用酒糟腐熟,进而生产生物有机肥。
