罕见病保障机制:部分国家与地区的经验与启示
2022-03-05朱坤
朱 坤
中国财政科学研究院,北京 100142
建立健全罕见病保障机制,是保障患者健康权、生存权的迫切需要,也是实施健康中国战略的必然要求。建立健全罕见病保障机制,不仅有助于减轻罕见病患者的就医负担,减少因病致贫、因病返贫现象的发生,加快我国全民健康覆盖和健康中国建设进程,也有助于推动我国医药产业转型升级,缩小我国与发达国家在生物医药产业方面的差距,实现我国医药产业的高质量发展。如何建立罕见病保障机制已经成为卫生健康领域的重要热点问题,但目前尚无系统的顶层设计。为此,我们从罕见病的定义、药品供应保障和费用分担,以及对医药产业发展的促进等方面对部分国家和地区的做法进行梳理,总结其经验与启示,为我国进一步完善罕见病保障的顶层设计提供依据。
一、罕见病的定义
罕见病是部分发病率极低的疾病的总称[1]。目前,国际上没有统一的定义,美国、日本、澳大利亚以及欧盟30 多个国家及地区结合自身情况作出了不同界定。总体上看,罕见病的界定方法可以分为三种。一是基于患者人数与药品角度,如美国。美国是世界上最早提出罕见病并从法律层面进行界定的国家,在1983年的《孤儿药法案》(Orphan Drug Act,ODA)中将“在美国患病人数少于20 万的疾病”界定为罕见病,并在2003年发布的《罕见病法案》(Rare Diseases Act,RDA)中对罕见病进行了扩展:“患病人数少于20万的疾病,或者患病人数超过20万但预期其治疗药品销售额难以收回研发成本的疾病。”[1-3]二是采用患病人数与患病率相结合的方法,如日本。日本在1993年将国内患病人数低于5 万人,或患病率低于1/2 500 的疾病界定为罕见病[1,4-5]。三是仅使用患病率来界定罕见病,大多数国家和地区均采用此方法。澳大利亚(1997年)和欧盟(2000年)的界定是“患病率低于5/10 000 的疾病”;俄罗斯(2011年)的界定是“患病率不高于10/100 000 的疾病”;巴西(2017年)的界定是“患病率低于65/100 000 的疾病”;我国台湾地区(2000年)规定:“患病率低于1/10 000 的疾病即为罕见病”[6]。
二、罕见病保障机制
(一)罕见病的药品保障
1.通过立法推动罕见病药物的保障
在罕见病政策起步较早的发达国家和地区,如美国、澳大利亚、日本,以及欧盟和我国台湾地区,在解决罕见病问题时都是围绕“以药带病”的管理思路,即明确罕见病药物(又称孤儿药)的边界,推动药物的可及性。因此,罕见病药物身份的认定就成为推动罕见病药物可及、可支付的第一步。
为了规范和支持孤儿药的研发,美国、澳大利亚、日本和欧盟等发达国家及地区都先后建立了专门的孤儿药认证及管理部门,并形成了完备的孤儿药政策、法律法规体系。美国于1983年率先颁布了ODA,首次在世界上定义了孤儿药这一概念,并于同年成立罕见疾病组织(The National Organization for Rare Disorders,NORD)。此后,美国又分别于2011年及2013年对ODA 进行了修订[7-8]。而新加坡、日本、澳大利亚和欧美先后于1991年、1993年、1998年和1999年出台并实施了治疗罕见病的用药政策[9-11]。作为药品监管机构,美国食品药品监督管理局(FDA)专门设立了孤儿药研发办公 室(Office of Orphan Products Development,OOPD)来负责孤儿药的评估及认证工作。随后,RDA、《处方药使用费用法》和“医疗创新发展计划”的推出,以及美国国立卫生研究院(NIH)罕见病研究办公室的成立都成功推动了美国罕见病的研究及孤儿药的开发。与美国类似,欧盟的《孤儿药管理法规》和日本的药事法中都规定了孤儿药的界定标准及相应管理政策。欧盟成立了罕见病专家委员会,欧洲药品管理局(EMA)也专门设立了孤儿药委员会负责孤儿药的认证与评估。日本的孤儿药认定及评估主要由厚生劳动省负责,医药品医疗器械综合机构和日本医药研究所参与相关事宜[12]。
2.全方位的政策支持,改善罕见病药物的可及性
针对罕见病的药品保障,不同国家和地区从经济支持和行政支持两个方面出台了不同的政策,改善罕见病药品的可及性,主要措施有税收抵免、研发支持、注册费减免、试验设计援助、市场独占期和快速审批等[13-17],具体见表1。

表1 部分国家和地区罕见病药品保障的经济和行政政策支持
美国是全球范围内最早对罕见病药物研发创新提供政策保障的国家,1983年美国ODA 出台后,逐渐形成一套针对罕见病药物的系统化、差异化的新药注册体系。政府主管机构从经济和行政两大方面为企业提供支持,极大程度上促进了罕见病药物在美国的研发,增加了在美上市的罕见病药物数量并缩短了上市时间。
在税收抵免、科研经费支持及试验设计援助的扶持下,罕见病药物研发创新与上市申请不断增加。美国在ODA出台前的10年里仅有10种罕见病药物上市,而1983年后,有503 种药品获得“孤儿药”身份认定并成功上市,涉及731 种适应证(截至2018年9月)。2017年,在美国上市的42 种新药中,有一半是罕见病药物。
为了保障罕见病药物注册制度的合理性,澳大利亚治疗商品管理局(Therapeutic Goods Administration,TGA)在罕见病药物项目启动近20年后,于2015—2016年启动对罕见病药物项目改革的评估工作。2017年6月,TGA 公布罕见病药物身份认定的三项新增标准,并针对申请企业如何测算目标适应证患病率进行了详尽的规定。要求:①必须是针对危及生命或导致严重衰弱的疾病;②仅针对特定的适应证人群有效;③目前没有治疗该适应证的药物上市,或目标药物在疗效或安全性方面显著高于已上市疗法。
(二)罕见病的费用保障
不同国家和地区的医疗保障制度不同,因此对罕见病的费用保障也存在一定的差别。已经建立了罕见病保障机制的国家,大多数采用了普惠和特惠相结合的方式来减轻罕见病患者的就医负担。
1.罕见病保障的普惠制做法
德国社会健康保险的保障待遇较高,所以采取了普惠制的方式来解决罕见病患者的就医费用,德国社会健康保险基金设立了年度个人自付的上限,所有患者(包括罕见病患者)年度个人自付医药费用不得超过其家庭收入的2%[18-19]。
日本社会健康保险制度的保障待遇较高,罕见病患者的个人自付不超过30%,且设立了每月的自付上限,超过上限部分,个人承担超出部分的1%[6,18-19]。
2.罕见病保障的普惠制与特惠制相结合的做法
英国罕见病患者的费用主要通过税收筹资建立的国家卫生服务体系(NHS)来支付。其中部分罕见肿瘤患者的药品费用可以通过肿瘤药物基金(CDF)支付。CDF 成立于2011年4月,旨在为那些被国家卫生与临床优化研究所(NICE)拒绝或正接受评估的新型抗肿瘤药物提供资金支持,并由NHS对其进行运行管理和预算控制[1-3,6,19]。
俄罗斯的罕见病患者医药费用主要由社会医疗保险基金支付。但俄罗斯对罕见病进行了分类,并设立了不同的支付渠道:一是7 种治疗费用昂贵的罕见病,由联邦政府统一采购并支付药品费用;二是24 种严重威胁生命的罕见病,由地方政府支付;三是230 种其他罕见病,由社会医疗保险基金支付[1-3,6]。
澳大利亚的罕见病患者医药费用,主要由澳大利亚的医疗保险制度(Medicare)支付,但列入救命药项目(LSDP)的罕见病药物由联邦财政支付[1-3,6,18]。
我国台湾地区的罕见病患者医药费用,主要由全民健康保险基金支付,全民健康保险对未被健康保险覆盖的罕见病费用通过设立专项基金予以补助,经费来源于捐赠及烟草税[6]。具体见表2。
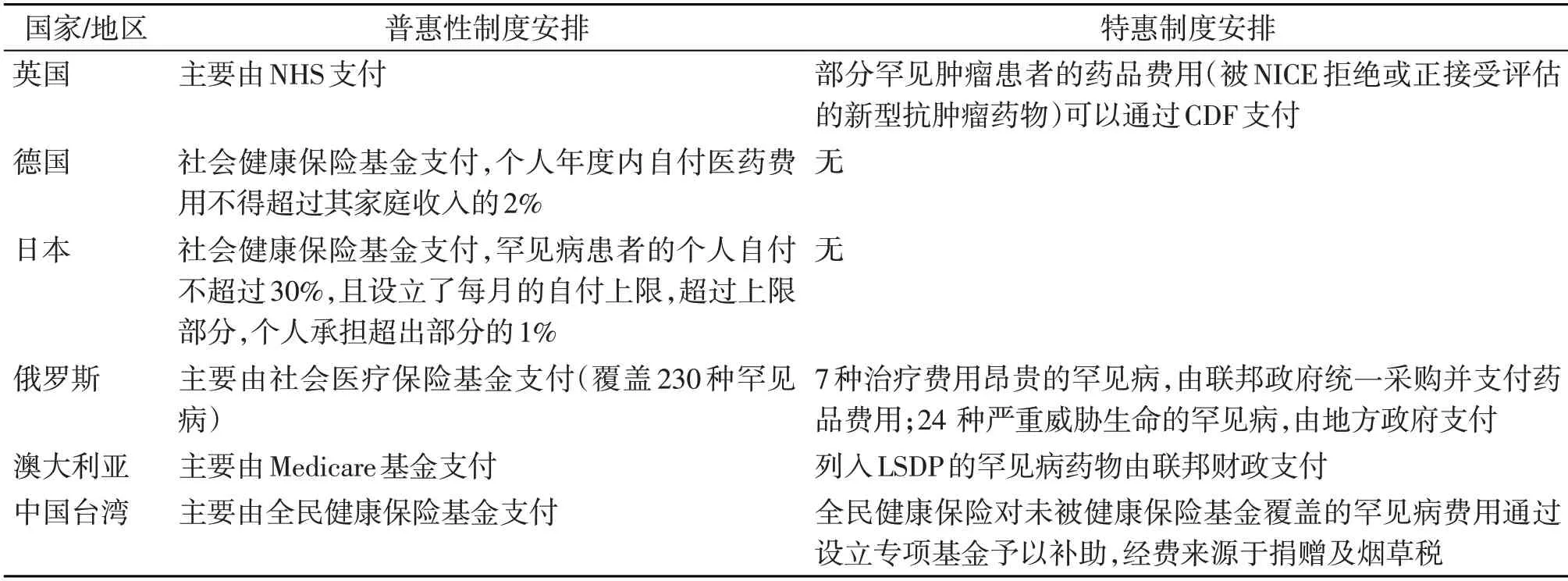
表2 部分国家和地区罕见病费用保障的制度安排
三、罕见病保障机制对医药产业发展的促进作用
当前,全球医药产业已经从传统的化学制药向生物制药转变,罕见病已成为引领生物制药产业发展的重要突破口。美国、日本和欧盟等国家和地区医药企业均在促进罕见病发展过程中实现了产业升级,提升了其在全球生物医药市场中的竞争力。过去10年,欧美等生物制药企业的崛起,大多与罕见病有关。全球销量前十位的生物药,多以罕见病为突破口,几乎都是以孤儿药的身份在欧美市场获批上市,并逐步拓展至多个罕见病和非罕见病适应证,为企业抢占市场提供了重要的窗口。艾昆纬(IQVIA)全球研究院统计,在过去的五年里,美国和欧盟每年批准上市的新药中有超过半数的是孤儿药。建立罕见病保障机制,已经成为发达国家和地区鼓励医药创新的重要组成部分,对于生物医药产业的发展具有重要的推动作用[21-23]。
四、对我国的启示与建议
(一)界定罕见病范围是建立罕见病保障机制的前提和基础
从部分国家和地区的实践看,罕见病的定义与范围各不相同,但都有一个大致的界定标准或范围,部分国家通过立法对罕见病进行了界定,部分国家通过疾病目录、发病率和药品相结合的方法对罕见病进行了界定,有力地推动了罕见病保障机制的发展。我国也在积极推进罕见病定义和目录的界定,国家卫生健康委等五部门于2018年出台了《第一批罕见病目录》,包括了121种罕见病,首次通过目录的形式对部分罕见病进行了确认。学界也对罕见病的定义进行了探讨,中华医学会医学遗传学分会于2010年建议:“将患病率低于1/500 000,或者新生儿发病率低于1/10 000 的疾病划入罕见病”[24],全国罕见病学术团体主委联席会议于2021年建议“新生儿发病率小于万分之一、患病率小于万分之一、患病人数小于14万的疾病划入罕见病”[25],但目前尚未得到官方的正式认可。建议我国借鉴国际经验,尽快从发病率、患病率及药品可及性等维度对罕见病进行界定,更好地推动罕见病保障机制的建设。
(二)改善药品可及是建立罕见病保障机制的重要内容
部分国家和地区通过运用政府与市场相结合的方式,为罕见病药品企业提供全方位全流程支持,显著提升了罕见病药品的可及性。我国也在探索建立罕见病的药品保障机制,对研发和生产罕见病药物的企业也给予了一定的支持,如研发的支持、上市准入的快速通道等,但与其他国家相比,我国在市场准入特别是医保准入方面仍有改进的空间。当前我国罕见病患者的药物供应保障主要依赖外资企业,应借鉴国际经验,进一步加强对国内企业的支持力度,及时将国内企业的产品纳入医保目录,更好地改善罕见病患者的药物可及性。
(三)普惠与特惠相结合的医疗保障制度是缓解罕见病患者就医负担的主要手段
从上述部分国家和地区的经验看,基本医疗保险基金在保障罕见病方面均承担了重要责任,优先将罕见病纳入了基本医疗保险的保障范围,保障了罕见病患者普惠性的受益权。对于基本医疗保险基金难以满足罕见病患者保障需求的,设立特惠性政策,通过专项基金、慈善捐赠和烟草税等方式,使罕见病患者的就医负担显著下降,普惠与特惠相结合的保障机制为我国建立健全罕见病患者的费用保障机制提供了有益借鉴。我国部分地区也已经在探索普惠与特惠相结合的罕见病保障机制,如山东青岛和浙江部分地区。但从国家层面看,普惠性制度安排不足,部分罕见病被排除在普惠性保障之外,特惠性制度安排缺位,如何建立特惠性制度目前仍在探索之中。建议借鉴国际经验,优先建立普惠性制度,让所有罕见病患者均能获得基本医疗保险制度的待遇保障,在此基础上,探索建立特惠性保障制度,缓解部分罕见病患者因病返贫、因病致贫问题。
(四)健全罕见病保障机制是实现我国生物医药产业转型升级的重要助推器
发达国家和地区的经验显示,建立罕见病保障机制有助于推动医药产业创新,更好地满足罕见病患者的需求。健全的罕见病保障机制已成为生物医药产业创新和转型升级的重要助推器。我国具有人口优势,罕见病患者众多,可以为生物医药产业发展提供重要的研究对象。但目前我国罕见病的医疗保障机制建设还相对滞后,与欧美发达国家还有较大的差距。基本医疗保险在保障罕见病方面的作用还有待进一步加强,普惠制与特惠制相结合的罕见病保障机制尚未形成。建议我国在地方实践的基础上,进一步完善罕见病保障机制,加强医疗保障政策与生物医药产业政策的衔接,借力生物制药行业高速发展平台提速孤儿药产业,推动医药产业转型升级和高质量发展,更好地满足我国罕见病患者的药品保障需求。
