一种罕见小额外标记染色体的鉴定及临床意义分析
2022-03-05王红丹夏海兰李永乐张晓梅冯战启
王红丹,夏海兰,李永乐,高 越,张晓梅,冯战启
小额外标记染色体 (small supernumerary marker chromosomes, sSMC) 是不能够被传统的染色体核型分析技术识别的多余的结构异常染色体[1]。大约60%的sSMC衍生于染色体短臂或者近端着丝粒染色体近中心区域。人群中sSMC的发生率为0.6/1000左右[2],是一种罕见染色体异常。25%~30%被发现的sSMC产生于15号染色体,sSMC(15)是最常见的sSMC类型[2]。起源于10号染色体的sSMC更为罕见,截至目前国内外仅见10余例报道。sSMC的临床效应取决于sSMC中常染色质的含量,染色体的起源以及嵌合比例等因素,因此,为了更好地了解核型与表型的相关性,继续研究报道更多的sSMC病例,特别是起源于10号染色体的罕见特征性病例。该研究对一携带sSMC(10)的患者进行了临床表型、遗传特征及临床意义分析。
1 材料与方法
1.1 病例资料患儿母亲,29岁,G3P1,有两次早孕期胎停史,未进行遗传咨询。患儿父亲,30岁,既往体健。患儿,女,7月龄,因新生儿窒息、缺血缺氧性脑病、生长发育迟缓来河南省人民医院医学遗传研究所遗传门诊进行遗传咨询,患儿体检未见明显结构畸形。患儿父母已经签署知情同意书,本研究通过河南省人民医院伦理委员会批准。
1.2 方法
1.2.1细胞遗传学核型分析 取患儿及其父母肝素钠抗凝血2 ml,接种于人外周血淋巴细胞培养基中,置于37℃恒温培养箱中,持续培养72 h,收获前1 h加入秋水仙素,经过氯化钾低渗处理、固定、滴片和烤片等常规过程制片。胰酶消化后采用Giemsa染色进行显带。采用全自动染色体核型分析系统(德国LEICA公司)计数30个分散良好且显带清晰的分裂相进行分析。
1.2.2染色体芯片分析(chromosomal microarray analysis, CMA) 采集患儿及父母外周血2 ml,应用柱式全血基因组DNA提取试剂盒 (德国QIAGEN公司)提取基因组DNA。采用Qubit定量平台(美国Qubit 3.0)定量DNA的浓度。应用Agilent公司生产的 SurePrint G3 Human CGH Microarray 8×60K芯片(美国Agilent公司)对患者及其父母全基因组CNVs进行检测。实验原理是将患者样本DNA与正常对照样本DNA分别用不同的荧光素标记(cy3/cy5)标记、纯化后进行竞争性杂交,采用Agilent Microarray Scanner对芯片进行扫描,运用Agilent CytoGenomics Edition软件得到定量的拷贝数检测结果。软件参数设置为对基因检测片段中连续3个探针logR值≥0.25或logR≤-0.25的CNVs进行标示。据文献[3]报道,大约99.34%致病性拷贝数变异(copy number variation, CNVs)长度均大于300 kb,对200 kb以上CNVs进行检测并做出提示。此芯片检测不能排除更小的染色体结构异常的可能性。芯片序列信息来源于2009年2月UCSC数据库提供的人类基因组参考序列(GRCh37/hg19)。
1.2.3影像学检查 患儿于出生第2天及第11天进行了MRI检查,序列:IR FRFSE SE/EPI;AXI:TIFLAIR&T2FLAIR,FRFSE T2WI;SE/EPI DWI SAG:T1FLAIR。
2 结果
2.1 细胞遗传学检测结果患儿母亲染色体核型为46, XX, t (10; 13)(p11.1;q11)[11]/ 46, XX[19](图1)。患儿父亲染色体核型结果正常,核型为46,XY。患儿染色体核型为47, XX, +mar(图2)。
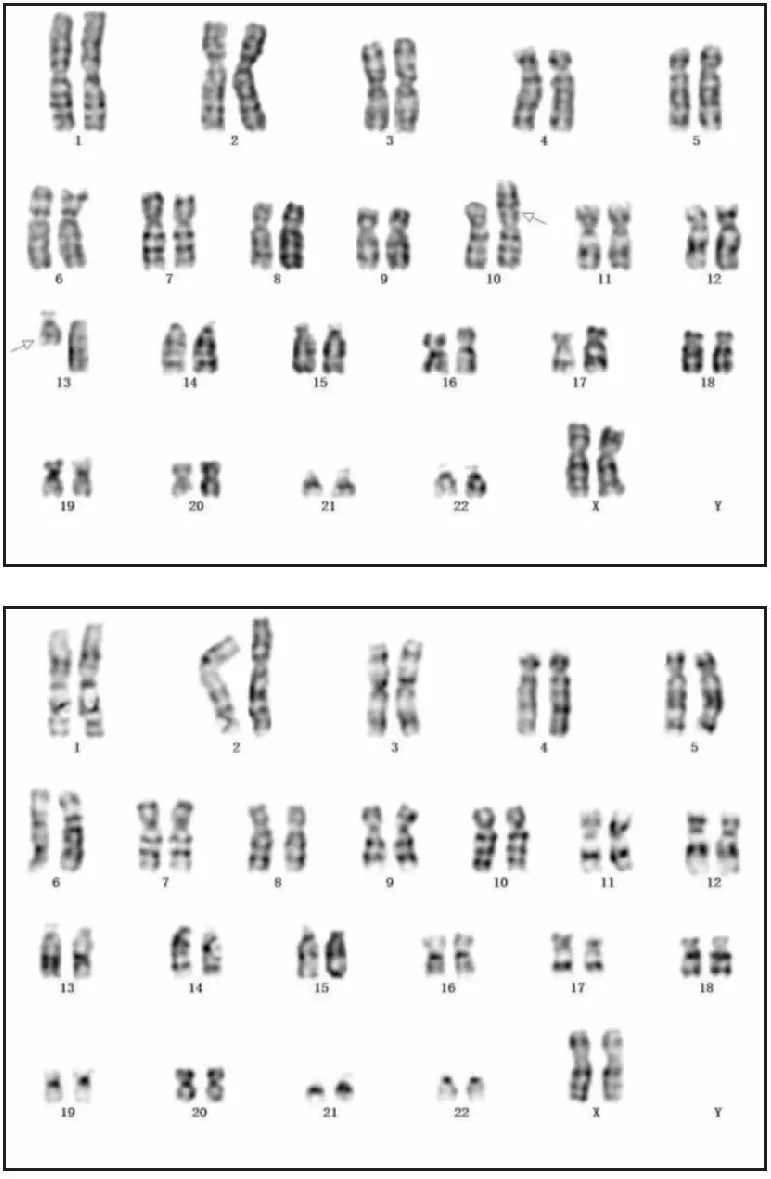
图1 患儿母亲G显带染色体核型分析图
2.2 CMA技术分析结果患儿父母CMA检测结果显示不存在200 kb以上CNVs。患儿CMA检测结果显示10号染色体p15.3p11.1区域LogR值显著升高,大约在0.5附近,提示患儿10号染色体p15.3p11.1区域发生了3拷贝重复。CMA分子核型为:arr[hg19] 10p15.3p11.1(148,206~38,545,928)×3,片段大小为38.39 Mb,13号染色体未见重复和缺失(图3)。
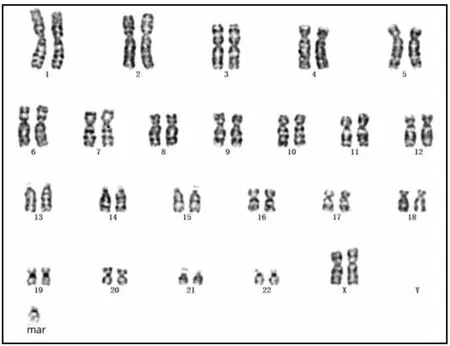
图2 患儿G显带染色体核型分析图

图3 患儿CMA检测结果
2.3 影像学检测结果患儿于出生第2天进行了头部MRI检查。可见左侧颞叶、右侧枕叶异常信号,双侧侧脑室后角内积血,符合缺氧缺血性脑病;Dandy-Walker畸形,枕大池内有积血;胼胝体异常信号及左侧头皮下血肿。出生第11天进行了头部MRI复查,与前片相比,右侧额叶新见异常信号区,有局部脑软化形成趋势,余同前片。CT检测结果支持缺血缺氧性脑病。
2.4 回顾性总结以往sSMC(10)病例对文献报道的sSMC(10)病例进行了遗传学和临床总结。见表1。

表1 文献报道的sSMC(10)病例的遗传学及临床特征
3 讨论
加用传统核型分析以外的遗传学检测方法,明确sSMC的衍生来源、大小、嵌合比例、组成结构以及包含的基因等显得尤为重要,是临床进行遗传学诊断及产前诊断的依据。针对有明确临床表型,同时核型检测到sSMC的病例,目前临床多采用CMA进行复查及确诊。但是需要注意的是CMA不能检测到平衡易位、倒位、低比例嵌合及多倍体等情况。
各个报道给出的sSMC携带频率不尽相同,目前尚无中国人群携带sSMC频率等相关报道。据文献报道,sSMC在人群中比较罕见,本病例代表一种新的sSMC(10)细胞遗传学形成机制,这在以往尚未见报道。课题组应用CMA技术对患儿基因组DNA进行分析,结果显示CMA分子核型为:arr[hg19]10p15.3p11.1(148,206~38,545,928)×3,片段大小为38.39 Mb。结合父母核型结果,分析患儿mar可能主要是由10号染色体短臂组成。
由于sSMC的常染色体组成、与sSMC同源的亲本染色体嵌合比例以及单亲二倍体程度等的不同,特定sSMC的表型是难以预测的。研究者普遍认为,携带sSMC的表型主要取决于sSMC中常染色质的含量以及嵌合比例。来自于10号染色体的sSMC非常罕见,本实验对已报道的sSMC(10)案例进行了总结,详见表1。这些病例中,其中有5例出现异常表型。未见异常表型的染色体来源区段分布在10p11.2q11.2以及10pterp14-15[6,11-12]。Trimbom et al[10]报道的患者是一个例外,报道了一个携带环状sSMC的14岁女孩(淋巴细胞嵌合比例为14%)呈现出生长发育迟缓、智力低下、肌张力减退、注意力下降等表型。由于技术手段的局限性,这些病例并未进行单亲二倍体检测,如果sSMC同源的亲本染色体来源于一个亲本,这样的患者是有可能表现出异常表型的。排除单亲二倍体以及其它未检测到的遗传学改变的情况下,临床上遇到10p11.2q11.2的sSMC,可以认定为良性变异。Snyder et al[5]和Chen et al[8]报道的病例几乎涉及到整个10号染色体短臂,患者出现了肾脏发育不全,指甲发育不全等多发畸形。Blennow et al[4]报道的10p11.1p12是涉及范围最小的致病性sSMC,本病例显示10p11.2p12可能是比较重要的致病区域,但其对sSMC范围的认定可能不是那么精确,且未进行单亲二倍体检测。
本研究患者由于涉及的片段比较大,几乎涉及到整条10号染色体短臂,且sSMC占比达到100%,依照ACMG和Clingen制定的CNV致病性判定指南,判定该CNV为致病性,该sSMC即为患儿致病原因。本例患儿是由于母亲的染色体易位,形成sSMC,在卵子形成过程中没有参与细胞分裂,遗传至患儿,核型分析显示该sSMC是由10号染色体的短臂和13号染色体短臂随体组成。本病例这种新的sSMC(10)细胞遗传学形成方式在以往尚未见报道。该患儿未见明显的结构畸形,进行了脑部核磁检测,留下了珍贵的病例资料。患儿脑部发现Dandy-Walker畸形等,这在以往尚未见报道,于以后的临床遗传学工作是一种启示。
