循环肿瘤细胞在局部晚期食管癌放化疗中的价值研究
2022-03-05黄于庭施险峰彭万仁
黄于庭,施险峰,汪 超,张 旭,彭万仁,王 华
食管癌为我国常见的消化道肿瘤,2017年我国新发病例23.5万例,死亡21.3万例,位居全球首位[1]。目前对于可切除食管癌仍然以手术为主要治疗方式,对于局部晚期食管癌患者,一线治疗手段为同步放化疗(concurrent radiochemotherapy, CRT),但效果并不理想[2]。因此,国内外多项临床试验正在积极探寻更佳的治疗方式,其中,诱导化疗+同步放化疗(induction chemotherapy & CRT, IC+CRT)为探索方向之一。循环肿瘤细胞(circulating tumor cells, CTCs)是自发或手术污染等原因导致原发或继发肿瘤进入外周血中的肿瘤细胞,在肿瘤发生、发展及转移过程中发挥重要作用[3]。血清CTCs阳性一般提示预后不良[4],部分CTCs可以形成转移灶,而诱导化疗可消灭外周血微转移灶,降低同步放化疗后转移风险,故CTCs阳性病例选择IC+CRT模式似乎更为合理,但尚有待考证。该研究旨在通过检测外周血CTCs,比较局部晚期食管癌患者经IC+CRT与CRT治疗后疗效、生存期的差异。
1 材料与方法
1.1 入组条件经检查为局部晚期不可切除的食管鳞癌;一般健康状态(performance status,PS)评分<2分;治疗前均行血清CTCs检测;无远处脏器转移;治疗前未行其他抗肿瘤治疗;血常规、生化指标基本正常;无严重脏器功能障碍。
1.2 病例资料依据入组条件,筛选2016年1月至2019年1月期间,安徽医科大学附属巢湖医院接受同步放化疗的食管癌患者临床资料124例。其中38例患者<65岁, 86例患者≥65岁;男:97例,女:27例; PS评分,0分:43例,1分:81例;依据AJCC第8版食管癌TNM分期标准[5],III期:45例,IVa期:79例;CTCs(+):64例,CTCs(-):60例。根据同步放化疗前有无接受诱导化疗,分为IC+CRT组62例,CRT组62例;诱导化疗方案包括紫杉醇类+铂类或氟尿嘧啶类+铂类,同步化疗方案包括双药三周方案或单药每周方案。两组的一般资料特征见表1,差异均无统计学意义。
1.3 CTCs检测方法初次治疗前使用STRECK管采集患者静脉血9 ml,采用 Next CTC第三代循环肿瘤活细胞自动捕获仪自动捕获循环肿瘤细胞。通过免疫荧光原位杂交(FISH)技术鉴定结果:若出现CEP8(+)、DAPI(+)、CD45(-)则判定为CTC,≥2个判定为阳性,<2个判定为阴性。
1.4治疗方法① 放疗:采用Elekta Precise直线加速器6MV X射线放疗,体位选用体部热塑膜固定,照射技术包括三维适形放疗(3-dimensional conformal radiation therapy, 3D-CRT)及静态野调强放疗(intensity modulated radiation therapy, IMRT),放疗范围为原发食管病灶(gross tumor volume, GTV)、淋巴结转移瘤(gross tumor volume of lymph node, GTV_nd)、亚临床病灶(clinical target volume, CTV)共同组成的区域外扩5~10 mm形成的计划靶区(planning target volume, PTV)。放射剂量依据个体耐受差异为50~66 Gy,分割剂量:1.8~2.0 Gy/f。② 化疗:依据患者个体化差异,放疗期间采用双药三周方案或单药每周方案同步化疗,化疗药物包括:紫杉类、铂类、氟尿嘧啶类。IC+CRT组患者在放疗前接受2~4周期诱导化疗,方案为紫杉醇类+铂类或氟尿嘧啶类+铂类,治疗期间化疗药物剂量均依据不良反应对标准剂量进行调整。
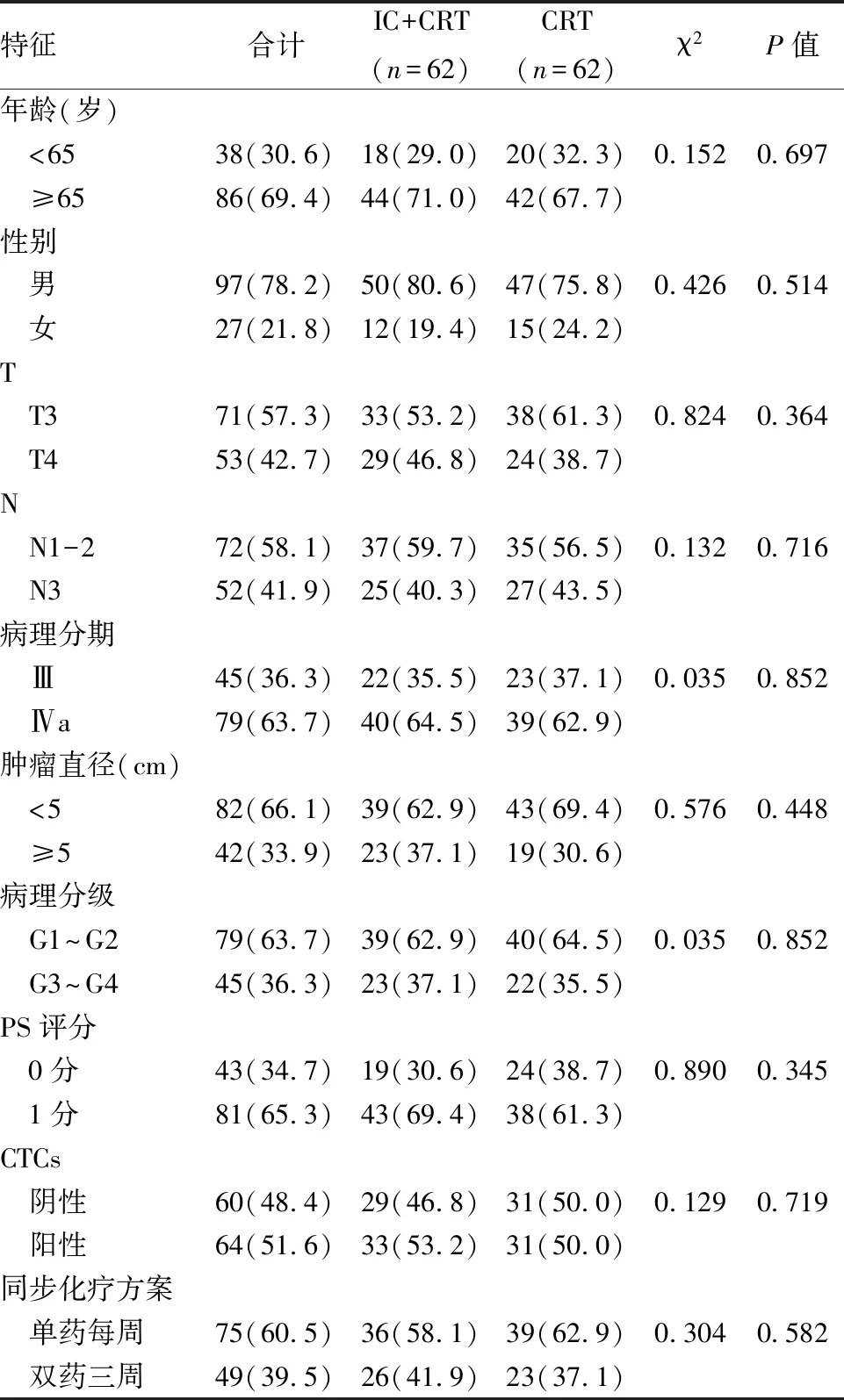
表1 食管癌患者的人口学特征和临床特征[n(%)]
1.5 疗效评价IC+CRT组在诱导化疗后2周行化疗疗效评价,所有患者同步放化疗结束3~4周行总体疗效评价,评价方法包括食管造影、胸+全腹CT、食管镜等等,依据实体肿瘤疗效评价标准(RECIST)[6],将治疗后的患者疗效分为:① 完全缓解(complete remission, CR):食管造影钡剂通畅,食管黏膜基本正常;食管镜未见肿瘤残存;CT食管管壁最大厚度<1.2 cm;淋巴结直径<1 cm。② 部分缓解(partial remission, PR):食管造影钡剂通过顺利,但仍有狭窄,肿瘤处最宽/最窄直径>1.5;食管镜残存肿瘤缩小≥50%;CT可见病灶长径之和减少≥30%。③ 疾病稳定(stable disease, SD):食管造影狭窄无变化;食管镜残存肿瘤缩小<50%或增大<20%;CT可见病灶长径之和减少<30%或增大<20%。④ 疾病进展(progressive disease, PD):食管造影狭窄明显加重;食管镜残存病灶增大≥20%;CT可见病灶长径之和增大≥20%,或出现新发病灶。
1.6 随访疗程结束后1个月复查,以后每3个月复查1次(2年以内),2年以后每6个月复查1次,复查过程中出现病情进展,则每3个月随访1次。末次随访时间截止于2020年12月,复查项目主要包括:常规体检、胸腹部CT、肿瘤指标、食管造影、食管镜,必要时可行血清CTCs、ctDNA、PETCT等。复查时原食管病灶、区域淋巴结较前进展定义为局部复发,出现实质脏器新发转移瘤或非区域淋巴结转移瘤定义为远处转移。
1.7 统计学处理分类资料采用样本量(百分比)来描述,组间比较采用χ2检验。运用Kaplan-Meier 法计算两组的总生存期(overall survival, OS)、无进展生存期(progression-free survival, PFS);采用Cox回归模型分析影响OS的因素。采用 R 软件进行森林图绘制,Graphpad Prism 7.0软件绘制生存图,SPSS 23.0 软件对数据进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 CTCs与人口学和临床特征的关联124例患者中,CTCs(+)共64例(51.6%),CTCs(-)60例(48.4%)。CTCs阳性率与肿瘤浸润(T)(χ2=5.827,P=0.016)、淋巴结转移(N)(χ2=16.521,P<0.001)、病理分期(χ2=11.888,P=0.001)相关。食管癌治疗后远处转移率(χ2=4.528,P=0.033)和肿瘤局部复发率(χ2=4.205,P=0.040)均与CTCs指标相关;CTCs(+)患者治疗失败主要原因为远处转移(65.6%vs46.7%),而CTCs(-)患者则为局部复发(66.7%vs48.4%);CTCs相关因素分析见表2。
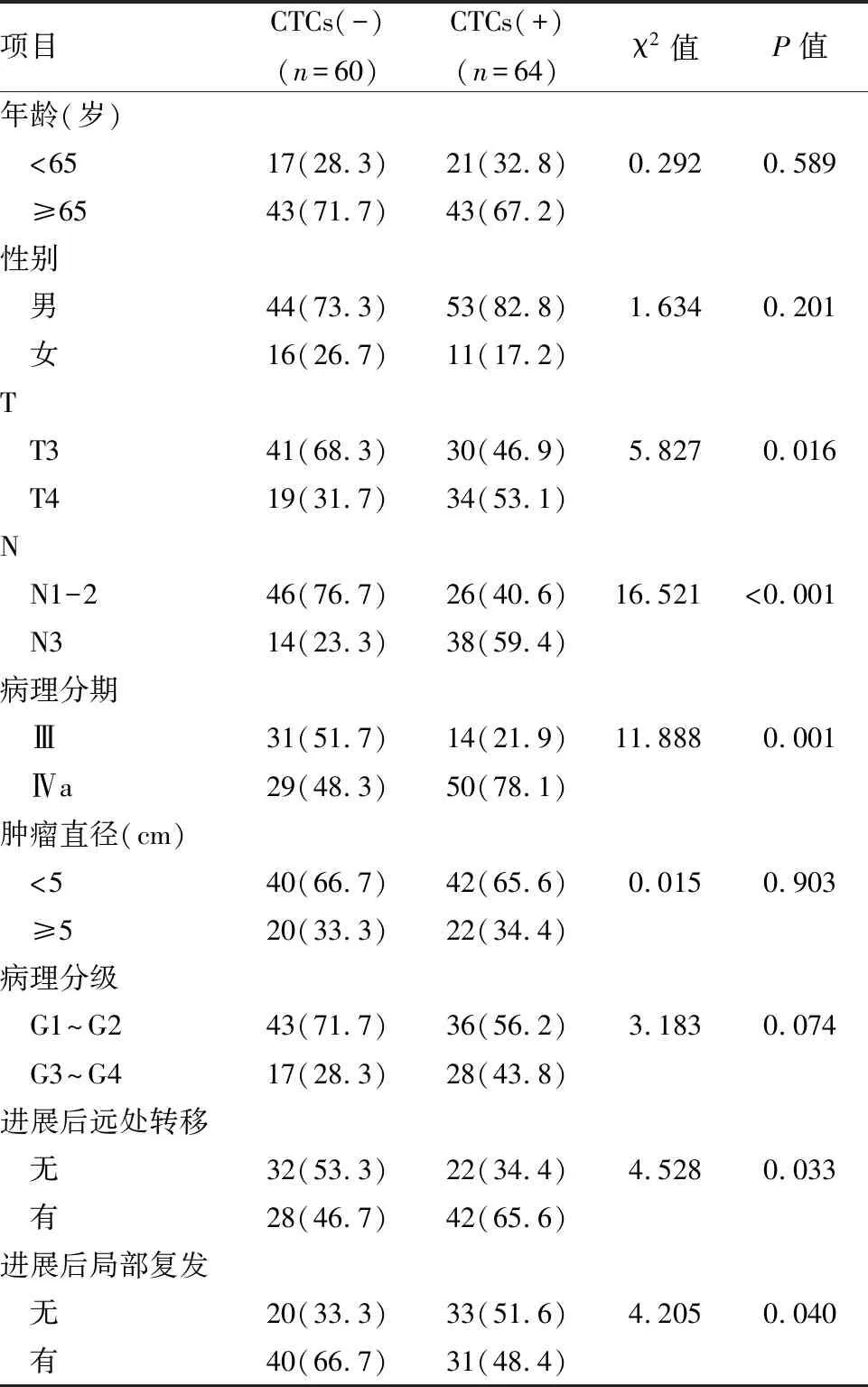
表2 CTCs 与人口学和临床特征的关联[n(%)]
2.2 CTCs与近期疗效IC+CRT组有效人数为45例(CR:18例,PR:27例),无效人数17例(SD:17例,PD:0例),客观缓解率(objective remission rates, ORR)为72.6%;CRT组有效人数为36例(包括CR:16例,PR:20例),无效人数26例(SD:25例,PD:1例),ORR为58.1%,两组间差异无统计学意义(χ2=2.884,P=0.089)。进一步根据CTCs阳性与否进行分层分析显示,CTCs(+)亚组中,IC+CRT组ORR为72.7%,CRT组为48.4%,差异有统计学意义(χ2=3.978,P=0.046);在CTCs(-)亚组中,IC+CRT组ORR为72.4%,CRT组为67.7%,差异无统计学意义(χ2=0.156,P=0.693)。见表3。

表3 两组患者近期疗效评价及CTCs分层分析[n(%)]
2.3 CTCs与远期疗效在对124例患者进行随访的过程中,共有8例发生失访。IC+CRT组和CRT组中位OS分别为23个月和15个月,IC+CRT组高于CRT组(χ2=5.286,P=0.021,图1A);且IC+CRT组PFS也高于CRT组(IC+CRT:18个月,CRT组:11个月,χ2=4.168;P=0.041,图1B)。根据CTCs阳性与否进行分层后,CTCs(+)亚组中,IC+CRT组OS高于CRT组(χ2=7.045,P=0.008,图1C),中位OS分别为 21个月、12个月;CTCs(-)亚组中两组中位OS均为24个月,差异无统计学意义(χ2=1.140,P=0.286,图1D)。
2.4 预后分析Cox回归单因素分析结果显示区域淋巴结(Node,N)(HR=1.515,P=0.034),分期(HR=1.846,P=0.002)和CTCs指标(HR=1.664,P=0.009)是影响OS的危险因素,而放化疗模式(HR=0.663,P=0.032)是OS的保护因素。进一步多因素分析结果显示N差异无统计学意义(HR=0.886,P=0.636),肿瘤分期(HR=1.844,P=0.019)和CTCs(HR=1.666,P=0.012)指标是影响OS的危险因素,而放化疗模式(HR=0.617,P=0.014)是OS的保护因素,即肿瘤分期晚、CTCs阳性的患者OS更短,接受IC+CRT治疗的患者比CRT治疗的患者OS更长。见表 4。
2.5 远期疗效亚组分析IC+CRT组优于同步组(HR=0.663,P=0.032)。进一步亚组分析显示年龄≥65岁(HR=0.547,P=0.011),肿瘤直径<5 cm(HR=0.563,P=0.017),病理分级G1~G2(HR=0.563,P=0.017)和CTCs(+)(HR=0.499,P=0.012)亚组中均可获益,而在其他亚组中差异无统计学意义。见图2。

图1 CTCs与OS 和PFS 生存曲线
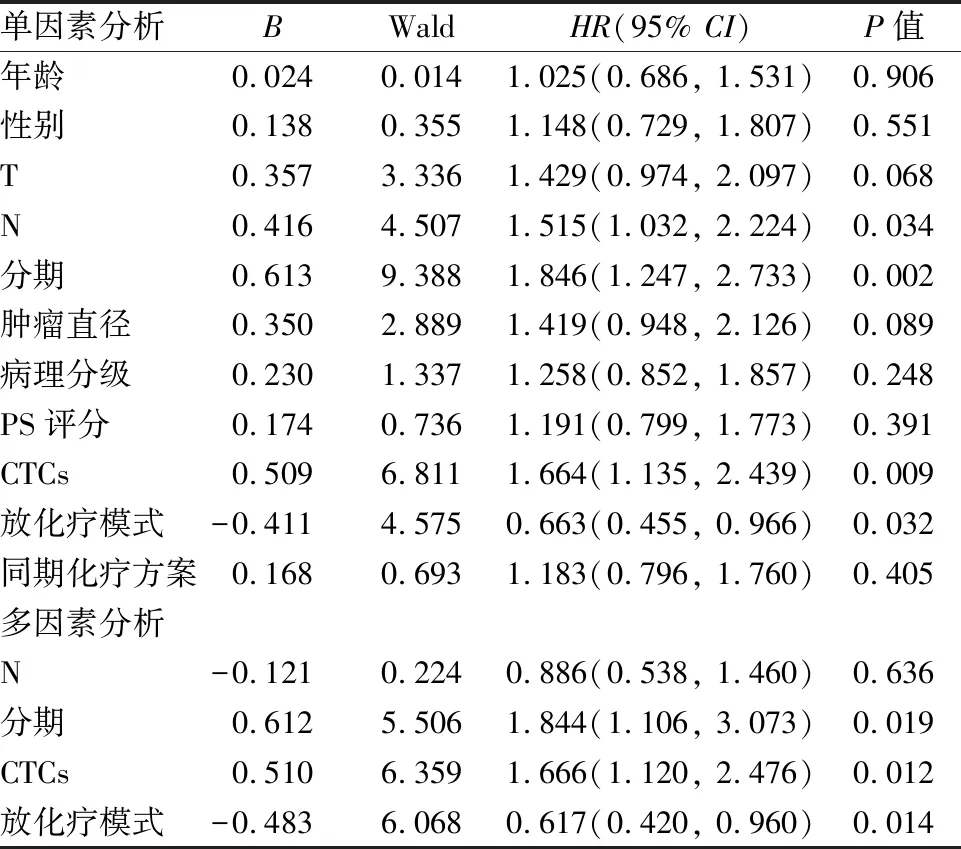
表4 影响食管癌患者OS的Cox回归分析
3 讨论
2019年NCCN指南将同步放化疗作为局部晚期食管癌治疗I级推荐[7],但效果并不理想,对于诱导化疗+同步放化疗,目前研究结论尚有争议,本研究通过回顾比较了两种放化疗模式的疗效差别,并引入CTCs指标观察其对不同放化疗模式的影响,以期为局部晚期食管鳞癌的放化疗模式选择提供参考。

图2 两组间影响OS的亚组分析
CTCs从被提出到进入临床应用已经经历了上百年时间,本研究显示CTCs指标与T、N、分期均有关,并可影响治疗后的复发转移率。Qiao et al[8]对59例食管癌手术患者术前CTCs样本分析发现:CTCs与肿瘤分化程度、肿瘤浸润、淋巴结和远处转移均有关,cox回归分析发现:性别、年龄、肿瘤位置、肿瘤分化和肿瘤大小均与OS和PFS无关。相反,术前CTCs水平(≥3个CTCs/7.5 ml)、淋巴结转移、远处转移和病理分期与OS和PFS相关,结论与本研究结果相似。CTCs被证实可用于肿瘤的疗效及预后判断,甚至可用于肿瘤治疗方案的决策。Zhao et al[9]在115例食管癌手术患者的研究中,57例接受术前化疗,58例接受术后化疗,两组的2年OS率及PFS差异无统计学意义。但亚组分析显示在CTCs(+)的病例中,术前化疗组PFS明显优于术后化疗组(71.90%vs38.73%,P=0.037 9),故建议术前检测CTCs(+)的患者可优先考虑术前化疗。那么,同步放化疗与手术同样作为局部治疗,CTCs能否对放疗前诱导化疗的选择产生影响值得期待。
目前国内外有关诱导化疗+同步放化疗用于局部晚期食管癌的前瞻性研究较少,且其价值尚无定论。王修身 等[10]对267例接受同步放化疗的食管癌患者根据是否行诱导化疗1:1配对分成诱导组及同步组,各85例,结果显示诱导组ORR(74.1%vs58.8%,P=0.035)、3年PFS率(34.8%vs15.4%,P=0.015)、3年OS率(44.2%vs29.7%,P=0.028)均优于同步组。另一项回顾性研究[11]报道了535例接受新辅助放化疗的食管癌患者,其中218例在新辅助放化疗前接受了诱导化疗,结果显示诱导组与非诱导组的无病生存率(53.7%vs45.1%,P=0.196)、OS率(55.5%vs54.0%,P=0.792)差异无统计学意义,但亚组分析发现:具有多个高危因素的亚组中,加入诱导化疗的患者5年无病生存率提高(40.4%vs26.8%,P=0.03),5年OS率提高,但差异无统计学意义 (38.0%vs28.5%,P=0.238),从而认为诱导化疗针对预后不良的患者获益更大。本研究显示,两组近期疗效接近有统计学意义(P=0.089),远期疗效诱导组优于同步组,PFS、2年OS率、3年OS率均优于同步组。提示诱导化疗可提高患者生存,但进一步研究发现,并非所有患者均可从诱导化疗中获益。Kuvendjiska et al[12]对20例食管癌患者新辅助化疗、手术前后全程CTCs监测的研究中认为:CTCs指标可以在制定治疗方案前提供重要信息,如果术前血清中检测到CTCs,则术前新辅助治疗可能为更佳选择。在本研究中,CTCs(+)患者在加入诱导化疗后近期疗效、远期疗效均明显提高,而CTC(-)患者则获益不明显,提示针对CTCs(+)病例选择诱导化疗更为适合,同时推断CTCs(-)可能为部分研究中诱导化疗无法提高生存获益的原因之一。另外,对远期疗效亚组分析时发现,病理分级G3~G4、年龄<65岁、肿瘤直径>5 cm诱导化疗获益不明显,可能与低分化癌迅速进展、进展后续治疗方案选择、诱导化疗方案无效[13]、化疗药物剂量等因素有关,需要进一步展开前瞻性研究探索。
本研究有一定局限性,回顾研究受限于病例数选择,及个体体质差异,少部分高龄、耐受性较差患者需要针对性个体化治疗,无法统一化疗药物剂量,可能会对研究结果产生些许影响。
综上所述,同步放化疗前加入诱导化疗可提高局部晚期食管癌患者的疗效及生存率,其中,CTCs(+)患者两种放化疗模式生存差异更加明显,而CTCs(-)患者差异则无统计学意义,提示CTCs指标对放化疗模式的选择可能具有一定参考价值,值得展开前瞻性大样本量研究进一步证实。
