黄芪保心汤辅治扩张型心肌病心力衰竭临床观察
2022-03-04张刘扛
张刘扛
(河南省柘城中医院心血管内科,河南 柘城476200)
心力衰竭是扩张型心肌病(Dilated cardiomyopath,DCM)常见并发症,DCM心衰病程较长且预后差,可造成呼吸功能、循环系统功能及肾功能受损。黄芪保心汤有散瘀解毒、养阴益气功效[1]。本研究用黄芪保心汤辅治DCM心衰效果较好,报道如下。
1 临床资料
共90例,均为我院2017年2月至2020年11月收治患者,按照随机数字表法分为观察组和对照组各45例。对照组男23例,女22例;年龄49~70岁,平均(59.46±5.07)岁;病程1~12年,平均(6.07±2.53)年;心功能分级为Ⅱ级10例,Ⅲ级20例,Ⅳ级15例。观察组男25例,女20例;年龄49~72岁,平均(60.13±5.54)岁;病程1~12年,平均(6.30±2.58)年;心功能分级为Ⅱ级9例,Ⅲ级20例,Ⅳ级16例。两组基线资料比较无显著差异(P>0.05)。研究经院伦理委员会审批通过。
符合DCM心衰中医辨证标准[2],为瘀毒犯心,气阴两虚证。主症为喘息,心悸,气短,乏力;次症为盗汗自汗,咽干口渴,口唇、面色紫暗,手足心热;脉细数结代或无力,舌质有瘀斑,紫暗或暗红,舌体瘦,无苔、少苔,有裂纹或剥苔。
符合DCM西医相关诊断标准[3]及心衰相关诊断标准[4]。LVEF(左心室射血分数)<45%,心功能Ⅱ~Ⅳ级,近期未使用其他可影响研究疗效的相关药物,患者及家属均知情了解研究并签订同意书。
排除伴有造血系统、内分泌系统等严重疾病,存在严重心源性休克、心律失常,存在肺、肾、肝等严重器官疾病,伴有感染性疾病,伴有恶性肿瘤疾病,哺乳或妊娠期女性,对研究所用药物不耐受。
2 治疗方法
两组均给予呋塞米(河北东风药业有限公司,国药准字H13021856),安体舒通(通化茂祥制药有限公司,国药准字H20030359),ACEI类药物首选卡托普利(唐山集川药业利康制药有限公司,国药准字H13022158),若卡托普利不耐受则更换为缬沙坦(浙江华海药业股份有限公司,国药准字H20183126),美托洛尔(AstraZeneca AB,国药准字J20150044)。
观察组加用黄芪保心汤。药用党参12g,连翘12g,茯苓12g,鳖甲12g,当归12g,黄芪30g,丹参12g,桂枝6g,麦冬12g,五味子6g。日1剂,水煎煮取汁200mL,日服2次,每次服100mL。
两组均持续治疗3个月后观察疗效。
3 观察指标
采用超声诊断系统(美国Philips公司,型号EPIQ7C)检测心功能指标水平,包括LVESD(左心室收缩末内径)、LVEDD(左心室舒张末内径)及LVEF,连续检测3个心动周期,并取平均值。采用6min步行运动试验评估6min步行距离,试验3次取平均值。采用ELISA法检测神经内分泌因子水平,包括AngⅡ(血管紧张素Ⅱ)、ET(内皮素)、NT-proBNP(血浆N末端B型钠尿肽)、PRA(肾素活性)、ALD(醛固酮)。
用SPSS22.0软件分析,计量资料以(±s)表示、用t检验,计数资料以(%)表示、用χ2检验,P<0.05为差异有统计学意义。
4 疗效标准
显效:主要体征及症状显著改善,心功能等级上升2级。有效:主要体征及症状明显改善,心功能等级上升1级。无效:主要体征及症状无明显改善,心功能等级无变化。
5 治疗结果
两组临床疗效比较见表1。
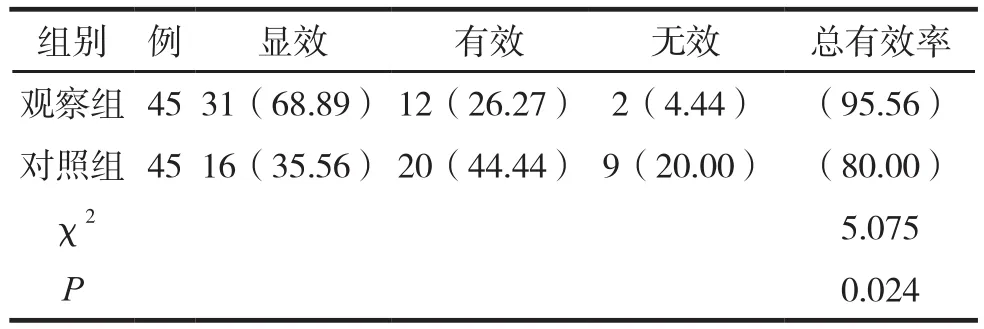
表1 两组临床疗效比较 例(%)
两组治疗前后心功能指标比较见表2。
表2 两组治疗前后心功能指标比较 (±s )
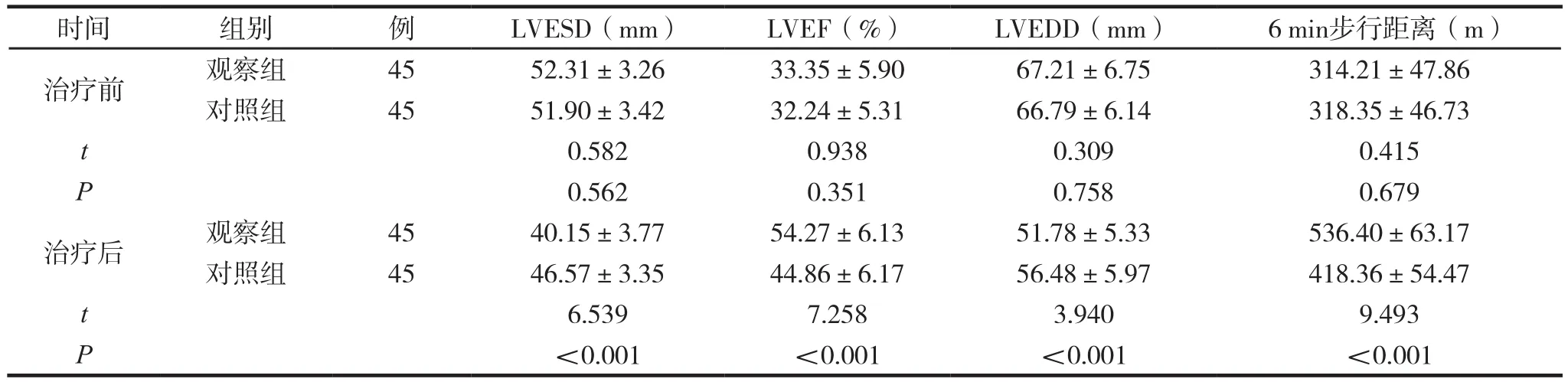
表2 两组治疗前后心功能指标比较 (±s )
时间 组别 例 LVESD(mm) LVEF(%) LVEDD(mm) 6 min步行距离(m)治疗前 观察组 45 52.31±3.26 33.35±5.90 67.21±6.75 314.21±47.86对照组 45 51.90±3.42 32.24±5.31 66.79±6.14 318.35±46.73 t 0.582 0.938 0.309 0.415 P 0.562 0.351 0.758 0.679治疗后 观察组 45 40.15±3.77 54.27±6.13 51.78±5.33 536.40±63.17对照组 45 46.57±3.35 44.86±6.17 56.48±5.97 418.36±54.47 t 6.539 7.258 3.940 9.493 P<0.001 <0.001 <0.001 <0.001
两组治疗前后神经内分泌因子水平比较见表3。
表3 两组治疗前后神经内分泌因子水平比较 (±s )
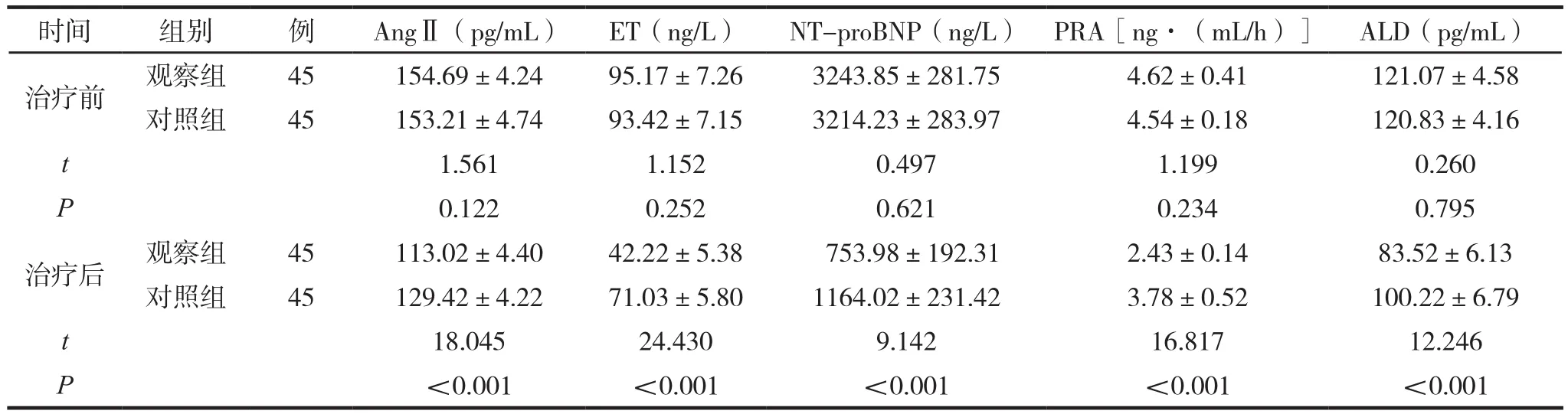
表3 两组治疗前后神经内分泌因子水平比较 (±s )
时间 组别 例 AngⅡ(pg/mL) ET(ng/L) NT-proBNP(ng/L) PRA[ng·(mL/h)] ALD(pg/mL)治疗前 观察组 45 154.69±4.24 95.17±7.26 3243.85±281.75 4.62±0.41 121.07±4.58对照组 45 153.21±4.74 93.42±7.15 3214.23±283.97 4.54±0.18 120.83±4.16 t 1.561 1.152 0.497 1.199 0.260 P 0.122 0.252 0.621 0.234 0.795治疗后 观察组 45 113.02±4.40 42.22±5.38 753.98±192.31 2.43±0.14 83.52±6.13对照组 45 129.42±4.22 71.03±5.80 1164.02±231.42 3.78±0.52 100.22±6.79 t 18.045 24.430 9.142 16.817 12.246 P<0.001 <0.001 <0.001 <0.001 <0.001
6 讨 论
DCM心衰属中医“喘证”、“心胀”范畴。属本虚标实之证,痰饮、外邪、血瘀、水湿为标,正虚为本[5]。黄芪保心汤中党参、黄芪益气健脾,鳖甲、当归、丹参、麦冬、五味子扶正养阴、化瘀活血,连翘解毒清心,茯苓、桂枝除湿健脾、利水通阳[6]。药理研究证实,黄芪所含黄芪皂苷生物活性较高,可促进心肌能量代谢,增强人体免疫功能。桂枝、连翘具有减轻心肌细胞损伤的作用。当归、丹参可抑制血小板聚集,预防血栓形成[7]。
DCM心衰发生造成压力负荷及心脏容量增大,自体心室细胞产生NT-proBNP,NT-proBNP对心衰诊断具有特异性、敏感性,是反映DCM心衰程度的重要指标。相关研究表明,肾素-血管紧张素-醛固酮系统(RAAS)的过度激活是造成DCM心衰的重要因素,AngⅡ、PRA、ALD是RAAS系统中的重要因子,DCM心衰发病过度激活RAAS系统,促使间质纤维化及心肌肥大,进一步介导心室重构;ALD可造成水钠潴留,可直接损伤心脏功能及心脏结构;AngⅡ可造成成纤维细胞增殖速度加快,促使细胞凋亡及心肌纤维化加重[8]。DCM心衰严重程度与血管内皮细胞受损程度密切相关,ET属强效促血管收缩的活性物质,作为神经调节肽的一种,可释放神经激素,调节神经分泌系统。DCM心衰病发时,ET因调节系统刺激而大量释放,可作为心功能评价参考指标[9]。因此,调节神经内分泌因子水平对治疗DCM心衰具有重要作用。
