槲皮黄酮抑制LRIG2/EGFR 信号转导诱导人皮肤鳞状细胞癌细胞凋亡
2022-03-04张洋吕君陈尚周雷淑英
张洋,吕君,陈尚周,雷淑英
(恩施土家族苗族自治州中心医院,湖北 恩施 445000)
过度暴晒、晒伤病史常与恶性皮肤癌的发生率增加有关,皮肤癌在白种人群中是较为常见的恶性肿瘤,每年全世界新增300 万的非黑色素瘤皮肤癌患者[1]。非黑色素瘤皮肤癌发病率的增加,迫切需求开发新的治疗方法、预防措施,以及优化诊断。非黑色素瘤皮肤癌起源于角质形成细胞,根据肿瘤发生的细胞类型可分为基底细胞癌和皮肤鳞状细胞癌(Cutaneous squamous cell carcinoma,CSCC)[2-3]。已有研究指出,生长因子及其受体表达失调对肿瘤的发生和发展有着重要影响[4],其中表皮生长因子受体(EGFR)在CSCC 中起着关键作用[5]。EGFR 在人表皮中广泛表达,调节表皮内环境稳定、细胞增殖、分化和细胞死亡等过程[6]。
富含亮氨酸重复序列和免疫球蛋白样结构域2(LRIG2)属于一种跨膜蛋白,在整个表皮中均有表达,参与受体酪氨酸激酶的调节,如EGFR 受体[7]。LRIG2 可促进EGFR 信号转导作为胶质母细胞瘤细胞的正反馈回路,提示LRIG2 是一种促癌基因[8]。近期研究表明,LRIG2 可通过激活EGFR 信号通路增加CSCC 的癌变过程[9]。
Qu 是黄酮类化合物,主要分布在蕨类植物、裸子植物及被子植物中,有较强的抗肿瘤活性[10]。已有研究证实Qu 对辐射诱导的皮肤纤维化有保护作用[11]。然而,Qu 对CSCC 细胞的增殖是否有抑制作用,尚未见报道。因此,本实验观察Qu 对A431 细胞增殖、凋亡及LRIG2/EGFR 信号转导的影响。
1 材料及方法
1.1 一般资料
1.1.1 材料及试剂 A431 细胞株来源于上海ATCC 细胞库;DMEM 培养液、胎牛血清、胰蛋白酶购自Gibco 公司;CCK8 试剂盒购自Solarbio 公司,批号40203ES60;RIPA 裂解液购自杭州四季青公司,批号SB203580;BCA 蛋白定量试剂盒购自北京康为世纪,批号H20000337;Annexin V/FITC 细胞凋亡试剂盒购自北京四正柏生物公司,批号KGA107;含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-3/9 活性检测试剂盒购自Solarbio 公司,批号C10268951;兔抗鼠Bax(批号ab1098963)、B 淋巴细胞瘤-2 基因(Bcl-2,批号ab0983652)、LRIG2(批号ab02764633)、EGFR(批号ab2019874)、p-EGFR(批号ab0023876)及β-actin(批号ab1829095)抗体购自英国Abcam公司;羊抗兔IgG 二抗(上海谷歌生物公司);ELC化学发光检测试剂盒(Advansta)。
1.1.2 主要仪器 BIORAD-550 型酶标仪(美国伯乐公司);BBS-V800 型单人超净台(山东鑫贝西公司);SPX-250 型细胞培养箱(美国Thermo 公司);GE-100 型凝胶电泳仪(北京六一仪器厂);Amersham Imager 600 仪器(BIO-RAD,美国);FACSCalibur 型流式细胞仪(美国Becton Dickinson 公司)。
1.2 方法
1.2.1 A431 细胞培养 采用含10%胎牛血清和1%抗生素的的DMEM 培养基对A431 细胞进行培养,培养箱条件设置为5%二氧化碳(CO2)、37 ℃恒温。待细胞融合至90%左右时,便进行传代培养。首先磷酸盐缓冲液(PBS)清洗细胞2 遍,加入胰蛋白酶进行消化细胞,待细胞变圆后加入培养基终止消化,转移至EP 离心管,1 000 r/min(离心半径20 cm)离心5 min,弃去旧培养液,加入新鲜培养液重悬细胞进行后续实验。
1.2.2 CCK8 实验 将对数期A431 细胞接种于96孔板,每孔1×104个细胞,培养过夜,然后加入10~200 μg/mL 的Qu 处理细胞12、24、48、72 h 后,弃去旧培养液,每孔加入100 μL 含10 μL 的CCK8 试剂的DMEM 培养液,放入培养箱中继续孵育1.5 h,在酶标仪450 nm 波长处检测细胞吸光度OD 值,并计算细胞相对活力。计算公式如下:细胞相对活力(%)=OD实验组/OD对照组×100%。
1.2.3 细胞克隆数分析 将对数期A431 细胞接种于6 孔板,每孔1 000 个细胞,培养过夜,然后加入10~200 μg/mL 的Qu 处理细胞6 d 后,每2 d 更换1次含药的新鲜培养液;然后对克隆细胞进行染色并计数。
1.2.4 5-溴-2-脱氧脲苷试剂(BrdU)ELISA 实验 将对数期A431 细胞接种于96 孔板,每孔1×104个细胞,培养过夜;10~200 μg/mL 的Qu 处理细胞48 h 后,加入BrdU 试剂孵育12 h;再采用酶联免疫吸附测定(ELISA)试剂盒检测BrdU 偶联的细胞,并在酶标仪405 nm 处测定其吸光度OD 值。
1.2.5 流式细胞术 收集各组细胞,PBS 清洗2 次,采用2.0 mg/mL 的PI 染液和RNaseⅠ染色30 min,流式细胞仪立即检测细胞周期分布情况。另外,收集细胞,PBS 重悬后,分别加入Annexin-V FITC 和PI 处理细胞(按照试剂盒操作说明书进行),最后用流式细胞仪检测细胞凋亡情况。
1.2.6 Western blot 实验 收集各组细胞,每组加入200 μL 的裂解液,置于冰上充分裂解30 min,收集细胞裂解液,4 ℃条件下12 000 r/min(离心半径为20 cm)离心12 min,收集上清。BCA 法检测了上清中总蛋白浓度,每孔上样40 μg 进行电泳分离,恒压70 V,电泳3 h。然后在恒流275 mA 条件下电转70 min,5%脱脂牛奶封闭1 h 后,将目的条带放入对应的一抗溶液(稀释比1∶1 000)中,4 ℃摇床孵育过夜。洗膜缓冲液(TBST)洗膜3 次,10 min/次,再把条带放入盛二抗(稀释比1∶3 000)的平皿中室温孵育1 h,TBST 洗膜3 次,10 min/次。加入4 mL 的ECL 显影液显色3 min,凝胶成像系统曝光。
1.2.7 Caspase-3/9 活性试验 收集各组细胞,采用Caspase-glot-3/9 活性测定试剂盒检测Caspase-3/9活性,酶标仪在405 nm 处测定其吸光度值。
1.2.8 LRIG2 质粒转染 LRIG2 mimics 和LRIG2 inhibitor 质粒由武汉巴菲尔生物有限公司合成,序列分别为:5’-CTGGACAGTGTGTTTGA-3’,5’-CCUCAGAGUUCACGGACAU-3’。采用Lipofectamine 2 000 试剂转染质粒至A431 细胞,具体操作步骤严格按照说明书进行。
1.3 统计学分析 采用SPSS 19.0 统计软件进行统计分析,两两组间比较采用t 检验,多组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 Qu 对A431 细胞增殖活性的影响 Qu 对A431 细胞活力影响见图1a,发现浓度高于50 μg/mL的Qu 处理细胞48 h 和72 h 时,细胞活力相比于0 μg/mL 的Qu 组明显降低(P<0.05)。Qu 对A431 细胞克隆的影响见图1b,提示浓度>50 μg/mL 的Qu处理细胞48 h 时,细胞克隆数相比于0 μg/mL 的Qu 组明显降低(P<0.05)。Qu 对BrdU 偶联细胞数的影响见图1c,提示浓度高于50 μg/mL 的Qu 处理细胞48 h 时,BrdU 偶联细胞数相比于0 μg/mL 的Qu组明显降低(P<0.05)。另外,流式细胞术检测A431细胞周期分布如图1 d,100 μg/mL 的Qu 处理细胞48 h,G1期细胞数明显增高,而S 和G2期细胞数明显减少(P<0.05)。
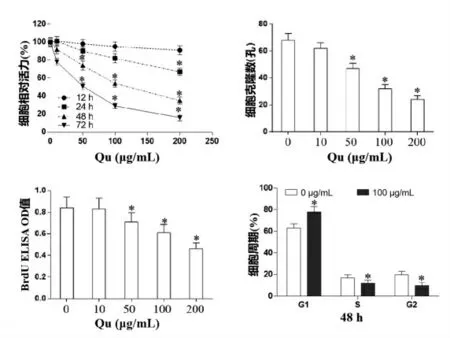
图1 Qu 对A431 细胞增殖的影响
2.2 Qu 多A431 细胞凋亡的影响 Qu 对A431 细胞中凋亡相关蛋白影响见图2a、b,发现Qu 能明显诱导促凋亡蛋白Bax 表达,而抑制抗凋亡蛋白Bcl-2表达(P<0.05)。Qu 对凋亡蛋白Caspase-3/9 活性影响见图2c,提示Qu 能明显诱导Caspase-3/9 活性增高(P<0.05)。另外,流式细胞术检测A431 细胞凋亡率见图2d,浓度高于50 μg/mL 的Qu 处理细胞48 h时,细胞凋亡率相比于0 μg/mL 的Qu 组明显升高(P<0.05)。
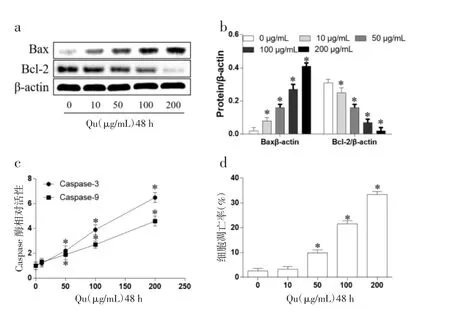
图2 Qu 对A431 细胞凋亡的影响
2.3 Qu 对A431 细胞中LRIG2/EGFR 信号通路的影响 100 μg/mL 的Qu 处理细胞48 h 时,相比于0 μg/mL 的Qu 组LRIG2 和p-EGFR 表达水平明显降低(P<0.05);然而,EGFR 表达水平没有发生明显变化(P>0.05),见图3。
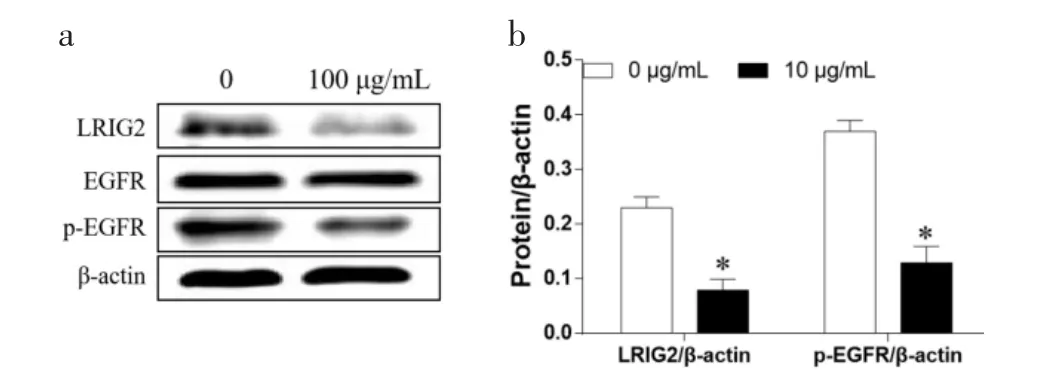
图3 Qu 对LRIG2/EGFR 信号转导的影响
2.4 EGFR 激动剂NSC228155 对A431 细胞生长的影响 Qu 与NSC 228155 共同处理A431 细胞48 h,对细胞活力和凋亡率检测结果见图4。提示Qu+NSC 228155 组细胞活力相比于Qu 组显著增高,而细胞凋亡率显著降低(P<0.05)。
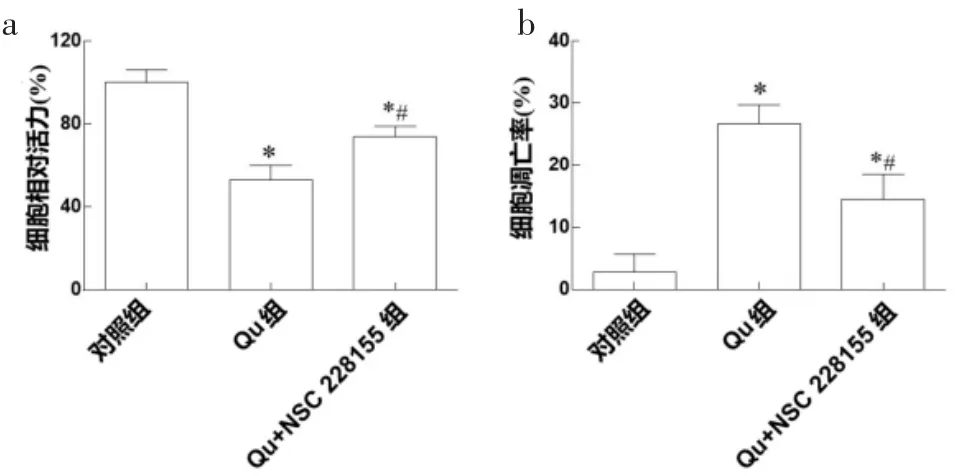
图4 NSC 228155 对A431 细胞生长的影响
2.5 Qu 通过LRIG2 诱导A431 细胞凋亡 LRIG2 mimics 和LRIG2 inhibitor 质粒转染A431 细胞,可分别上调和沉默LRIG2 基因表达,见图5a、b。相比于Qu 组,Qu+LRIG2 mimics 组p-EGFR 表达水平明显升高,细胞活力明显升高,细胞凋亡率显著降低(P<0.05);Qu+LRIG2 inhibitor 组p-EGFR 表达水平明显降低,细胞活力明显降低,细胞凋亡率显著增高(P<0.05)。相比于对照组,Qu+LRIG2 mimics 组p-EGFR 表达水平明显降低,细胞活力明显降低,细胞凋亡率显著升高(P<0.05);Qu+LRIG2 inhibitor 组p-EGFR 表达水平明显降低,细胞活力明显降低,细胞凋亡率显著升高(P<0.05),见图5c~f。3 讨论

图5 Qu 通过LRIG2 调节A431 细胞生长
Qu 有抗肿瘤的药理活性,表现出抑制癌细胞生长、诱导其凋亡的生物学效应。然而,相关作用机制尚不清楚。Qu 有多种抗癌特性,包括调节细胞信号传导、促凋亡、抗增殖、抗氧化及抑制生长等。事实上,现在学者们已经知道Qu 有多种生物学效应,抑制多种酶参与细胞增殖以及信号转导通路。另一方面,也有研究报告,当Qu 联合化疗药物或放射治疗对多种癌症都表现出潜在的协同效应,包括乳腺癌、前列腺癌、肺癌及肝癌等[12]。于是,该实验主要目的是阐述Qu 对体外培养的A431 细胞凋亡的诱导机制。实验结果提示,Qu 可抑制A431 细胞增殖,促使其凋亡;降低LRIG2 表达,抑制EGFR 磷酸化;Qu通过介导LRIG2/EGFR 信号转导诱导A431 细胞凋亡。肿瘤发生机制研究已证实细胞凋亡是药物化疗或放疗的结果,由信号网络基因的表达异常参与此过程。细胞凋亡途径包括死亡受体途径及线粒体途径,均能进一步活化Caspase-3,引发内切核酸酶活化,导致细胞凋亡发生[12-13]。Caspase 是调控细胞凋亡的主要蛋白,主要通过抑制Caspase-3 和Caspase-9活性阻断细胞的凋亡,并且这些蛋白的表达水平与CSCC 的增殖、凋亡相关密切[14-15]。本研究揭示Qu 能明显增强Caspase-3/9 活性、增高促凋亡蛋白Bax表达及抑制抗凋亡蛋白Bcl-2 表达,进而诱导A431细胞凋亡。
本课题进一步探讨了Qu 诱导A431 细胞凋亡的分子机制。LRIG2 蛋白是不同受体酪氨酸激酶的重要调节因子,参与EGFR 受体家族的正负反馈循环[16]。LRIG2 是一种促癌蛋白,其表达水平增高与宫颈鳞状细胞癌、非小细胞肺癌和胶质母细胞瘤的预后不良有关[17-19]。另外,LRIG2 在CSCC 细胞中表达水平明显上调,与促使了皮肤的癌变过程[9]。与上述研究结果类似,本实验发现Qu 降低LRIG2 表达水平,进而诱导A431 细胞凋亡。
EGFR 表达失调对肿瘤的发生和发展有着重要影响,包括CSCC[5]。EGFR 在人表皮中广泛表达,调节表皮内环境稳定、细胞增殖、分化和细胞死亡等过程[6]。本实验发现Qu 可抑制EGFR 磷酸化水平,进而降低A431 细胞增殖活性。采用EGFR 激动剂与Qu 共处理A431 细胞时,发现其可部分逆转Qu对A431 细胞的毒性作用,说明Qu 通过EGFR 信号通路发挥抗CSCC 的作用。实验进一步观察LRIG2关键蛋白的枢纽作用,对LRIG2 基因进行过表达和沉默,发现LRIG2 基因过表达会部分逆转Qu 对EGFR 磷酸化的抑制作用及A431 细胞的毒性作用,提示Qu 是通过LRIG2/EGFR 信号通路发挥抗CSCC 的药理活性。
综上所述,Qu 可通过诱导A431 细胞凋亡和抑制细胞增殖发挥抗肿瘤作用,其机制可能与抑制LRIG2/EGFR 信号通路活化有关。
