响应面法优化氧化槐定碱脂质体的制备及表征
2022-03-04郭留城杜利月冯慧慧高笑笑崔凤灵
郭留城,杜利月,冯慧慧,高笑笑,崔凤灵
(河南师范大学 化学化工学院,河南 新乡 453007)
氧化槐定碱(Oxysophoridine,OSR)是从豆科槐属植物苦豆子(SophoraalopecuroidesL.)中提取得到的一种重要的生物碱,现已经可以人工合成.现代药理学研究证明,OSR具有抗肿瘤、抗炎、抗菌、抗病毒、抗氧化等多种药理活性[1-4].然而,由于其半衰期短,体内没有靶向性,会导致人体产生呼吸减慢、昏迷、甚至死亡等不良反应[4].
在贮存的过程中,氧化槐定碱易变质.张军帅等人[5]采用冷冻干燥法将OSR制备成了粉针剂,延缓了制剂中OSR的变质,延长了OSR制剂的保质期,提高了OSR制剂的用药安全.然而将OSR制备成靶向制剂的研究,尚未见有报道.从提高临床疗效、降低副作用的角度入手,利用单因素实验和Box-Behnken响应面设计等实验技术,将OSR制备成具有靶向功能的脂质体制剂,可以在一定程度上提高OSR的疗效,降低毒副作用,方便临床用药,也可以丰富OSR的药物制剂,从而使OSR更好地服务于临床[6].薄膜法制备的脂质体分散性好,载药量较高[6-7],因此,本文采用改良薄膜法制备OSR脂质体.
1 实验部分
1.1 试剂与仪器
主要试剂:氧化槐定碱对照品(批号:190322,纯度98.7%)和氧化槐定碱原料(批号:190409)购于南京道斯夫生物科技有限公司,大豆卵磷脂(批号:EXR1DRK4)和胆固醇(批号:R8ARE2KU)购于上海萨恩化学技术有限公司,乙腈(色谱级,批号:C11988756)购于上海麦克林生化科技有限公司,蒸馏水自制,其他试剂均为分析纯.
主要仪器:JEM-2100型高分辨透射电子显微镜(日本电子公司)、Zetasizer Nano ZS 90(马尔文)激光粒度仪(德芮克国际股份有限公司)、1260型高效液相色谱仪(美国安捷伦科技公司)、Agilent Cary100型紫外-可见分光光度计(美国安捷伦科技公司)、RE100-S型旋转蒸发仪(北京大龙兴创实验仪器股份公司)、DSC204F1型差示扫描量热仪(德国耐驰公司)、Spectrum 400F型中远红外光谱仪(美国珀金埃尔默仪器有限公司)、MS105DU/A型分析天平(梅特勒-托利多国际有限公司).
1.2 溶液的配制及OSR脂质体的制备
OSR储备液的制备:精密称取OSR对照品13.2 mg,用双蒸水配制成1 mmol/L的溶液.
PBS缓冲溶液的配制:称取4.00 g NaCl,0.10 g KCl,0.72 g Na2HPO4,0.12 g KH2PO4溶于400 mL蒸馏水中,用HCl调节pH值至7.4,最后加蒸馏水定容至500 mL,即得PBS缓冲液[4].
大豆卵磷脂(Lecithin High Potency,LHP)和胆固醇(Cholesterol,CHO)混合液的制备:称取LHP 2.4 g和CHO 0.4 g,加入100 mL氯仿超声溶解后,制成240 mL溶液,作为LHP和CHO的混合液.
OSR脂质体的制备:取处方量的LHP和CHO混合溶液,在室温下,旋干溶剂,加入处方量的OSR(原料)溶液,37 ℃涡旋水合1 h,再加入处方量的PBS缓冲溶液,涡旋水合至规定时间,用0.45 μm微孔滤膜过滤,即得OSR脂质体[6,8-9].
供试品溶液的制备[8]:取OSR脂质体5 mL,离心分离脂质体,精密量取上清液2 mL,用PBS缓冲溶液稀释,使OSR的质量浓度约为120 μg/mL,摇匀,0.22 μm滤膜过滤,即得.
阴性溶液的制备[9]:制备不含OSR的空白脂质体,操作方法同“供试品溶液的制备”,即得.
1.3 OSR含量(质量分数)测定方法
1.3.1色谱条件
采用Waters Symmetry®C18色谱柱(250 mm×4.6 mm,5 μm);流动相为0.05%(质量分数)的三乙胺水溶液(磷酸调pH为3.5)与乙腈混合液(体积比为95∶5);流速:1.0 mL/min;检测波长:210 nm;柱温:30 ℃;进样量:10 μL.
1.3.2专属性实验
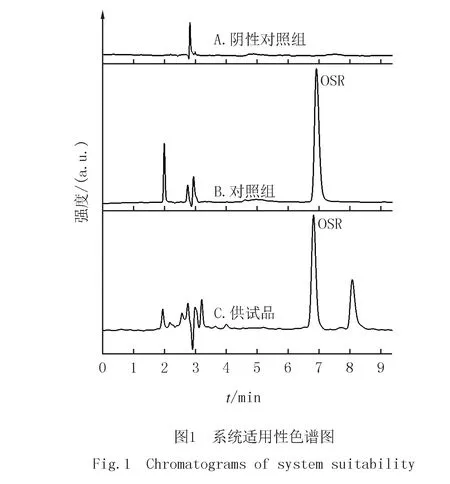
按照1.3.1中色谱条件设定仪器参数,进样量10 μL,取1.2中的对照品溶液、供试品溶液、阴性对照溶液,进样测定,记录色谱图谱[10-11].
1.3.3线性关系的考察
按照1.3.1中色谱条件设定仪器参数,取OSR储备液适量,制成240.840、187.320、133.800、80.280、26.760、24.084、18.732、13.380、8.028、2.676 μg/mL的溶液,分别进样测定,记录色谱图谱和峰面积[5,11],计算出回归方程.
1.3.4方法学考察
按照文献报道[5,11-12]的方法进行精密度实验、重复性实验和加样回收率实验.
精密度实验:取对照品溶液,进样6次,记录色谱图谱和峰面积.
重复性实验:平行制备OSR脂质体6批,按照1.2中供试品溶液的制备方法,制备供试品溶液,按照1.3.1中色谱条件做重复性实验,记录色谱图谱和峰面积.
加样回收率实验:取1 g LHP和300 mg CHO溶于10 mL氯仿中,在室温下,旋干溶剂.平行制备3批,分别加入OSR 120 mg、150 mg、180 mg,按照1.2中OSR脂质体的制备方法,制备3种不同质量浓度的OSR脂质体.按1.3.1中色谱条件,测定脂质体中OSR的质量分数,计算平均回收率.
1.4 包封率和载药量的测定
取制备好的OSR脂质体5 mL,在转速为50 000 r/min条件下,离心30 min[13],取上清液用0.22 μm滤膜过滤,按1.3.1中色谱条件,测定OSR的峰面积,计算OSR的质量,作为未包封OSR质量W1;制备脂质体时加入的OSR质量为W2,制备脂质体时加入的辅料质量为W3,分别计算包封率(encapsulation efficiency,EE%)和载药量(drug loading capacity,DL%)[6,8-9]:

1.5 单因素实验方法
改变LHP和CHO的质量比:固定LHP的用量为1 g,OSR的用量为150 mg,改变CHO的用量,使LHP和CHO的质量比为10∶0.5,10∶1.0,10∶3.0,10∶5.0,10∶7.0,10∶9.0和10∶10.0.按上述质量比,称取LHP和CHO,加入氯仿溶解后,按照1.2中操作,制备OSR脂质体.按1.2中供试品溶液的制备方法,将OSR脂质体制备成供试品溶液,按照1.3.1中色谱条件,采用HPLC法测定未包封的OSR,计算包封率[8-9].
改变LHP和OSR的质量比:固定LHP的用量为1 g,CHO的用量为300 mg,改变OSR的用量,使LHP和OSR的质量比为10∶0.5,10∶1.0,10∶1.5,10∶2.0,10∶3.0,10∶5.0和10∶7.0.按照1.2中操作,制备OSR脂质体.按1.2中供试品溶液的制备方法,将OSR脂质体制备成供试品溶液,按照1.3.1中色谱条件,采用HPLC法测定未包封的OSR,计算包封率[8-9].
水合时间的优化:量取LHP和CHO的混合液2 mL和1 mmol/L OSR缓冲溶液1 mL,分别采用0.5、1.0、1.5、2.0、2.5、3.0、3.5 h的水合时间制备OSR脂质体,按照1.2中操作,制备OSR脂质体.按1.2中供试品溶液的制备方法,将OSR脂质体制备成供试品溶液,按照1.3.1中色谱条件,采用HPLC法测定未包封的OSR,计算包封率[6,8-9].
1.6 响应面优化实验
单因素实验无法评估实验过程中不同因素之间的相互作用,因此,采用Design-Expert.V8.0.6.1 软件进行响应面设计,优化OSR脂质体的制备过程,以揭示这些不同单因素之间的相互作用,并优化OSR脂质体的制备过程[8-9,14-15].选择对包封率有显著影响的3个参数(LHP与CHO的质量比:A;LHP与OSR的质量比:B;水合时间:C,h)作为考察对象,以包封率作为测定指标.结合1.5中实验结果,每个因素选择3个级别.这3个因素的3个级别(-1、0、1)分别如下:LHP与CHO的质量比(10∶1.0,10∶3.0,10∶5.0),LHP与OSR的质量比(10∶1.0,10∶1.5和10∶2.0)和水合时间(1.0、1.5和2.0 h).构建了包含17个实验运行的设计矩阵,进行响应面优化实验.
1.7 验证实验
采用响应面实验优化后的最佳制备工艺,制备3批OSR脂质体,按1.2中供试品溶液的制备方法,分别将OSR脂质体制备成供试品溶液,按照1.3.1中色谱条件,采用HPLC法测定未包封的OSR,计算包封率.
1.8 OSR脂质体的表征
载药量的测定:取1.7中制备的OSR脂质体混悬液,按1.2中供试品溶液的制备方法,分别将OSR脂质体制备成供试品溶液,按照1.3.1中色谱条件,采用HPLC法测定未包封的OSR,按1.4中载药量计算公式,计算载药量.
脂质体形态:取1.7中制备的OSR脂质体混悬液,以超纯水适当稀释后,在专用铜网上制样,在防尘装置中静置并自然挥干,使OSR样品沉积在铜网上,放大5万倍,加速电压200 kV,观察并摄像[8-9].
粒径分布与Zeta电位:取1.7中制备的OSR脂质体混悬液,以超纯水适当稀释后,采用动态光散射仪测定Zeta电位、粒径及粒径分布[8,14].
红外光谱表征:取1.7中制备的OSR脂质体混悬液,真空干燥得OSR脂质体粉末.分别取CHO,LHP,OSR,物理混合物和OSR脂质体粉末,加入溴化钾固体,充分研细,压片,在400~4 000 cm-1范围内进行红外分光扫描,记录图谱[8].
差示扫描量热分析:取CHO,LHP,OSR,物理混合物与1.7中制备的OSR悬混液真空干燥后的脂质体粉末,进行差示扫描量热(differential scanning calorimetry,DSC)分析.工作条件:以空铝坩埚为空白参考池,另一铝坩埚为样品池,在样品池中放入样品约10 mg,置于机器中进行图谱扫描;N2作为吹扫气,扫描速度10 ℃·min-1,扫描范围30~300 ℃,记录图谱[8].
2 实验结果与讨论
2.1 测定方法的可靠性
2.1.1专属性实验结果
OSR含量测定方法的专属性实验结果见图1.结果显示OSR的分离度较好,专属性强,阴性无干扰.
2.1.2线性关系考察结果
测得的OSR峰面积,用Origin Pro 8.5软件进行线性回归分析,得回归方程为Y=5.487 27X-1.535 23,相关系数R2=0.999 5,线性范围为:2.676~240.840 μg/mL.结果显示OSR的质量分数与峰面积呈良好的线性关系.
2.1.3方法学考察结果
精密度实验测得的OSR峰面积,用Origin Pro 8.5软件进行线性回归分析,峰面积的RSD值为0.58%(n=6).重复性实验测得的OSR峰面积,用Excel 2016软件进行相对标准偏差(RSD值)分析,峰面积的RSD值为0.91%(n=6).回收率实验测得的OSR峰面积,用Excel 2016软件进行均值和相对标准偏差(RSD值)分析,3种不同质量浓度的OSR溶液,平均回收率分别为98.53%,99.22%,98.79%,RSD值分别为0.83%,0.93%,0.86%(n=3).结果表明,精密度、重复性和回收率均符合《中华人民共和国药典》2020年版四部通则9101项下规定.
2.2 单因素实验结果
LHP与CHO不同质量比的单因素实验结果见图2.由图2可知,随着CHO质量的增加包封率先升高,随后下降,在LHP和CHO的质量比为10∶3.0时包封率达到最佳.LHP与OSR不同质量比的单因素实验结果见图3.由图3可知,随着OSR质量的增加包封率先升高,随后下降,在质量比为10∶1.5时包封率达到最佳.


不同水合时间对OSR脂质体影响的单因素实验结果见图4.由图4可知,随着水合时间的增加包封率逐渐升高,在水合时间大于1.5 h时包封率基本不再增加.因此,选择LHP与CHO的质量比为10∶1.0,10∶3.0,10∶5.0,LHP与OSR的质量比为10∶1.0,10∶1.5和10∶2.0和水合时间为1.0、1.5和2.0 h,作为响应面优化实验的因素水平.
2.3 响应面优化实验结果
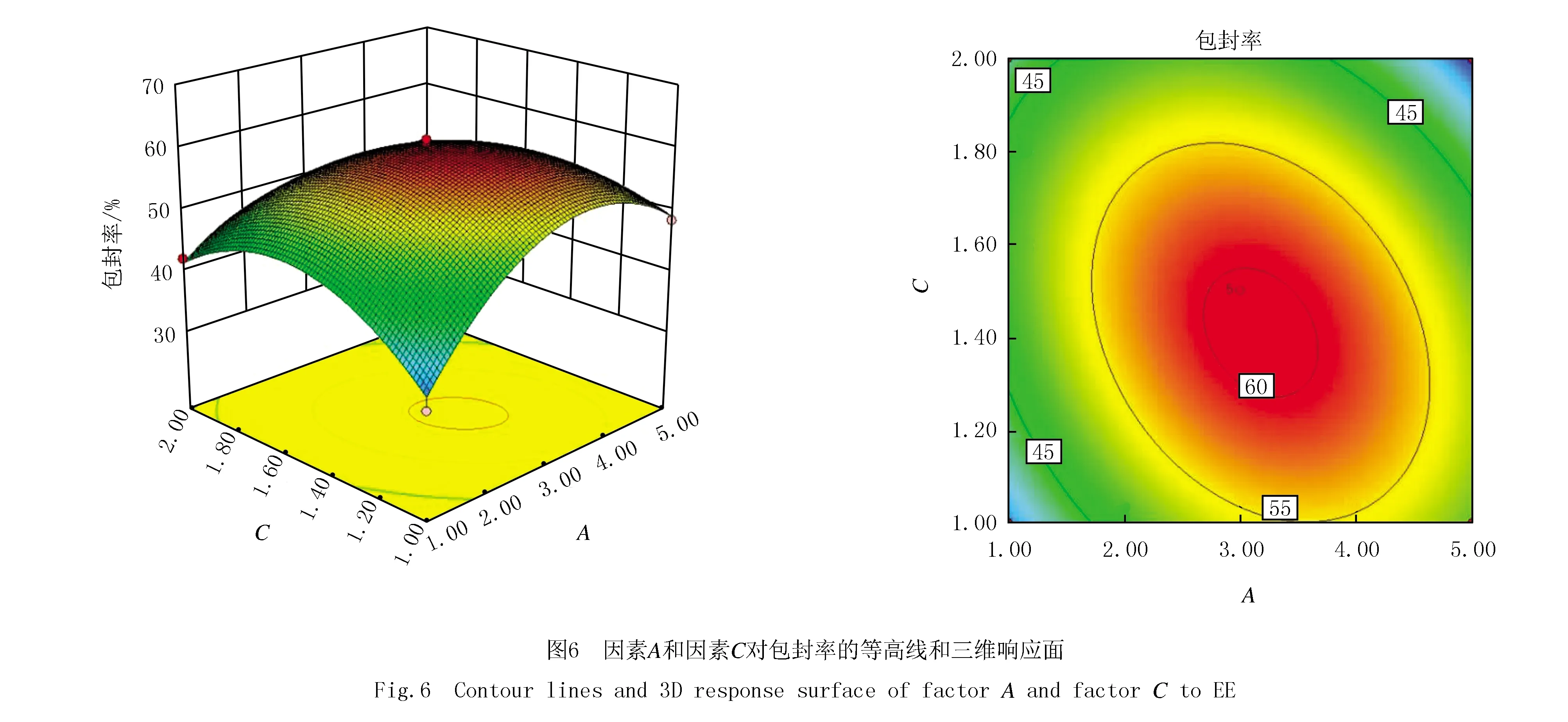
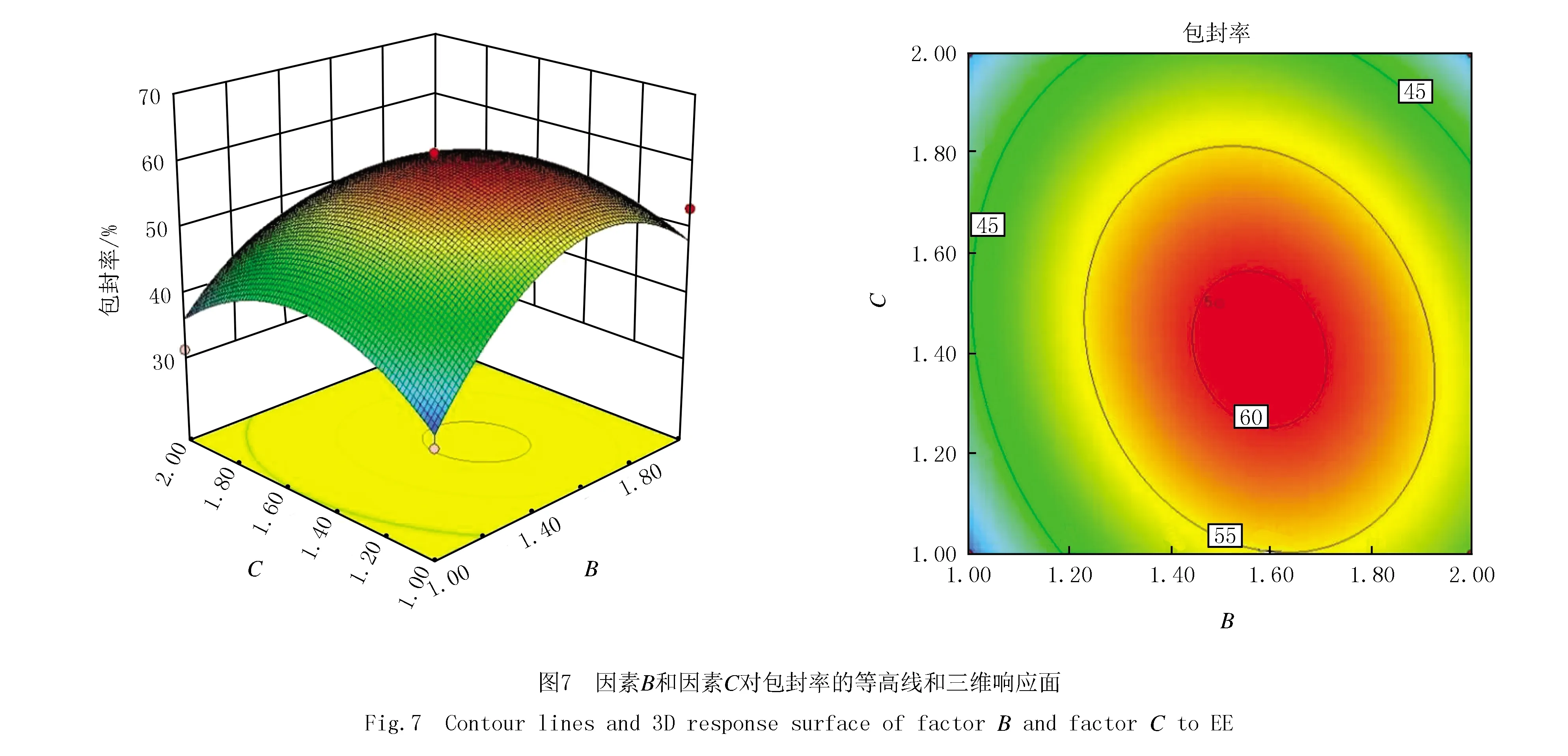
应用Design-Expert V8.0.6.1对实验数据进行分析,响应面优化实验设计与结果见表1,响应面模型的方差分析结果见表2,3个因素对包封率的等高线和三维响应面见图5、图6和图7.以包封率对各因素自变量进行模型拟合,通过拟合得到的二次回归方程为OSR包封率(%)=59.27+0.79A+1.89B-1.15C-0.62AB-3.96AC-1.72BC-11.58A2-12.48B2-9.66C2(R2=0.938 6,失拟度检验F值为5.65,P=0.063 8>0.05),由拟合方程结果可知拟合模型F值为11.90(P=0.001 8<0.05),信噪比值为8.425,相对较高,表明该拟合模型拟合结果良好,实测值与预测值之间的相关性较高,能够高度准确地预测实验结果的实际情况.

表1 Box-Behnken实验设计与结果

表2 Box-Behnken响应面模型的方差分析
根据二次回归方程拟合结果,固定一个因素水平[14-15],进行OSR包封率对其他两个因素的拟合,得到实验结果的三维效应曲面图,并对OSR的提取工艺参数进行优选.图5、图6和图7中OSR的包封率随着各变量的增加而增加,到达最大值后逐渐下降.最佳制备工艺处方为:LHP与CHO的质量比为10∶3.09、LHP与OSR的质量比为10∶1.54、水合时间为1.46 h,与单因素实验结果基本吻合.

2.4 工艺验证实验结果
按最优工艺制备的3批OSR脂质体的包封率分别为57.68%,57.30%,59.09%,平均包封率为58.02%,RSD值为1.63%.OSR脂质体包封率的实测平均值为58.02%与预测值为59.41%非常接近,偏差较小,预测性良好,说明OSR的最佳制备工艺稳定、可行.
2.5 OSR脂质体的表征
2.5.1载药量的测定
按最优工艺制备的3批OSR脂质体的载药量分别为6.24%,6.20%,6.38%,平均载药量为6.27%,RSD值为1.52%,平行3批OSR脂质体的载药量误差较小,说明OSR的最佳制备工艺稳定.
2.5.2脂质体形态
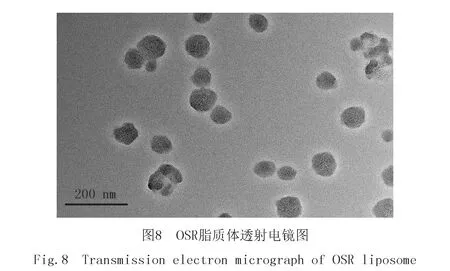
透射电镜拍摄的OSR脂质体的形状,见图8.由图8可知,OSR的外观成类球形均匀分散,多数为单室脂质体.
2.5.3粒径分布与Zeta电位测定结果
动态光散射仪测定的粒径及粒径分布结果见图9,Zeta电位测定结果见图10.由图9可知,OSR的粒径为154.1 nm,分散系数(PDI)为0.329,说明OSR脂质体粒径分布较为均匀;由图10可知,OSR脂质体的Zeta电位为-29.9 mV,其绝对值≫15 mV,结合DLVO理论可知,制备的OSR脂质体混悬液稳定,不易发生絮凝[8,15].
2.5.4红外光谱表征结果
OSR脂质体的红外测定结果见图11.图11 a线显示,1 670 cm-1处吸收峰为CHO的C=C伸缩振动峰,3 431 cm-1处的吸收峰为CHO的-OH伸缩振动峰,2 934 cm-1为-CH3的伸缩振动峰,1 360~1 470 cm-1为-CH3的不对称伸缩振动.图11b线显示,1 630 cm-1和3 010 cm-1处吸收峰分别为LHP的C=C伸缩振动峰和碳碳双键上氢的伸缩振动峰,1 740 cm-1和1 236 cm-1处吸收峰分别为LHP分子中酯键的C=O和C-O-C伸缩振动峰,3 323 cm-1处的吸收峰为LHP的-OH和-NH的伸缩振动峰,2 925 cm-1、2 853 cm-1和1 466 cm-1依次为-CH2-的不对称伸缩振动、对称伸缩振动和面内弯曲振动峰,1 090 cm-1和722 cm-1分别为醇羟基的C-O伸缩振动峰和O-H面外弯曲振动峰;1 066 cm-1、1 657 cm-1和827 cm-1分别为氨基的C-N伸缩振动峰、N-H面内弯曲振动峰和N-H面外弯曲振动峰,1 378 cm-1为-CH3的面内对称弯曲振动峰,-CH3的面内不对称弯曲振动峰和伸缩振动峰被-CH2-相应位置的峰所掩盖.图11c线是CHO和LHP物理混合物的红外图谱,对比图11a,b,c 3线可知,图11c线是图11a线和b线简单地叠加,明显区别于OSR脂质体的红外图11e线.图11d线显示,1 620 cm-1和1 249 cm-1处吸收峰分别为OSR分子中酰胺键的C=O和C-N伸缩振动峰,1 020 cm-1~1 220 cm-1处吸收峰为OSR分子中的叔胺中C-N伸缩振动峰,1 349 cm-1和1 304 cm-1处吸收峰为OSR分子中叔碳氢的振动吸收峰,其余的吸收峰为OSR的不同化学环境中-CH2-的振动峰.图11e线显示,OSR分子中酰胺键的C=O和C-N伸缩振动峰、叔胺中C-N伸缩振动峰和叔碳氢的振动吸收峰得以保留,红外吸收峰位几乎没有变化,说明OSR进入脂质体囊泡中.此外,图11e线与c线和d线对比,在2 000~3 600 cm-1范围内OSR脂质体的红外吸收峰的位置和峰形发生了明显的变化,进一步说明OSR进入脂质体囊泡中.
2.5.5差示扫描量热分析结果
OSR脂质体的差示扫描量热分析测定结果见图12.图12结果表明,CHO(a线)在151.1 ℃时出现一个熔点峰;LHP是由卵磷脂、脑磷脂、肌醇磷脂、神经鞘磷脂、磷脂酸和其他磷脂组成的复杂混合物,所以LHP的DSC图(b线)出现多个吸热峰;OSR(c线)在96.5 ℃时出现一个熔点峰,在225.5 ℃时出现一个放热峰;对比CHO,LHP和OSR的DSC图可以发现,药物与两者的物理混合物的DSC图(d线)是三者的简单叠加,说明药物与CHO和LHP的物理混合物不能形成脂质体;OSR脂质体(e线)在204.8 ℃附近出现新的放热峰,在228.2 ℃附近出现新的吸热峰,说明形成新物质,不是简单的物料叠加,证明生成了OSR脂质体[8].


3 结 论
采用单因素实验法,剖析OSR脂质体制备过程中辅料用量的影响,采用Box-Behnken响应面设计实验,剖析多个因素对OSR脂质体的共同的影响,优化了OSR脂质体的制备工艺.单因素实验与响应面实验设计相结合,具有预测性好的优点,优于只能分析离散型数据的正交实验设计.单因素实验结合Box-Behnken响应面实验,采用线性模型,求得回归方程,通过合理预测得出最佳工艺条件.OSR的最佳制备工艺为:大豆卵磷脂与胆固醇的质量比为10∶3.09、大豆卵磷脂与药物的质量比为10∶1.54、水合时间为1.46 h.制备的OSR脂质体的外观成类球形,平均粒径为154.1 nm,分散系数为0.329,平均包封率为58.02%(RSD为1.63%),平均载药量为6.27%(RSD为1.52%),Zeta电位为-29.9 mV,采用红外光谱法、差示扫描量热分析等表征法证明了OSR脂质体的形成.采用预测的最佳工艺制备的OSR脂质体,粒径较小,PDI值较低,脂质体分散性好,Zeta电位绝对值较高,不易发生沉淀,说明优化的OSR脂质体制备方法稳定可靠.

