六价铬通过上调SUMO特异性蛋白酶家族分子表达增强雄激素受体的转录活性
2022-03-03颜志文王鹏敏武瑞琴
颜志文,王鹏敏,武瑞琴,陈 方
(1.厦门大学附属第一医院药剂科,福建 厦门 361003;2.中国人民解放军疾病预防控制中心,北京 100071)
铬(chromium,Cr)是一类重要的化工原料,广泛应用于多个领域。工业活动中产生的铬渣是目前世界上最主要的重工业污染源之一[1]。铬的毒性与其存在的价态有关,六价铬毒性最大,比三价铬高约100倍,且易被人体吸收并在体内蓄积[2-4]。六价铬被认为是对人类健康危害最大的6种环境毒物之一,可经呼吸道、消化道或皮肤进入机体,被细胞内一系列还原物质还原为五价、四价和三价,并产生大量活性氧,从而导致一系列有害反应[5-7]。任丽敏[8]调查研究发现,职业接触六价铬使男性精子数量显著减少,精子存活率明显下降。Kumar等[9]研究发现,Wistar雌性大鼠孕期六价铬暴露后,子代雄性大鼠睾丸支持细胞雄激素受体(androgen receptor,AR)和促卵泡素受体mRNA和蛋白表达水平均明显降低,可能导致生殖功能受损。多个研究表明六价铬接触可增加前列腺癌患病风险[10]。雄激素发挥作用依赖其受体AR,而AR是一种转录因子,由配体结合结构域、DNA结合结构域和转录激活结构域3个主要功能结构域组成。正常生理条件下,AR经配体雄激素活化后入核,可与靶基因上游的雄激素反应元件(androgen response element,ARE)结合,调节下游基因转录[11]。目前尚未见六价铬暴露对AR转录活性的影响的相关文献报道,本研究通过离体模型研究六价铬对ARmRNA和蛋白水平及转录活性的影响,并探讨其可能的分子机制,为阐明六价铬的内分泌干扰毒性机制提供新线索。
1 材料与方法
1.1 主要试剂和仪器
K2CrO4,美国 Sigma-Aldrich有限公司;MTT,碧云天生物技术有限公司;pRL-TK、pSG5-AR和pARE2-luc质粒,军事科学院军事医学研究院生物工程研究所周建光研究员馈赠;RPMI 1640细胞培养基、DMEM高糖细胞培养基及胎牛血清,美国Gibco公司;荧光素酶检测系统、小鼠抗兔AR、小泛素类似修饰物(small ubiquitin-like modifier,SUMO)特异性蛋白酶1(SUMO-specific proteases,SENP1)、SENP3及GAPDH单克隆抗体(一抗)和辣根过氧化物酶标记的山羊抗兔IgG抗体(二抗),英国Abcam公司;Trizol,美国 Invitrogen公司;逆转录PCR试剂盒,日本Toyobo公司;Taq DNA聚合酶,日本TaKaRa Bio株式会社;相关基因引物(表1),上海生工生物技术有限公司合成;BCA蛋白定量试剂盒和Super ECL Plus超敏发光液,北京普利莱基因技术有限公司;蛋白分子质量标准,美国Thermo Scientific公司。CO2培养箱(Heracell VIOS 160i),美国赛默飞世尔科技公司;倒置显微镜(CKX53),日本奥林巴斯光学有限公司;荧光分光光度计(F-2500),日本日立高新技术公司;酶标仪(Model 550)、电泳仪、电泳槽、转膜装置及凝胶成像仪,美国Bio-RAD生命医学产品有限公司。

Tab.1 Primer sequences for RT-PCR
1.2 细胞和细胞培养
雄激素依赖型人前列腺癌细胞LNCaP和表达SV40大T抗原的人胚胎肾上皮细胞293T均由中国人民解放军疾病预防控制所提供。在37℃、饱和湿度条件下,LNCaP细胞和293T细胞分别用RPMI 1640培养基和DMEM培养基于含5%CO2的培养箱中培养。培养基含10%胎牛血清、青霉素1×105U·L-1和链霉素100 mg·L-1。根据细胞生长情况传代,取处于对数生长期的细胞用于实验。
1.3 MTT法检测细胞存活率
细胞以5.0×107L-1密度接种于96孔板中,每孔100 μL,适应生长24 h后弃去原培养基,293T细胞分别加入终浓度为0.25,0.5,1.0,2.0,4.0,8.0和16.0 μmol·L-1K2CrO4,LNCaP 细胞分别加入终浓度为 0.25,0.5,1.0,2.0,4.0,10.0 和 20.0 μmol·L-1K2CrO4,同时以 PBS处理作为细胞对照组。K2CrO4处理20 h后每孔加入5 g·L-1MTT 20 μL,置于培养箱中继续培养4 h。孵育结束后吸出培养基,每孔加入150 μL DMSO溶解结晶,微型振荡器上振荡10 min,用酶标仪测定各孔570 nm处吸光度值(A570nm),以空白孔调零。细胞存活率(%)=(实验组A570nm-空白组A570nm)/(细胞对照组A570nm-空白组A570nm)×100%。并采用GraphPad Prism8软件拟合计算半数抑制浓度(50% inhibitin concentration,IC50)值。
1.4 双荧光素酶报告基因系统检测细胞AR转录活性
AR作为转录因子,可与特定的ARE结合发挥转录活性。选择不表达AR的293T细胞,利用荧光素酶报告基因检测分析六价铬对外源性AR转录活性的影响。293T细胞以5.0×107L-1的密度接种于24孔板,每孔1 mL,待细胞生长至60%~70%融合度时,将表达连接有荧光素酶报告基因的ARE的质粒pARE2-luc和表达AR的质粒pSG5-AR瞬时共转染293T细胞,同时转染表达海肾荧光素酶的质粒pRL-TK作为对照。转染6 h后更换培养基,置于培养箱中继续培养24 h后,分别加入终浓度为0.25,0.5,1.0,2.0,4.0,8.0和 16.0 μmol·L-1K2CrO4,同时以PBS处理作为细胞对照组,继续培养24 h后进行荧光素酶报告分析。
选择LNCaP细胞进行荧光素酶报告基因检测,分析六价铬对内源性AR转录活性的影响。LNCaP细胞以5.0×107L-1的密度接种于24孔板,每孔1 mL,待细胞生长至60%~70%融合度时,将质粒pRL-TK和pARE2-luc进行瞬时共转染LNCaP细胞。转染6 h后更换培养基,置于培养箱中继续培养24 h,分别加入终浓度为 0.25,0.5,1.0,2.0,4.0,8.0 和 16.0 μmol·L-1K2CrO4,同时以PBS处理作为细胞对照组,继续培养24 h后进行荧光素酶报告分析。
以上实验中每组均转染了质粒pRL-TK,经此荧光强度确定转染效率,且每组样本pARE2-luc的荧光强度均经pRL-TK荧光强度校正,得出相对荧光强度进行组间统计学分析,以排除转染效率的差异。培养结束后,每孔加入100 μL报告基因细胞裂解液,室温条件下摇动培养板15 min,充分裂解后,12 000×g离心5 min,取上清用于测定。分别取100 μL样本加入白色96孔板中,加入100 μL萤火虫萤光素酶检测试剂或海肾萤光素酶检测试剂,混匀后用酶标仪检测荧光强度值。用萤火虫萤光素酶检测的荧光强度与海肾萤光素酶检测的荧光强度比值为相对荧光强度,以相对荧光强度反映AR的转录活性。
1.5 RT-PCR检测细胞AR和SENP家族相关分子mRNA水平
LNCaP细胞以 5.0×107L-1的密度接种于24孔板,每孔1 mL,适应生长24 h后弃去原培养基,分别加入终浓度为0.5,2.0和8.0 μmol·L-1K2CrO4,同时以PBS处理作为细胞对照组,继续培养24 h。经Trizol提取细胞总RNA,用逆转录试剂盒将总RNA逆转录为cDNA。在完成的逆转录体系中分别 加 入 内 参GAPDH和AR,SENP1,SENP2,SENP3,SENP5,SENP6,SENP7和SENP8基因的上游和下游引物(表1),再加入Taq DNA聚合酶进行 PCR。PCR具体反应条件:AR为95℃变性10 s,56℃退火15 s,72℃延伸 50 s,循环38 次后,72℃保持7 min;GAPDH 为94℃变性30 s,58℃退火 40 s,72℃延伸50 s,循环30次后,72℃保持8 min;SENP1,SENP2,SENP3,SENP5,SENP6,SENP7和SENP8为95℃变性10 s,65℃退火60 s,72℃延伸20 s,循环40次后,72℃保持5 min。PCR产物经1.5%的琼脂糖凝胶电泳(溴化乙锭染色)分离,再经凝胶系统成像。采用Image J软件反转图像后再扫描分析目标基因条带的荧光强度。以目标基因与GAPDH条带荧光强度比值表示目标mRNA相对表达水平。
1.6 Western印迹法检测细胞AR,SENP1和SENP3蛋白表达水平
取1.5分组培养的LNCaP细胞,用含苯甲基磺酰氟的NP-40蛋白裂解液裂解细胞并收集细胞蛋白,用BCA蛋白定量试剂盒测定样品中蛋白质浓度。经8%SDS-PAGE凝胶电泳分离蛋白,用湿转法将蛋白转移到PVDF膜,加入一抗(AR,1∶1000;SENP1,1∶3000;SENP3,1∶3000;GAPDH,1∶5000),4℃ 孵育过夜;洗去一抗,加入相应二抗(1∶5000),于室温孵育2 h后洗去二抗。采用ECL化学发光显色成像,Image J软件扫描分析蛋白条带积分吸光度值。利用目标蛋白与内参蛋白条带积分吸光度比值表示目标蛋白相对表达水平。
1.7 统计学分析
实验结果数据以±s表示,采用SPSS26.0软件进行统计分析。多组间比较采用单因素方差分析(one-way ANOVA),实验组与对照组的两两比较采用Dunnettt检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 六价铬对293T和LNCaP细胞存活率的影响
MTT结果(图1A)显示,与细胞对照组相比,K2CrO4浓度≥1.0 μmol·L-1时,293T细胞存活率显著降低(P<0.01),K2CrO416.0 μmol·L-1组细胞存活率仅为(30.6±2.9)%。K2CrO4处理293T 细胞24 h的 IC50为 6.16 μmol·L-1。
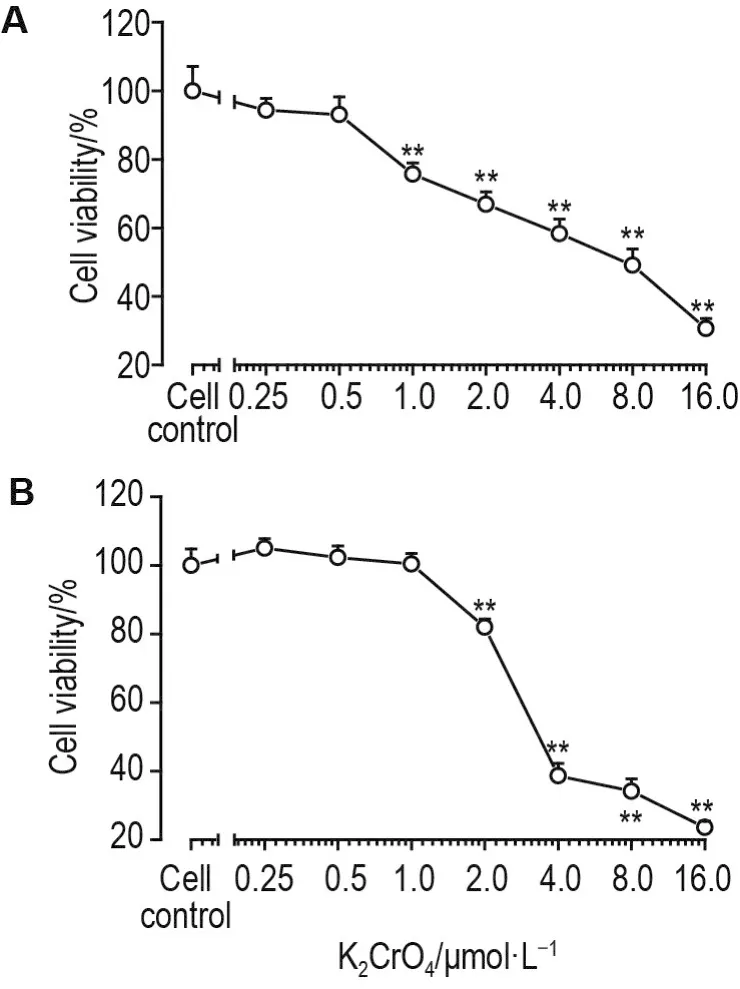
Fig.1 Effect of K2CrO4on cell viability of 293T cells(A)and LNCaP cells(B)by MTT assay.293T cells and LNCaP cells were incubated with K2CrO4for 24 h,respectively.Cell viability(%)=(A570 nmof the sample group-A570 nmof the blank group)/(A570 nmof cell control group-A570 nmof the blank group)×100%.±s,n=6.**P<0.01,compared with cell control group.
与细胞对照组相比,K2CrO4浓度≤1.0 μmol·L-1时对LNCaP细胞存活无明显影响;K2CrO4浓度≥2.0 μmol·L-1时,LNCaP细胞存活率显著降低(P<0.01),K2CrO420.0 μmol·L-1组细胞存活率仅为(23.6±1.8)%(图1B)。K2CrO4处理LNCaP细胞24 h的IC50值为5.01 μmol·L-1。
2.2 六价铬对293T和LNCaP细胞中AR转录活性的影响
荧光素酶报告基因检测显示,与细胞对照组相比,K2CrO4浓度≥1.0 μmol·L-1时293T细胞中外源性 AR 转录活性显著增强(P<0.05,P<0.01;图2A)。与细胞对照组相比,K2CrO44.0 和 8.0 μmol·L-1组LNCaP细胞中内源性AR转录活性明显增强(P<0.05,P<0.01;图2B),而K2CrO416.0 μmol·L-1组有增强趋势,但未达到统计学差异;与K2CrO48.0μmol·L-1组相比,K2CrO416.0 μmol·L-1组内源性 AR 转录活性显著降低(图2B)。
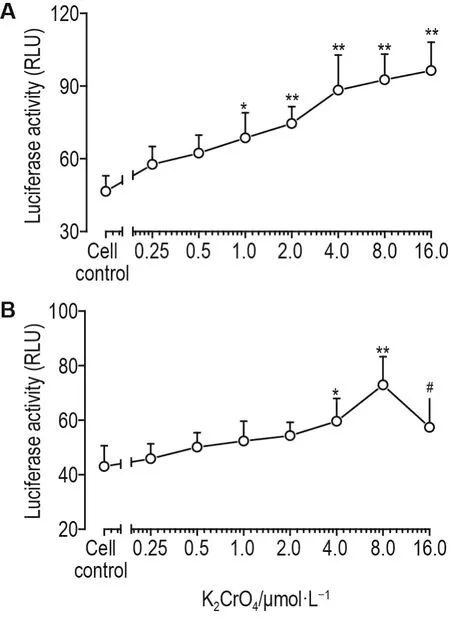
Fig.2 Effect of K2CrO4on transcriptional activity of AR in 293T cells(A)and LNCaP cells(B).293T cells were co-transfected with AR and androgen response element(ARE)-luc reporter plasmids followed by incubation with K2CrO4for 24 h,and the transcriptional activity of the exogenous AR was analyzed by the dual-luciferase reporter assay system.LNCaP cells were transfected with ARE-luc reporter plasmids followed by incubation with K2CrO4for 24 h,and the transcriptional activity of the endogenous AR was analyzed by the dual-luciferase reporter assay system.±s,n=4.*P<0.05,**P<0.01;compared with cell control group,#P<0.05,compared with K2CrO48.0 μmol·L-1group.
2.3 六价铬对LNCaP细胞内源性AR mRNA和蛋白表达水平的影响
RT-PCR和Western印迹结果显示,K2CrO40.5,2.0和8.0 μmol·L-1处理对LNCaP细胞内源性ARmRNA和蛋白表达水平均无影响(图3A和B)。
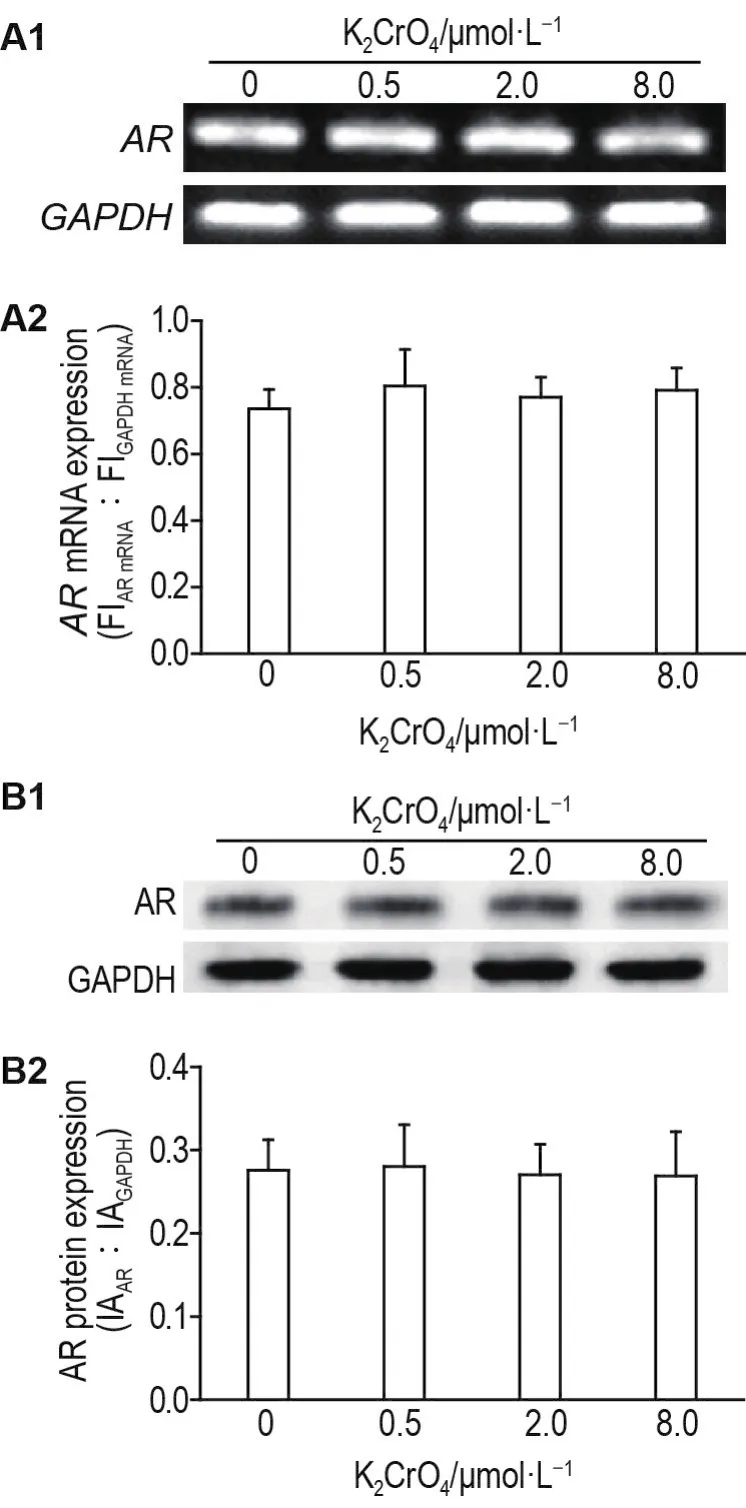
Fig.3 Effect of K2CrO4on mRNA(A)and protein(B)levels of AR in LNCaP cells.A2 was the semi-quantitative result of A1 that was inverted in Image-J software.B2 was the semi-quantitative result of B1.FI:fluorescence intensity.
2.4 六价铬对LNCaP细胞SENP家族相关分子mRNA水平的影响
RT-PCR结果(图4)显示,与细胞对照组相比,K2CrO42.0 和 8.0 μmol·L-1显著增加 LNCaP 细胞SENP1mRNA 水 平(P<0.05,P<0.01);K2CrO40.5,2.0和8.0 μmol·L-1显著增加SENP3mRNA 水平(P<0.05,P<0.01)。K2CrO4处理均不改变LNCaP细胞中SENP2,SENP5,SENP6,SENP7和SENP8mRNA水平。

Fig.4 Effect of K2CrO4on mRNA levels of SUMO-specific proteases(SENP)in LNCaP cells.See Fig.3 for the cell treatment.B1 and B2 were the semi-quantitative results of A that was inverted in Image-J software.±s,n=4.*P<0.05,**P<0.01,compared with cell control group.
2.5 六价铬对LNCaP细胞SENP1和SENP3蛋白水平的影响
与细胞对照组相比,K2CrO48.0 μmol·L-1显著增加LNCaP细胞SENP1蛋白表达水平(P<0.01,图5A);K2CrO42.0和8.0 μmol·L-1明显增加SENP3蛋白表达水平(P<0.05,图5B)。

Fig.5 Effects of K2CrO4on protein levels of SENP1(A)and SENP3(B)in LNCaP cells.See Fig.3 for the cell treatment.A2 and B2 were the semi-quantitative results of A1 and B1,respectively.±s,n=4.*P<0.05,**P<0.01,compared with cell control group.
3 讨论
本研究首先检测了K2CrO4对293T细胞和LNCaP细胞存活率的影响,发现 K2CrO4浓度≥1.0 μmol·L-1时293T细胞存活率显著下降。在LNCaP细胞中观察到较低浓度 K2CrO4(0.25,0.5 和 1.0 μmol·L-1)不抑制细胞存活。当 K2CrO4浓度≥2.0 μmol·L-1时,LNCaP细胞存活率显著下降。李时恩等[12]报道,重六价铬酸钾(K2Cr2O7)在0~0.312 μmol·L-1范围内促进人胚肺细胞A549细胞增殖,浓度≥0.625 μmol·L-1时显著降低细胞存活率。这些不同细胞类型的体外研究提示,高浓度六价铬对细胞产生毒性作用,且随六价铬浓度增加其细胞毒性作用增大。
为研究六价铬是否干扰外源性和内源性AR的转录活性,本研究构建了连接荧光素酶报告基因且表达ARE的质粒和表达AR的质粒,并将这些质粒共转染入内源性不表达AR的293T细胞中,同时将连接荧光素酶报告基因且表达ARE的质粒转染入内源性表达AR的LNCaP细胞中,进一步在LNCaP细胞中探究六价铬是否影响AR本身的转录和翻译。由于不确定K2CrO4抑制细胞存活的浓度范围与影响AR转录活性的浓度范围是否一致,在研究六价铬对AR转录活性的影响中选择了不抑制细胞存活的K2CrO4浓度和显著抑制细胞存活的K2CrO4浓度。同时基于影响LNCaP细胞AR转录活性的K2CrO4浓度范围,研究六价铬对AR mRNA和蛋白水平的影响时,K2CrO4浓度选择 0.5,2.0和8.0 μmol·L-1。实验结果显示,六价铬增强外源性和内源性AR的转录活性但不改变内源性AR mRNA和蛋白水平。因此推测,六价铬对AR转录活性的调节可能是通过蛋白翻译后修饰实现的。
AR作为一种具有很多修饰位点的核转录因子,其转录活性可被多种修饰机制调节,而类泛素化修饰在调节AR的转录活性中发挥重要作用[13-15]。类泛素化修饰中研究最为广泛的SUMO化修饰由SUMO特异性E1,E2和E3酶催化进行,其中SUMO特异性E1酶是主要的SUMO化修饰酶,AR经SUMO化修饰后其转录活性下降[16-17]。而去SUMO化则主要由SENP完成[18]。哺乳动物体内有 7种 SENP 即 SENP1,SENP2,SENP3,SENP5,SENP6,SENP7和SENP8,SENP定位不同,功能也略有差异,并具有不同的底物特异性[19-20]。SENP1主要位于核仁以外的细胞核内,SENP2主要位于核孔复合物,SENP3和SENP5主要位于核仁,SENP6和SENP7主要位于核质。近年来研究报道,SENP8不作用于SUMO化蛋白,而作用于另一种类泛素蛋白NEDD8。很多证据显示,SENP1/2可切断AR与SUMO之间的连接,在AR的去SUMO化过程中发挥主要作用,而AR去SUMO化后转录活性明显增强[21-22]。本研究结果显示,六价铬增强AR的转录活性且不影响AR本身表达水平,增加SENP1和SENP3 mRNA及蛋白水平。因此推测,六价铬通过上调SENP1和SENP3、降低AR的SUMO化修饰水平而增强AR的转录活性,继而导致内分泌干扰毒性,影响影响前列腺癌细胞增殖。
综上所述,六价铬可能通过上调SENP1和SENP3表达继而增强AR的转录活性,最终影响其下游靶基因表达。本研究为探索六价铬造成内分泌干扰毒性的分子机制提供新思路。
