基于RNA-Seq数据分析葡萄糖诱导绵羊卵泡颗粒细胞衰老的差异表达基因
2022-03-03张配颖宋鹏琰陈晓勇周荣艳
张配颖,宋鹏琰,周 营,陈晓勇,周荣艳
(河北农业大学动物科技学院,保定 071001)
卵巢是雌性动物的主要生殖器官,卵巢卵泡颗粒细胞在维持生殖功能上起着极其重要的作用。从原始卵泡发育到卵泡成熟排卵后黄体的形成,颗粒细胞作为主要的功能细胞,其增殖与分化直接影响着卵泡的生长发育、排卵、黄体形成以及甾体激素分泌等卵巢功能活动[1]。目前,对卵泡颗粒细胞功能调控机制的研究主要采用体外细胞培养的方法,但长期体外培养会造成细胞形态的改变和基因的差异表达[2]。因此,颗粒细胞体外培养对于探索卵巢功能活动具有重要意义。
细胞体外培养时的分化与增殖异常、细胞周期改变诱导的衰老、DNA片段化引起的凋亡等均受到多种因素影响,如氨基酸组成[3]、血清含量[4]、葡萄糖浓度[5]等,其中葡萄糖是机体最主要的能量物质,在新陈代谢中发挥着重要的作用。葡萄糖水平的失衡会引发相关的应激,进而可导致细胞衰老[6]。在高糖环境下,细胞内产生大量活性氧(reactive oxygen species,ROS),ROS可加速端粒缩短、引起DNA损伤并导致衰老相关的细胞生长停滞[7-8]。在成纤维细胞[9]、内皮细胞[10]、间充质干细胞[11]等上的研究已证实高浓度葡萄糖可诱导细胞衰老。目前,关于体外培养绵羊卵泡颗粒细胞的研究主要集中在细胞凋亡和激素分泌方面[3,12],细胞培养条件对结果有直接影响。本课题组前期研究发现,采用DMEM/F12培养基(葡萄糖浓度为17.5 mmol/L)体外培养的绵羊卵泡颗粒细胞周期及衰老相关分泌表型相关基因(如细胞周期素D1(Cyclin D1,CCND1)、基质金属蛋白酶9(matrix metallopeptidase 9,MMP9))等均发生了改变(未发表),推测培养基中高浓度葡萄糖对细胞周期产生了影响。 目前,普遍使用DMEM/F12培养基培养绵羊卵泡颗粒细胞,而绵羊体内血糖生理浓度为1.5~4 mmol/L[13],关于培养基中葡萄糖浓度对细胞影响的研究鲜见报道。本课题组前期研究发现,高浓度葡萄糖可影响细胞周期/衰老相关基因的表达,诱导细胞衰老并抑制颗粒细胞的增殖(未发表)。因此,为了明确葡萄糖诱导绵羊卵泡颗粒细胞衰老的机制,本试验通过RNA测序(RNA-Seq)技术,对2个葡萄糖浓度培养基培养的绵羊卵泡颗粒细胞进行转录组测序分析,选取细胞衰老关键基因锚定蛋白重复域蛋白1(ankyrin repeat domain-containing protein 1,ANKRD1)[14]、细胞衰老相关分泌表型蛋白白细胞介素8(interleukin-8,IL-8)[15]、具有缓解细胞衰老功能的催产素(oxytocin,OXT)[16]、晚期糖基化产物(AGE)-晚期糖基化终末产物受体(RAGE)信号通路中烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(NADPH oxidase 4,NOX4)[17]等4个差异表达基因用实时荧光定量PCR进行验证,旨在筛选差异表达基因和信号通路,以期为细胞衰老相关功能基因的筛选提供参考。
1 材料与方法
1.1 主要试剂
DMEM/F12无糖培养基(PM150323)、D-葡萄糖溶液(PB180418)均购自武汉普诺赛生命科技有限公司;胎牛血清(FBS)、胰酶(12604013)均购自Gibco公司;细胞衰老β-半乳糖苷酶染色试剂盒(C0602)购自上海碧云天生物技术有限公司;Forget-Me-Not EvaGreen qPCR Master Mix购自BIOTIUM公司。
1.2 颗粒细胞的分离培养
绵羊卵巢采自保定振宏食品加工有限公司。将采集的卵巢用75%酒精消毒后,用预热生理盐水清洗,剪去多余脂肪及系膜。选择直径为3~7 mm的卵泡将全部卵泡液吸至离心管中,吹打后静置5 min,取上清液,1 500 r/min离心10 min,弃上清,分别用含17.5(H组)和2 mmol/L(L组)葡萄糖的培养基(DMEM/F12无糖培养基+10% FBS+1%双抗+50 μg/mL丙酮酸钠)吹打混匀后接种于细胞培养瓶中,37 ℃、5% CO2培养箱内培养。
1.3 β-半乳糖苷酶染色
将L和H组颗粒细胞以5×104/孔的密度接种于12孔板,每组设置3个重复。孵育72 h后分别进行β-半乳糖苷酶染色。加入1 mL β-半乳糖苷酶染色固定液,室温固定15 min后加入染色液。37 ℃孵育过夜,细胞蓝染表示衰老细胞,在普通光学显微镜下观察并计算蓝染细胞阳性率。
细胞阳性率(%)=蓝染细胞数/全部细胞数×100%
1.4 转录组测序分析
将细胞收集于无菌EP管中,低温保存运输,由组学生物(北京)有限公司进行样品检测、文库构建及其质量控制和上机测序。用NanoDrop微量分光光度计检测RNA的纯度、浓度、核酸吸收峰,用Agilent 2100生物分析仪精确检测RNA的完整性。样品检测合格后,进行mRNA富集,然后以mRNA为模板,合成双链cDNA,双链cDNA再进行末端修复、加A尾并连接测序接头,再用AMPure XP beads进行片段大小选择,最后进行PCR富集得到最终的cDNA文库。文库构建完成后,对文库质量进行检测,检测结果达到要求后进行上机测序。对测序得到的原始序列进行过滤,去除含有接头的序列和低质量的序列,得到高质量的纯净序列用于后续分析。
1.5 差异表达基因分析
对不同处理组进行重复相关性评估,用DESeq进行样品组间的差异表达分析。在差异表达基因检测过程中,将差异倍数|FoldChange|≥1.5且错误发现率(false discovery rate,FDR)<0.01作为筛选标准。通过KOBAS(2.0)从生物过程(biological process,BP)、分子功能(molecular function,MF)及细胞成分(cellular component,CC)等方面进行差异表达基因的GO功能富集分析,通过KOBAS(2.0)对差异表达基因进行KEGG信号通路富集分析,P<0.05被认为是显著富集。
1.6 实时荧光定量PCR验证
将L和H组颗粒细胞以2×105/孔的密度接种于6孔板中,每组设置3个重复。孵育72 h后用Trizol法提取细胞总RNA并反转录合成cDNA。根据GenBank中ANKRD1、IL-8、OXT、NOX4基因序列用Primer-Blast设计特异性扩增引物,引物具体信息见表1。引物均由广州锐博生物科技有限公司合成。以绵羊GAPDH基因为内参,进行实时荧光定量PCR反应。PCR反应体系20 μL:Forget-Me-Not EvaGreen qPCR Master Mix 10 μL,ROX 3 μL,上、下游引物(10 μmol/L)各0.4 μL,cDNA 2 μL,ddH2O 4.2 μL。PCR反应条件:95 ℃预变性2 min;95 ℃变性5 s,60 ℃退火30 s,共40个循环。每个样品3次重复,检测结果用2-△△Ct法进行统计分析。

表1 引物信息
1.7 数据统计与分析
用SPSS 22.0统计软件的独立样本t检验进行组间差异比较,用GraphPad Prism 8.0软件进行作图,结果用平均值±标准差表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 葡萄糖对颗粒细胞衰老的影响
孵育72 h后,β-半乳糖苷酶染色结果表明,H组细胞的体积变大,细胞呈现大量阳性蓝染;细胞阳性率统计结果表明,H组细胞阳性率极显著高于L组(P<0.01)(图1)。
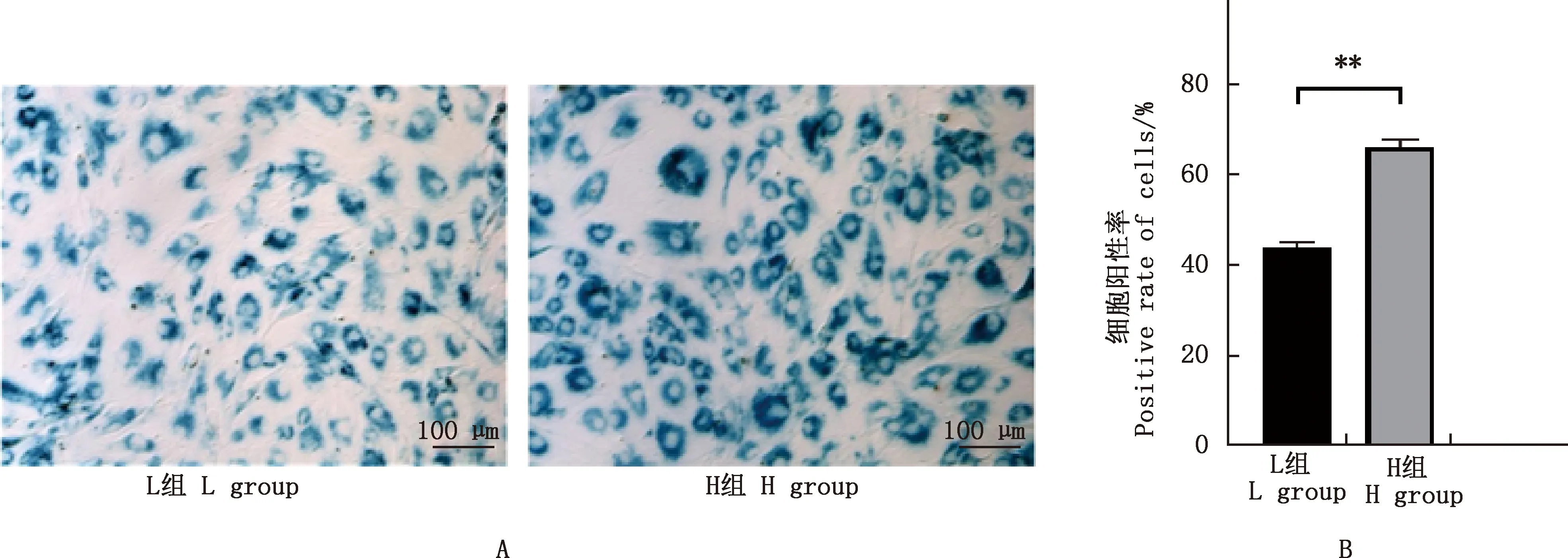
①A,β-半乳糖苷酶染色结果(100×);B,细胞阳性率。②*,差异显著(P<0.05);**,差异极显著(P<0.01);无标记,差异不显著(P>0.05)。图5同
2.2 差异表达基因转录组测序分析
转录组测序结果表明,不同浓度葡萄糖处理细胞72 h后,差异表达基因共401个,其中上调基因有153个,下调基因有248个(图2)。与细胞周期相关的基因有2个(SENP5、GNAI1基因)表达上调, 4个(ARL2、RGS2、 ENSOARG00000001444、ENSOARG00000014182基因)表达下调;与高糖诱导的细胞异常相关基因有9个,其中上调基因有6个(NOX4、PIK3CB、TGFB2、EDN1、IL-8、F3基因),下调基因有3个(COL4A2、HRAS、SELE基因)(表2)。
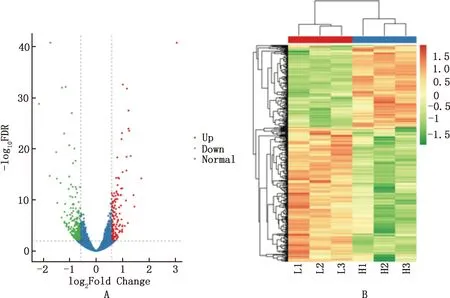
图2 差异表达基因火山图(A)和聚类热图(B)
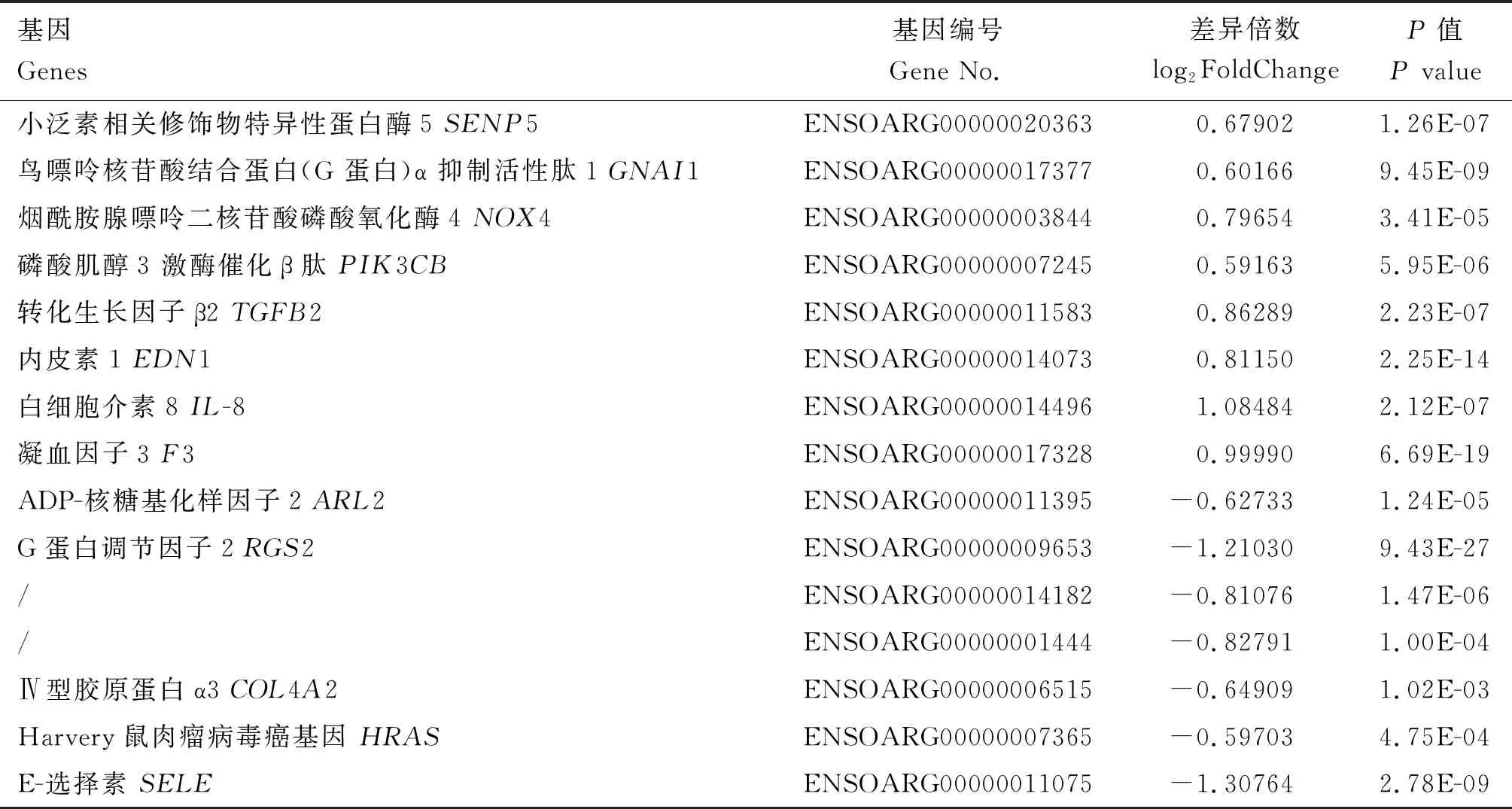
表2 与高糖诱导细胞异常和细胞周期相关的差异表达基因
2.3 差异表达基因GO功能富集分析
对处理后绵羊卵泡颗粒细胞的差异表达基因进行GO功能富集分析发现,差异表达基因富集在生物过程、分子功能和细胞成分三大类,其中生物过程占单基因注释的大多数。生物过程中差异表达基因主要富集在细胞过程、生物调节、代谢过程、繁殖、多细胞生物过程、细胞运动、细胞组成、组织和生物发生等;细胞成分中差异表达基因主要富集在胞外区、膜、突触、细胞器及超分子复合体等;分子功能中差异表达基因主要富集在催化活性、整合、转运活性、分子功能调节剂、结构分子活性及分子传感器活性等(图3)。
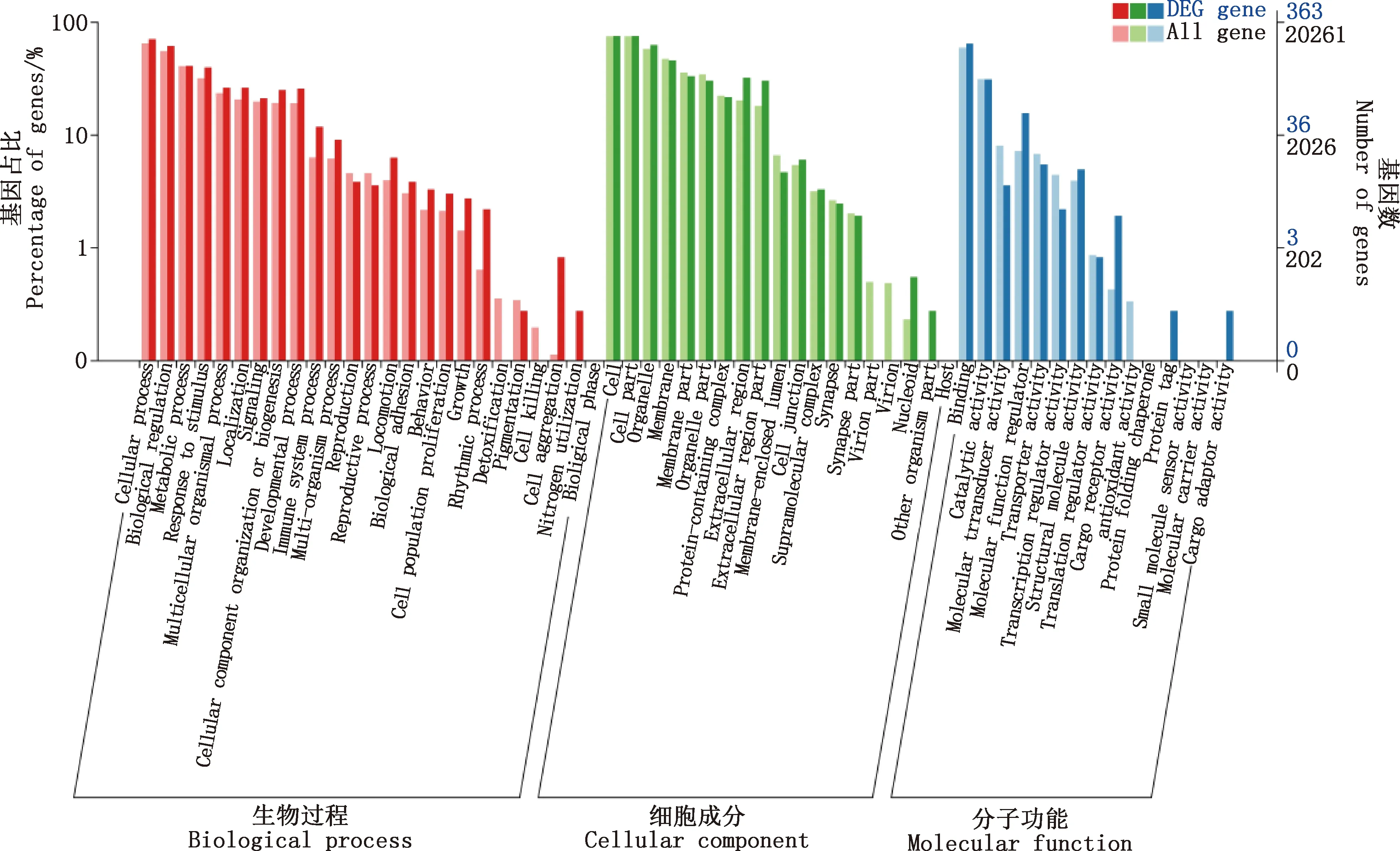
图3 差异表达基因的GO功能富集注释
2.4 差异表达基因KEGG通路富集分析
KEGG通路富集分析结果表明,共有901个差异基因富集在245个信号通路中,主要的信号通路有AGE-RAGE信号通路、胰岛素信号通路、肿瘤坏死因子(TNF)信号通路、过氧化物酶体增殖物激活受体(PPAR)信号通路、雌激素信号通路等(图4),其中AEG-RAGE信号通路与糖尿病并发症相关。
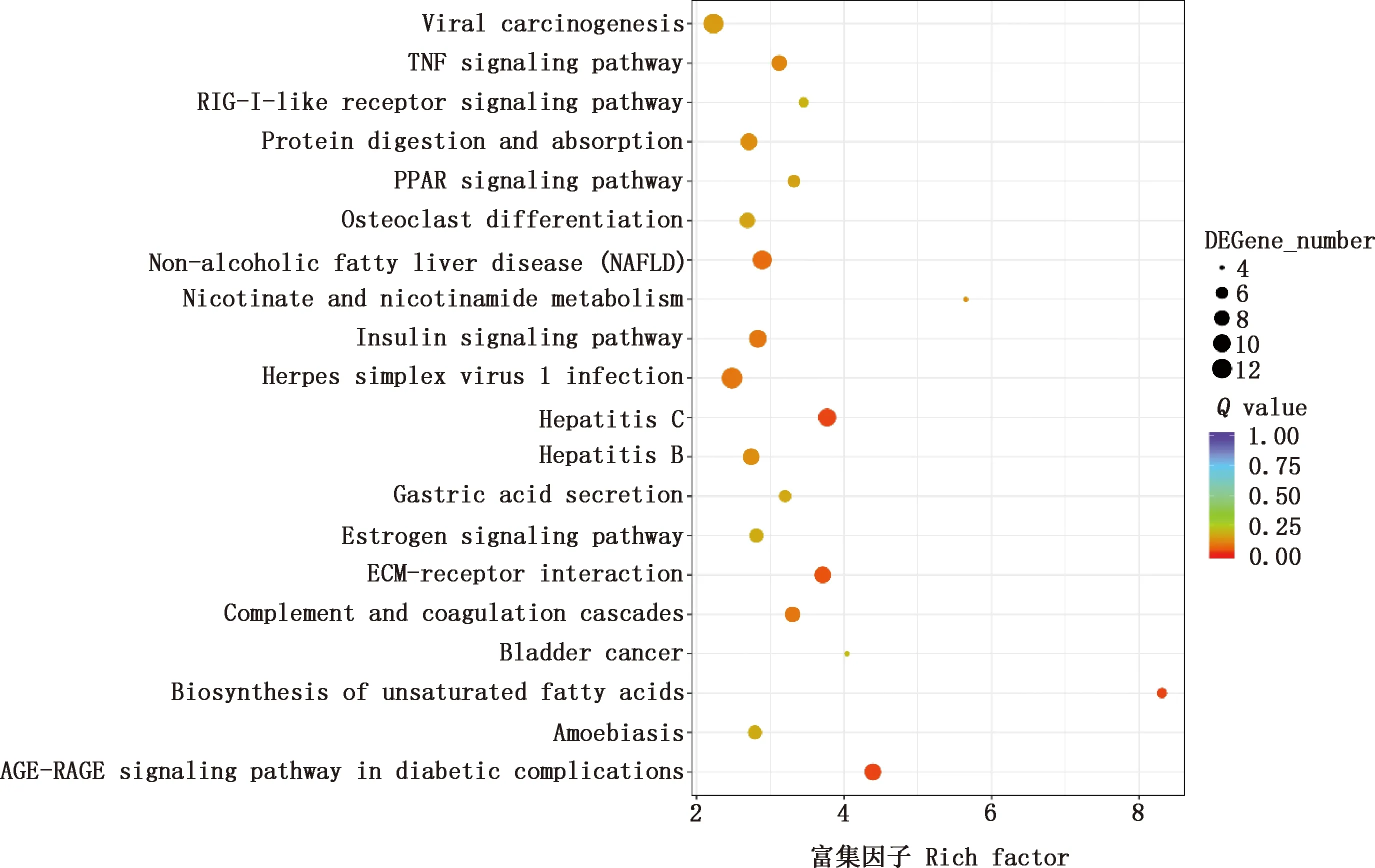
图4 差异基因的KEGG信号通路富集注释(前20)
2.5 差异表达基因实时荧光定量PCR验证结果
实时荧光定量PCR检测结果表明,与L组相比,H组IL-8基因表达水平极显著上调(P<0.01),ANKRD1基因表达水平显著上调(P<0.05),OXT基因表达水平极显著下调(P<0.01),NOX4基因表达量呈上升趋势,但差异不显著(P>0.05)(图5)。实时荧光定量PCR结果与转录组测序结果一致。
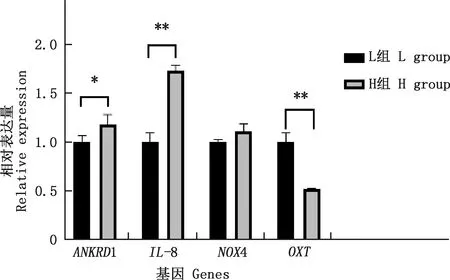
图5 实时荧光定量PCR验证RNA-Seq结果
3 讨 论
高浓度葡萄糖可诱导细胞衰老,细胞衰老主要表现为细胞代谢、分泌细胞因子、表观遗传调控和蛋白表达的改变[18],同时会出现衰老相关β-半乳糖苷酶活性增强以及衰老相关染色质聚集等[19]。本研究结果显示,高糖组细胞β-半乳糖苷酶染色阳性率显著上升,李炳旻等[20]和Sonia等[21]研究表明高糖会诱导皮肤成纤维细胞和内皮细胞衰老。以上研究说明高浓度葡萄糖可促进颗粒细胞、皮肤成纤维细胞和内皮细胞等体细胞衰老。
AEGs是治疗糖尿病的重要物质,其可通过促进活性氧生成和氧化应激,影响细胞的衰老[22],其中AEG-RAGE信号通路是AEGs发挥主要作用的关键通路[23]。糖基化终产物是AGEs结合受体,RAGE信号途径可激活磷脂酰肌醇3-激酶(PI3K)-丝氨酸/苏氨酸激酶(Akt)信号通路,PI3K-Akt信号通路也是胰岛素信号通路中的重要信号通路,胰岛素与其受体结合导致胰岛素受体底物(IRS)通过胰岛素受体酪氨酸激酶(INSR)的酪氨酸磷酸化,IRS与PI3K的调节亚基相关联激活PI3K-Akt信号通路,胰岛素样生长因子-1(IGF-1)可经PI3K-Akt信号通路来促进大鼠软骨细胞衰老[24]。TNF家族的2个成员是TNF-α和TNF-β,TNF-α通过PI3K-Akt信号通路促进细胞的衰老[25]。PPAR是核激素受体超家族的配体激活的转录因子,包括PPARα、PPARγ和PPARβ/δ 3种亚型,在PPAR信号通路中起着核心调控作用,且均参与细胞衰老的调控[26-29],PPAR的激活可能对细胞衰老有预防作用[30]。PPARδ可通过PI3K-Akt信号通路协调血管紧张素Ⅱ诱导血管平滑肌细胞衰老[29]。PI3K-Akt信号通路与细胞衰老的调控密切相关[31]。本试验通过对葡萄糖诱导绵羊卵泡颗粒细胞衰老过程中的差异表达基因进行KEGG通路富集分析发现,差异表达基因主要富集的通路为糖尿病并发症中的AEG-RAGE信号通路、胰岛素信号通路、TNF信号通路、PPAR信号通路等,表明高浓度葡萄糖可能通过不同途径激活PI3K-Akt信号通路来调控颗粒细胞的衰老。
ANKRD1已被证实与老年供体骨髓中骨髓间充质干细胞的体内衰老有关[14]。IL-8是趋化因子家族(CXC)的一种细胞因子,作为衰老细胞过度表达的趋化因子和衰老相关分泌表型的组成部分[15],调控细胞周期进程与细胞增殖等过程[32-33]。本研究中共有401个差异表达基因,这些基因主要参与细胞过程、代谢过程、细胞组成或生物发生等生物过程,差异表达基因中ANKRD1、IL-8基因表达水平显著升高,OXT基因表达水平显著降低,实时荧光定量PCR结果与转录组测序结果基本一致。H组显著上调ANKRD1和IL-8基因的表达水平,表明高浓度葡萄糖可能通过ANKRD1和IL-8基因调控颗粒细胞的衰老。OXT与血糖稳态密切相关,具有降糖作用[34-35],且能够调节细胞增殖和细胞周期进程[36-37]。H组OXT基因表达水平显著降低,推测高浓度葡萄糖通过下调OXT基因的表达引起细胞周期阻滞诱导细胞的衰老。
综上所述,葡萄糖通过ANKRD1、IL-8和OXT等基因相关信号通路调控绵羊卵泡颗粒细胞的衰老,本研究为深入研究葡萄糖对绵羊卵泡颗粒细胞衰老的分子机制提供了参考。
4 结 论
17.5 mmol/L葡萄糖可诱导绵羊卵泡颗粒细胞的衰老,用2和17.5 mmol/L葡萄糖处理细胞后,共有401个差异表达基因,这些基因主要参与细胞过程、代谢过程、细胞组成或生物发生等生物过程,主要富集在糖尿病并发症中的AEG-RAGE信号通路、TNF信号通路和PPAR信号通路等。
