解冻稀释液中添加精浆对冻融猪精子品质的影响
2022-03-03王轶男孔令敏徐海峰张正文李春宇吕艳秋
王轶男,孔令敏,徐海峰,张正文,李春宇,尹 伊,金 一,吕艳秋
(1.延边大学农学院,延吉 133002;2.长春市第一中等职业学校,长春 130000;3.长春市经开区兴隆山镇政府,长春 130000)
热休克蛋白A8(heat shock protein A8,HSPA8),也称为热休克70 ku蛋白8,是Hsp70蛋白家族的组成成员,也是高度保守的伴侣蛋白[4]。HSPA8具有促凋亡和抗凋亡的特性,对细胞活力起保护作用,在细胞外的空间中也能够检测到[5]。研究表明,从输卵管上皮的顶部质膜(APM)制剂中获得的可溶性蛋白成分能够增强哺乳动物精子的存活率,而可溶性蛋白部分的存活增强特性似乎在很大程度上取决于HSPA8,在输精过程中由输卵管上皮细胞产生HSPA8[6],可提高公猪[7]、公羊[8]和公牛[7]精子的存活率。此外,HSPA8对提高精子活力、精子膜流动性、精子与输卵管细胞结合能力和体外单精子受精率有直接作用[9]。 Elliott等[7]研究发现,0.5 μg/mL HSPA8对精子活力的积极影响最大,可显著提高猪精子活力和卵母细胞囊胚率[8-9],所以本试验在冷冻基础液中选用0.5 μg/mL HSPA8进行研究。
精浆(seminal plasma,SP)是一种在睾丸、附睾和附属性腺中分泌的液体混合物,包含多种调节精子功能的因素。据报道,用自体(同种)SP补充冻融的公羊精子可以改善精子的特性,包括运动性、活力和穿透宫颈黏液的能力,以及宫腔内人工授精后的生育能力[10]。一方面,在生殖生理过程中,精子在短时间内与精浆发生相互作用,精子和未稀释的精浆之间的接触时间延长会导致精子快速死亡,相反,附睾精子可以在附睾液中保存几天并保持其受精能力[11];另一方面,在物种之间一定浓度的精浆通常有利于液态或冷冻状态下精液的保存[11]。 Rodriguez-Martinez等[12]研究发现,解冻后添加精浆可改善膜和顶体的完整性,并增强体内受精成功率,且与改良的冷冻解冻保护剂联合使用可获得良好的育种效果。本试验通过在冷冻前添加HSPA8和解冻后添加精浆,研究其对猪精子品质的影响,以期为改善猪精子冻融损伤原理和优质猪精液的保存提供一定的理论参考。
1 材料与方法
1.1 主要试剂
线粒体膜电位检测试剂盒(JC-1)和考马斯亮蓝均购自碧云天生物技术有限公司;PVDF膜(0.22 mm)购自华美生物工程有限公司;精子顶体形态花生凝集素荧光标记(PNA-FITC)购自上海杰美基因医药科技有限公司;HSPA8购自上海联迈生物科技有限公司;其余药品如无特殊说明均购自Sigma公司。
1.2 精液采集
猪精液均采自延吉市政兴种猪场,选用5头成年健康的长白猪,使用手握法采集猪精液,检测精子活力≥85%时可用于本试验。
1.3 精液冷冻前、冷冻及解冻处理
1.3.1 冷冻基础液的配制 对照组(无HSPA8)冷冻基础Ⅰ液:葡萄糖0.750 g,柠檬酸钠0.690 g,Tris 0.565 g,NaHCO30.100 g,EDTA 0.235 g,青霉素钠0.060 g,硫酸链霉素0.500 g,卵黄20 mL,最后定容至100 mL;对照组(无HSPA8)冷冻基础Ⅱ液:冷冻基础Ⅰ液和6%甘油;处理组(有HSPA8)冷冻基础Ⅰ液:HSPA8 500 μg,葡萄糖0.750 g,柠檬酸钠0.690 g,Tris 0.565 g,NaHCO30.100 g,EDTA 0.235 g,青霉素钠0.060 g,硫酸链霉素0.500 g,卵黄20 mL,最后定容至1 000 mL;处理组(有HSPA8)冷冻基础Ⅱ液:冷冻基础Ⅰ液和6%甘油。
1.3.2 冷冻前处理 采集到合格精液后立即用BTS稀释,并放入25 ℃恒温箱平衡1 h,随后用4层纱布包裹后放入17 ℃恒温箱平衡2 h,每间隔30 min轻微上下晃动数次避免精子进入假死状态;2 h后分装到离心管中,17 ℃、2 400 r/min离心10 min,弃上清液;分别用预冷为17 ℃的冷冻基础Ⅰ液进行重悬,重悬后将其放入4 ℃恒温箱中平衡3 h;沿着杯壁加入等体积的冷冻基础Ⅱ液,最终将精子甘油浓度调为3%,精子密度为5×108/mL,对精液样品进行冷冻分装。
1.3.3 冷冻处理 在4 ℃条件下缓慢灌装精液于0.25 mL冷冻麦管中,用不同颜色的聚乙烯醇粉末迅速封口并做好颜色记录,随后小心放入盛有液氮的冷冻盒中,置于液氮液面上方3~5 cm处熏蒸10 min,随后投入液氮罐内。
借鉴游客感知价值测量相关研究,依据“Means-End”理论,参考我国《中华人民共和国旅游行业规范——旅游景区游客中心设置与服务规范》(LB/T011-2011)对于游客中心相关建设标准、临安大峡谷村游客中心现状,设计游客中心属性层与结果层题项;参考KAHLE[23]的LOV价值观列表,制定使用游客中心可能满足的游客最终目的题项,量表指标来源如表1所示。设计访谈问卷如表2所示。
1.3.4 解冻处理 解冻时迅速取出冷冻麦管置于60 ℃水浴锅中解冻8 s。解冻后取出并剪断细管两端,将精液样品倒入1.5 mL离心管中,各处理组均添加等量的提前预热到37 ℃的对应精浆浓度(0、10%、30%、50%)的解冻稀释液,37 ℃恒温箱中孵育15 min。孵育后以600 r/min离心5 min,弃上清液,按之前的原则添加预热好的解冻稀释液,重复2次。
1.4 精子基本质量评估
运动能力评估:解冻并孵育15 min后,取2 μL精液置于37 ℃的精子计数池中,在显微镜(200×)下,通过精子分析仪分析精子直线速度(VSL)、曲线速度(VCL)、前向性运动(STR)、直线性运动(LIN)、平均路径速度(VAP)和运动的摆动性(WOB)。
质膜完整性评估:取50 μL精液与1 mL低渗溶液混匀,37 ℃孵育30 min后,在显微镜(200×)下观察200个精子(卷尾即质膜完整的精子),统计质膜完整率。
顶体完整性评估:按照精子顶体形态花生凝集素荧光标记(PNA-FITC)试剂盒说明进行试验,在荧光显微镜下观察精子顶体状态,置于流式细胞仪(BDC6 Plus)上进行计数。
细胞凋亡评估:将H33342染色液与37 ℃预热的精子混匀后,37 ℃水浴锅中避光孵育20 min;加入PI染色工作液混匀后,37 ℃水浴锅中孵育10 min,在荧光显微镜下观察并计数染色的精子样本。
线粒体膜电位评估:按照线粒体膜电位检测试剂盒说明进行试验,在荧光显微镜下观察并计数染色的精子样本。判断依据:高线粒体膜电位(ΔΨm)的精子具有黄色或者橙色荧光;较低线粒体膜电位(ΔΨm)的精子具有绿色荧光。
DNA完整性(CMA3)评估:按照Chromomycin A3检测试剂盒说明进行试验,在荧光显微镜下观察染色后的精子。判断依据:精子头部发出亮绿色荧光表示CMA3阳性(染色质结构异常);精子头部发出暗绿色荧光表示CMA3阴性(染色质结构正常)。
1.5 冷冻前添加HSPA8和解冻后添加精浆对猪精子获能状态的影响
1.5.1 提取精子蛋白 获能后的精液800 r/min离心6 min,弃上清,将RIPA(强)裂解液和蛋白酶抑制剂PSMF按照4∶1比例混匀加入,振荡器振荡3 min使精子细胞充分裂解,置于摇床上4 ℃摇动40 min,4 ℃、12 000 r/min离心10 min,用移液枪吸取上清液即为精子蛋白。
1.5.2 精子蛋白浓度测定 按照BCA蛋白浓度测定说明书,加入0、1、2、4、8、12、16、20 μL标准品到96孔板中,加标准样品稀释液PBS补足20 μL,相当于标准品浓度分别为0、0.025、0.05、0.1、0.2、0.3、0.4、0.5 mg/mL;加适当体积精子蛋白样品到96孔板中,样品不足时,使用标准样品稀释液PBS补足20 μL;在各孔中加入200 μL的BCA工作液,使用移液枪反复吸取使其充分混匀,37 ℃恒温箱中放置30 min;用酶标仪测定540 nm处的吸光度,制定标准蛋白曲线,计算各组精子蛋白最终浓度。
1.5.3 SDS-PAGE免疫印迹 将蛋白溶液和上样缓冲液置于95 ℃以上水浴锅中煮沸5 min;将20 μL预混好的蛋白样品加入胶孔中,80 V 30 min后转换100 V跑至距底边约1.5 cm处停止;将多余胶切掉,按照胶的大小剪裁PVDF膜,使用半干转膜的方式将胶上的蛋白转到PVDF膜上,按照由下到上的顺序放置(滤纸-PVDF膜-胶-滤纸),对应正负极,电压调至25 V,转膜1.5 h。
转膜结束后的PVDF膜使用1×TBST在摇床上清洗3次,10 min/次;加入5%脱脂奶粉于摇床上封闭1~2 h,用1×TBST在摇床上洗膜3次,10 min/次;加入一抗(按照1∶1 000进行稀释),放入4 ℃过夜,孵育18~24 h,用1×TBST在摇床上洗膜3次,10 min/次;加入二抗,置于摇床上孵育1~2 h,1×TBST在摇床上洗膜3次,10 min/次;将显影液ECL染色A与B液按1∶1的比例充分混匀后,均匀覆盖在PVDF膜上,放入数字凝胶成像系统中进行成像并拍照。
1.6 统计分析
使用SPSS 25.0软件进行统计分析,使用GraphPad Prism 8.0软件统计分析柱状图,采用方差分析多重比较检验数据的差异性,结果以平均值±标准差表示,以P<0.05为差异显著性判断标准。
2 结 果
2.1 猪新鲜精液质量参数检测
由表1可知,新鲜精液精子活力为94.00%,质膜完整性为73.23%,顶体完整性为70.04%,各项指标均显示精液质量完好,说明精液适合应用于本试验研究。

表1 猪新鲜精子质量参数检测结果
2.2 冷冻前添加HSPA8和解冻后添加精浆对猪精子运动能力的影响
由表2可知,与对照组相比,添加0.5 μg/mL HSPA8组且未添加精浆时,精子曲线速度、直线速度、平均路径速度和前向性运动均显著提升(P<0.05),精子直线性运动和运动的摆动性均无显著差异(P>0.05);向解冻稀释液中添加不同浓度的精浆后发现,各处理组的精子运动参数受精浆浓度的影响产生改变,当精浆浓度为50%时改善的效果最佳,且显著高于添加0.5 μg/mL HSPA8组(P<0.05)。
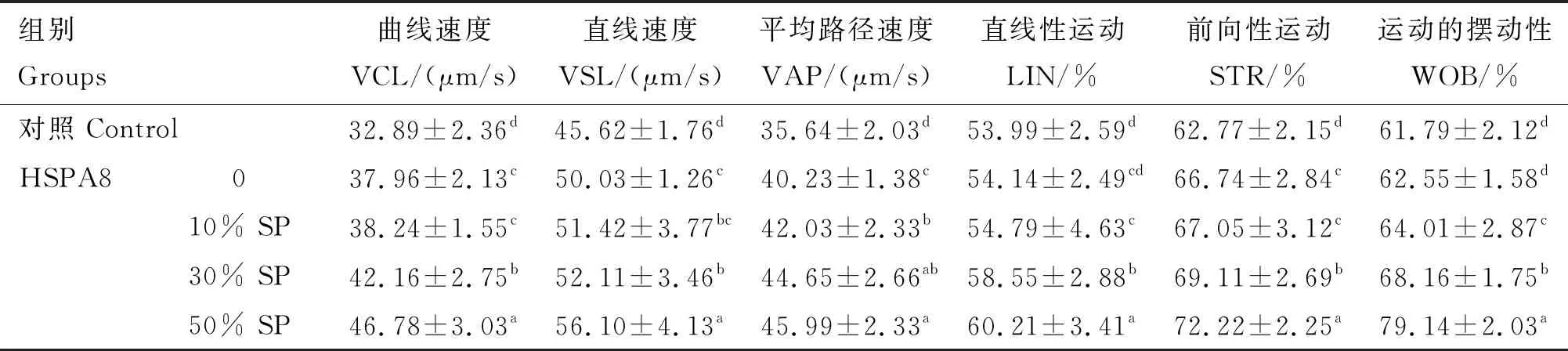
表2 冻融前后猪精子运动能力的检测结果
2.3 冷冻前添加HSPA8和解冻后添加精浆对猪精子质量参数的影响
由表3可知,与对照组相比,添加0.5 μg/mL HSPA8处理组精子活力、质膜完整性、顶体完整性均显著提升(P<0.05),细胞凋亡水平和线粒体膜电位均显著下降(P>0.05);向解冻稀释液中添加不同浓度的精浆后发现,在精浆浓度为30%时精子活力、质膜完整性、顶体完整性和线粒体膜电位开始得到显著改善(P<0.05),当精浆浓度为50%时改善的效果最佳,且显著高于添加0.5 μg/mL HSPA8组(P<0.05)。冻融前后猪精子质膜完整性、顶体完整性、细胞凋亡和线粒体膜电位的检测结果见图1~4。
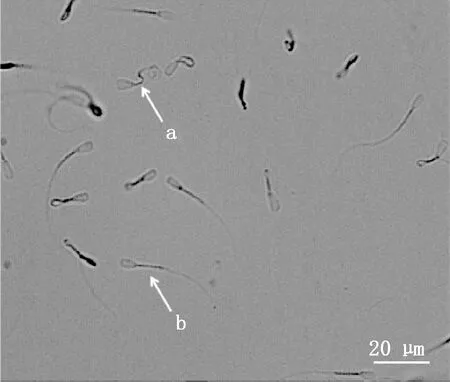
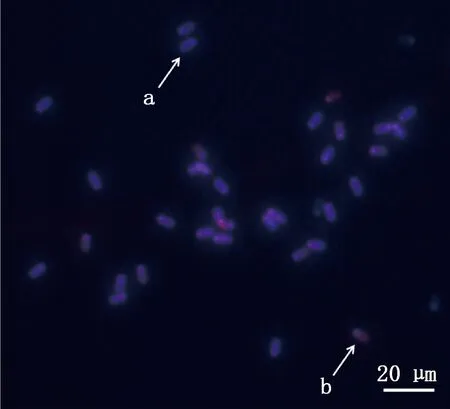
a,精子尾巴卷曲-质膜完整的精子;b,精子尾巴未卷曲-质膜破损的精子
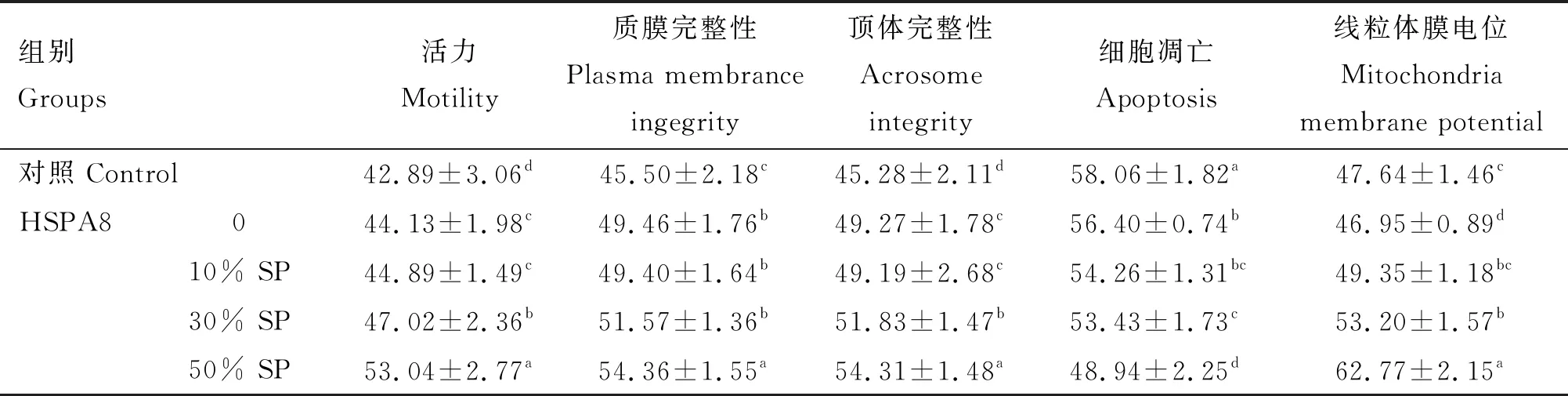
表3 冻融前后猪精子质量参数的检测结果
2.4 冷冻前添加HSPA8和解冻后添加精浆对猪精子鱼精蛋白缺失水平的影响
由图5可知,当向冷冻保护剂中添加HSPA8时,精子鱼精蛋白缺失率显著降低(P<0.05);用不同浓度精浆对解冻精子进行处理发现,用50%精浆处理的精子鱼精蛋白缺失率明显下降,且显著低于添加0.5 μg/mL HSPA8组(P<0.05)。
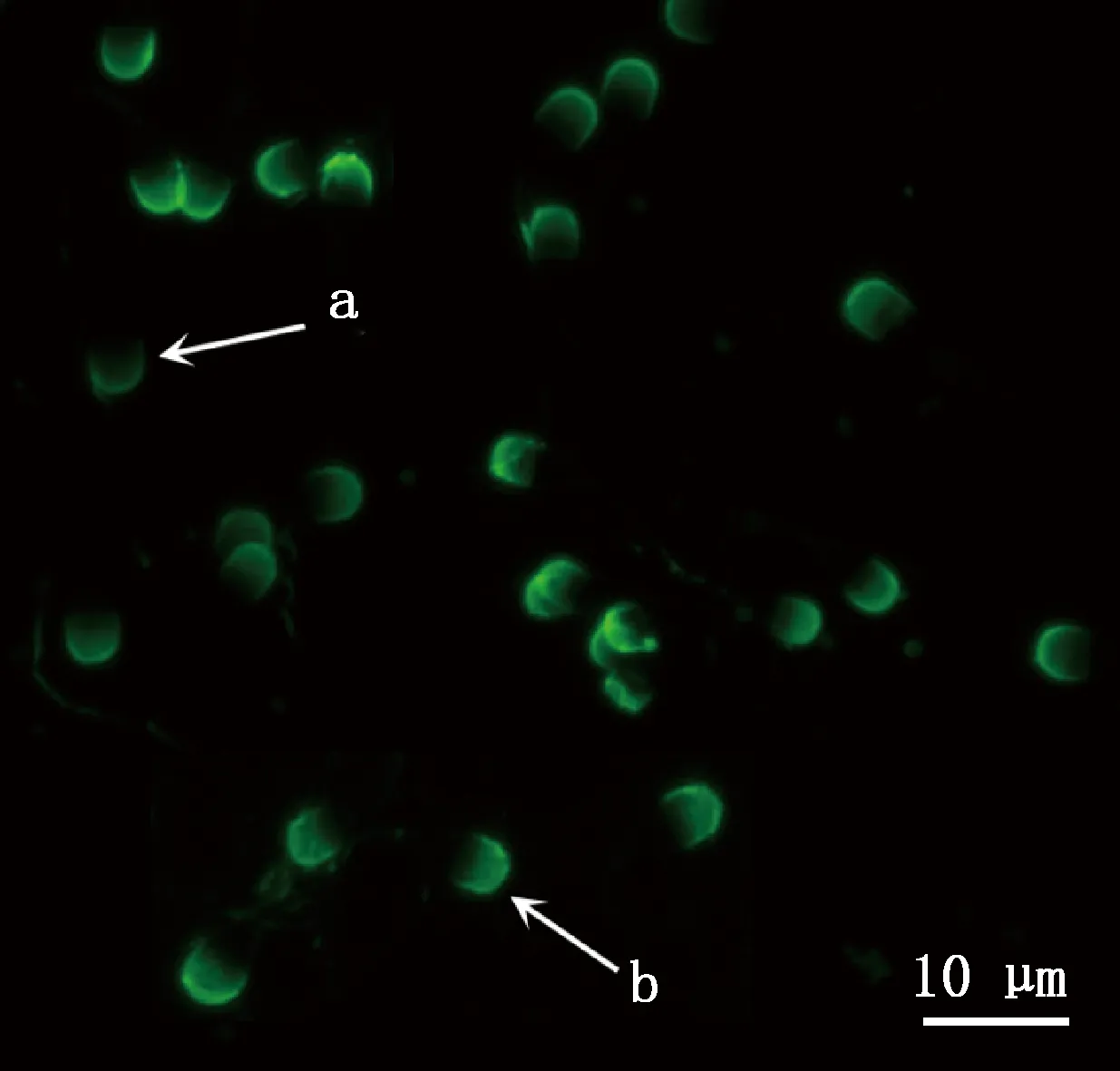
a,顶体破损的精子;b,顶体完整的精子
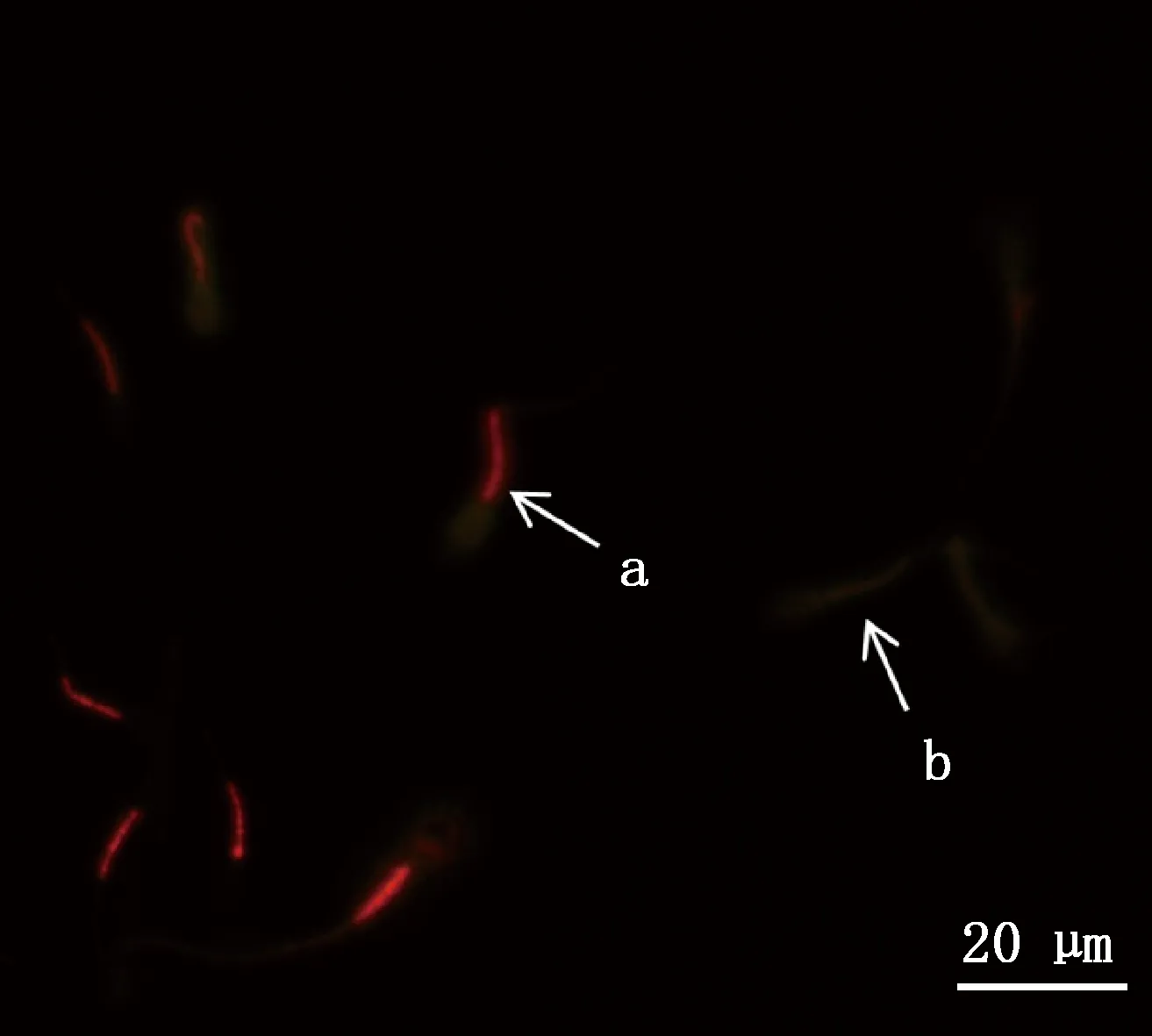
a,活精子细胞;b,死精子细胞
a,高线粒体膜电位;b,低线粒体膜电位
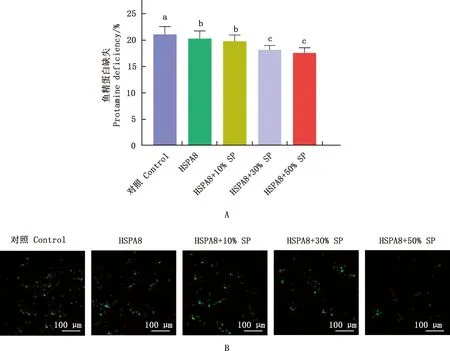
A,柱形图,肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)。下同。B,荧光图,发出亮光(亮绿色荧光)为鱼精蛋白缺失的精子;发出暗光(暗绿色荧光)为正常的精子
2.5 冷冻前添加HSPA8和解冻后添加精浆对猪精子获能状态的影响
由图6可知,添加0.5 μg/mL HSPA8的精子蛋白酪氨酸磷酸化水平显著高于对照组(P<0.05);用不同浓度的精浆对解冻精子进行处理发现,添加50%精浆的处理组精子蛋白酪氨酸磷酸化水平显著高于0.5 μg/mL HSPA8组(P<0.05)。
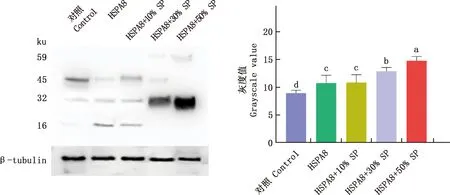
A,蛋白酪氨酸磷酸化检测结果;B,灰度值
3 讨 论
3.1 HSPA8对冻融精子的影响
HSPA8是高度保守的蛋白,存在于由猪输卵管上皮、sAPM制备的可溶性蛋白质亚群中,在精子存储过程中发挥作用,可提高公猪和公牛精子的体外存活率[7]。因此,HSPA8可能是一种具有生物活性的sAPM成分,可用于提高体外精子活力[7]。本研究也得到了相同的结果,与对照组相比,在冷冻基础液中添加0.5 μg/mL HSPA8提高了公猪的精子活力,且添加0.5 μg/mL HSPA8不仅仅可以提高精子活力,还可提高精子顶体膜、DNA完整性(鱼精蛋白)、线粒体膜电位及体外获能水平等。表明HSPA8可在一定程度上改善冷冻保护剂对猪精子的不良影响[13]。
3.2 HSPA8和精浆联合使用对冻融精子质量参数与动力学参数的影响
目前,冷冻保存仍然会对精子造成损害,低温保存通过对精子膜、细胞骨架、运动器官和细胞代谢等产生影响,降低精子质量[14]。精子的存活率、质膜完整性、顶体完整性和抗氧化状态等各种参数都与生育能力有关,且都会受到冻融过程的影响[15-16]。Lodhi等[17]报道,解冻后正常状态精子的存活率、运动能力和膜完整性之间都有显著的相关性。在本研究中,通过检测精子的活力、质膜完整性、顶体完整性和细胞凋亡水平发现,用精浆处理确实得到了改善。在冻融时向解冻稀释液中添加10%和30%精浆对精子的影响相对较少,用50%精浆处理后有显著的效果,表明精浆的作用与浓度有关;且在50%精浆中解冻冷冻保存的公猪精子将显著提高精子的生存和运动能力,这可能会延长精子的寿命并对母猪的生育能力产生积极影响。
精子活力高可能与线粒体的活性有关,而控制精子活力的机制是调节其线粒体活性,因此这对于维持精液活力是绝对有必要的[18-20]。线粒体膜电位与精子动力学参数(VCL、VSL、VAP等)显著相关,且具有高水平线粒体膜电位的精子体外受精后受精率更高[21]。本研究中,与对照组相比,在冷冻前添加HSPA8和解冻后用50%精浆处理的精子动力学参数均显著升高,且表现出更高水平的线粒体膜电位。 说明0.5 μg/mL HSPA8和50%精浆联合使用可显著改善线粒体膜电位水平与精子的运动性能。
3.3 HSPA8和精浆联合使用对冻融精子DNA完整性和精子获能的影响
鱼精蛋白是一种精子中浓缩的父本基因组的包装中必不可少的特异核蛋白[22]。研究显示,鱼精蛋白缺乏会使染色质的紧密包装恶化,并增加对外界压力的敏感性,从而导致更高的精子DNA损伤风险[23]。到目前为止,最常用的分析鱼精蛋白缺乏症的方法是CMA3染色,这与精子DNA的完整性密切相关,鱼精蛋白缺乏与精子DNA损伤呈正相关[24]。本研究发现,当添加HSPA8冷冻保护剂和解冻后添加不同浓度的精浆时鱼精蛋白缺失率明显减少,表明添加HSPA8后冷冻精子中鱼精蛋白水平得到了来自精浆的主动保护作用,从而保护精子的DNA完整性。
精子获能是哺乳动物精子受精的终极成熟事件,精子获能过程包括pH改变、蛋白质酪氨酸磷酸化的增加、钙离子的涌入,以及精子蛋白酶体活性的变化和锌离子的外流,以获得受精的能力[25]。由于冷冻导致了类似获能的状态,进而致使冻融公猪精子的受精期缩短。研究证明,精浆可在体外对精子质量产生积极的影响,可逆转冻死的现象,根据金霉素(CTC)的染色模式,暴露于精浆会在体外逆转公猪精子的冷冻吞噬作用[26]。在冷冻保存的公羊精液中添加精浆可改善受精后母羊的繁殖力[27],在精浆中解冻公猪精子能增加体内精子的存活时间,也可改善家畜的生殖能力[28-29]。在本研究中,冷冻前添加HSPA8和解冻后用50%精浆处理的精子蛋白酪氨酸磷酸化显著增加,表明精子完全具备体外受精的能力,也同时有可能改善母猪的受精率。
4 结 论
本研究在冷冻基础液中添加0.5 μg/mL HSPA8和解冻稀释液中添加不同浓度的精浆发现,0.5 μg/mL HSPA8和50%精浆联合使用显著改善了精子的活力、质膜完整性、顶体完整性、线粒体膜电位、细胞凋亡水平和体外获能能力。
