2018-2020年中国部分省市猪流行性腹泻病毒S1基因的监测及遗传变异分析
2022-03-03杨汉春
颜 忠,杨汉春
(中国农业大学动物医学院,北京 100193)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的猪的一种急性、高度传染性肠道疾病,以猪的呕吐、水样腹泻、脱水和生长迟缓为主要特征[1]。PED首次出现在20世纪70年代初的英格兰和比利时[2],并于1977年在比利时首次分离出PEDV[3],1984年在中国首次出现,随后一直处于散发状态,自2010年底,中国大范围暴发了PED疫情,造成了严重的经济损失,2013年春季PED开始传入美国、加拿大和墨西哥等国家[4]。
研究表明,PEDV的变异主要发生在S基因,S基因对于了解PEDV田间分离株的遗传相关性和流行病学状况及促进疫苗研发至关重要[5-7]。目前,PEDV全球主要流行毒株分为GⅠ(经典型)和GⅡ(变异型)2个基因型,其中GⅠ基因型包括GⅠa和GⅠb 2个基因亚型,GⅡ基因型包括GⅡa、GⅡb和GⅡc 3个基因亚型[8]。GⅠ基因型毒株S基因长度为4 152 bp,编码1 383个氨基酸,而GⅡ基因型毒株S基因长度为4 161或4 158 bp,比GⅠ基因型毒株长9或6 bp。GⅠ与GⅡ基因型毒株主要差异在于S基因。对PEDV S蛋白序列比对分析发现,GⅠ与GⅡ基因型毒株S蛋白之间存在上百个氨基酸差异,主要集中于S1基因,而S2基因相对保守[9]。因此,对PEDVS1基因变异情况进行监测与遗传变异分析对于PED的防控具有重要的意义。
本研究于2018-2020年从中国11个省市318个规模化猪场共采集2 391份样品,采用RT-PCR方法检测PEDV核酸,选择30个PEDV毒株进行S1全基因扩增与测序,与国内外参考毒株进行遗传变异分析,构建遗传进化树,并对PEDV S1蛋白进行分析,预测其流行变异趋势,以期为PEDV的防控奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品 2018年1月至2020年12月从中国北京、内蒙古、河北、河南、山东、四川、湖北、广西、安徽、江苏及重庆318个母猪存栏规模>500头的规模化猪场共采集2 391份样本(包括腹泻猪和非腹泻猪的肠道、粪便、口腔液等),通过RT-PCR方法检测样品PEDVS1基因,并对不同年度、省市、季节猪场和样品PEDV核酸阳性率进行分析。不同年份及地点的猪场数量和样品数量详见表1。
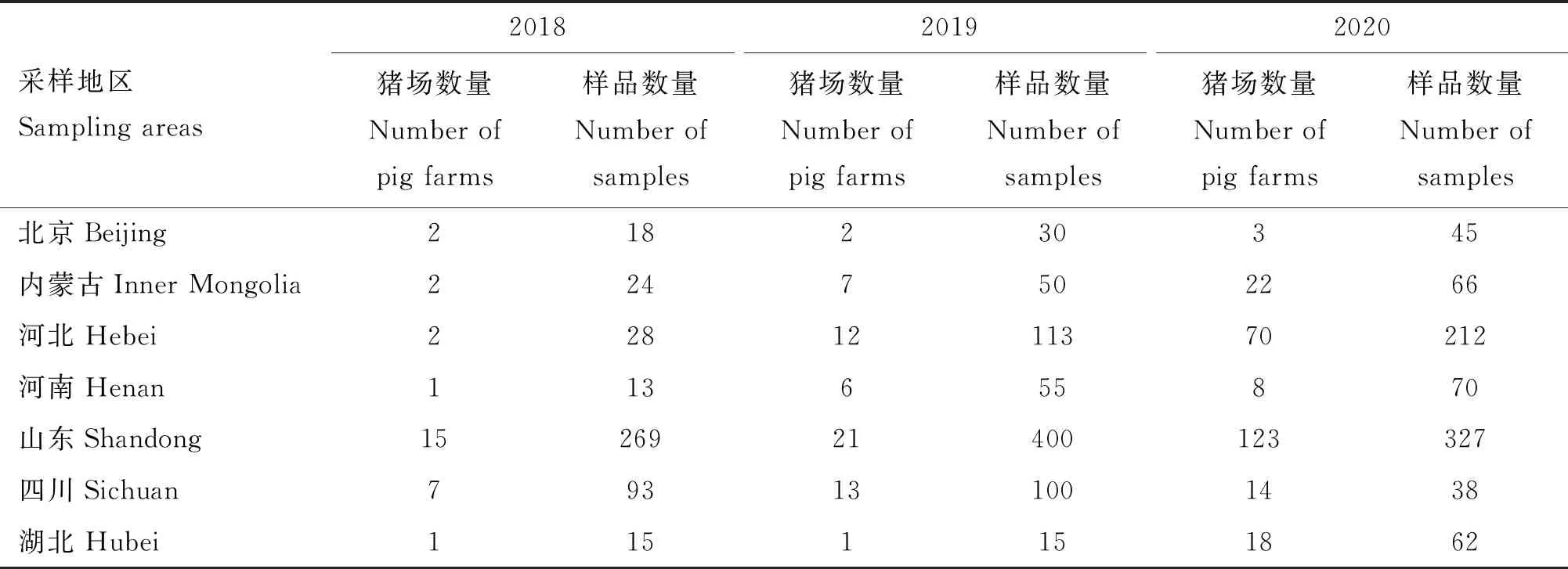
表1 2018-2020年11省市检测的猪场数量和样品数量
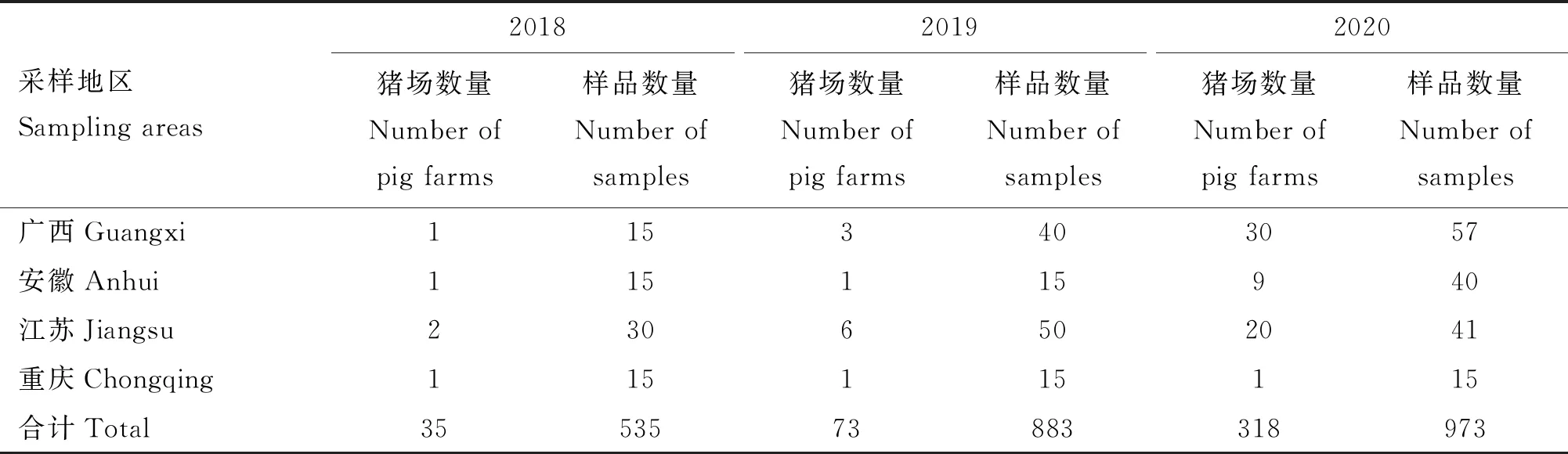
续表
1.1.2 主要试剂及仪器 2×One-Step RT-PCR Master Mix、Trans5K Plus DNA Marker、Enzyme Mix均购自北京全式金生物技术有限公司;RNA提取试剂盒、DNA凝胶回收试剂盒、质粒小量DNA提取试剂均购自天根生化科技(北京)有限公司。PCR仪购自Bio-Rad公司;超净台购自苏州安泰空气技术有限公司;离心机、单道移液器均购自赛默飞世尔(上海)仪器有限公司;移液器购自普兰德(上海)贸易有限公司;凝胶成像系统和水平电泳仪电泳槽均购自北京六一生物科技有限公司;千分之一电子天平购自上海卓精电子科技有限公司;涡旋振荡器、微量振荡器均购自海门市其林贝尔仪器制造有限公司。
1.2 方法
1.2.1 样品处理 肠道组织:取适量有典型病变的肠道组织,按1∶4加入灭菌的PBS或生理盐水,置于研磨器(灭菌)中研磨,反复冻融3次,12 000 r/min离心5 min,取上清液进行病毒RNA提取。
口腔液等液体样品:避免反复冻融,12 000 r/min离心5 min,取上清液进行病毒RNA提取。
粪便拭子:使用灭菌棉签采集粪便拭子,立即置于0.5 mL含103U/mL双抗(青霉素和链霉素)的PBS中,涡旋震荡15 s,12 000 r/min离心5 min,取上清液进行病毒RNA提取。
1.2.2 引物设计与合成 根据GenBank中BJ-2011-1毒株S1基因保守序列(登录号:JN825712)设计1对特异性引物,A-F:5′-GCGCTGTGATT-GACGGCACACT-3′;A-F:5′-GTAAGCATAGA-GTTGACTTCAG-3′,预期扩增产物大小约为2 800 bp。引物由生工生物工程(上海)股份有限公司合成。
1.2.3 病毒RNA提取与扩增 按照RNA提取试剂盒说明书,采用离心柱法提取核酸,以提取的RNA为模板进行一步法RT-PCR反应。PCR反应体系20 μL:2×One-Step Reaction Mix 10 μL,上、下游引物各0.4 μL,RNA模板5.5 μL,Enzyme Mix 0.4 μL,DEPC水3.3 μL。PCR反应条件:45 ℃反转录30 min;95 ℃预变性 5 min;95 ℃变性 30 s,50 ℃退火 30 s,72 ℃延伸 3 min,共35个循环;72 ℃延伸10 min。
1.2.4 PEDVS1基因克隆与测序 RT-PCR扩增产物进行1.0%琼脂糖凝胶电泳检测后按照胶回收试剂盒说明书回收,与pEASY®-Blunt Simple Cloning载体连接,转化大肠杆菌DH5α感受态细胞,于37 ℃培养至长出单个菌落,挑取合适菌落扩大培养,吸取200 μL菌液涂于LB/Amp+平板上,37 ℃培养过夜(12~16 h),挑选菌落进行PCR鉴定,将阳性样品送生工生物工程(上海)股份有限公司测序。
1.2.5 PEDVS1基因序列比对和分析 使用DNAStar软件中的 MegAlign 程序对测序结果进行编辑和遗传进化分析。在 GenBank上下载部分参考毒株,具体信息见表2。使用 DNAStar 软件中的 MegAlign 程序采用 ClustalW方法对参考序列与目标序列进行核苷酸和氨基酸序列的相似性比对及抗原表位分析,使用 Mega 7.0软件并采用 Neighbor-Joining法绘制进化树。
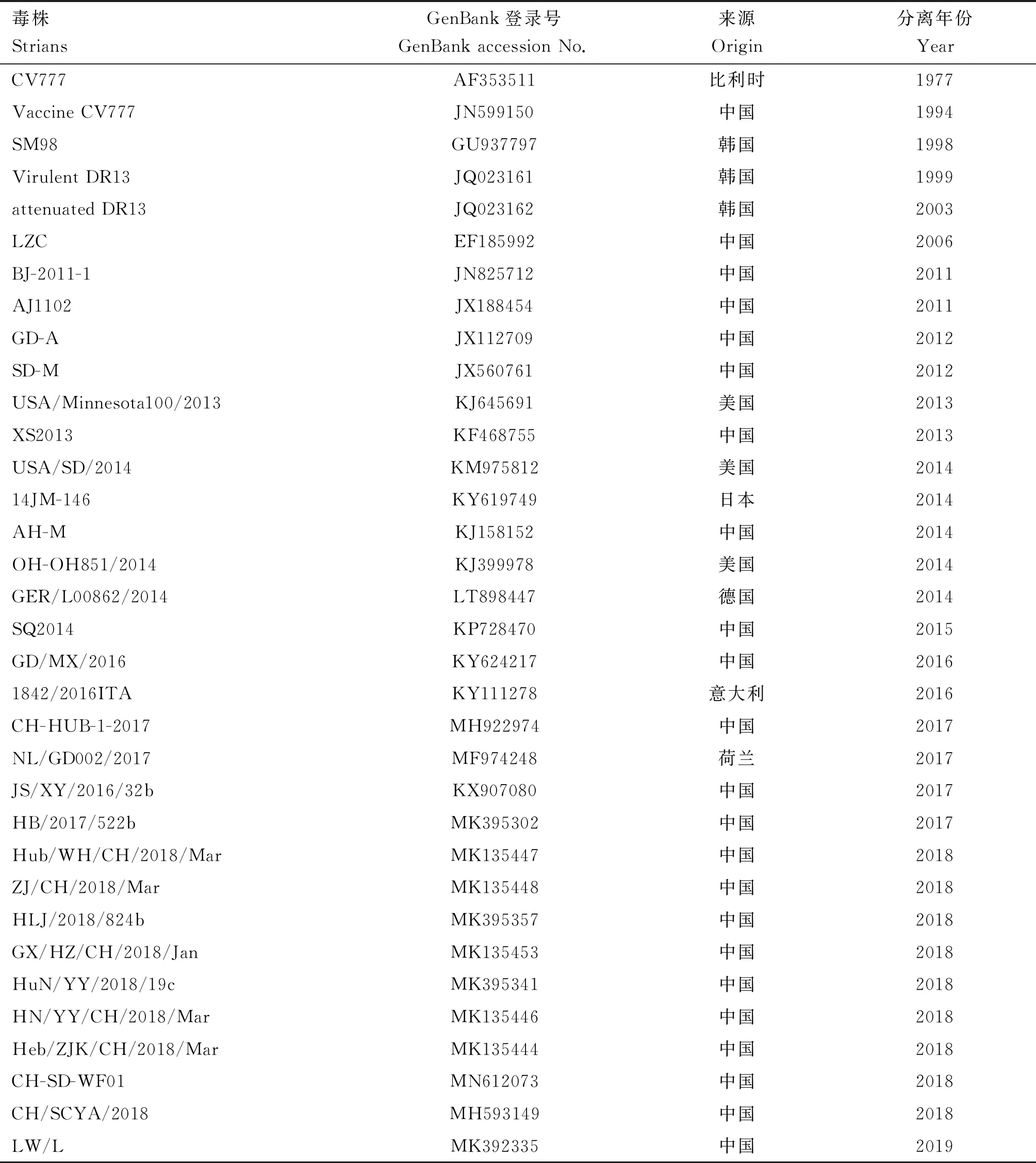
表2 PEDV参考毒株信息
2 结 果
2.1 2018-2020年11省市猪场PEDV核酸检测结果
2018-2020年11省市猪场PEDV核酸检测结果见表3。由表3可知,猪场PEDV核酸阳性率分为48.57%、10.96%和4.72%,呈现出逐年下降的趋势,样品PEDV核酸阳性率分别为28.97%、8.27%和7.50%,也呈现出逐年下降的趋势。

表3 2018-2020年11省市猪场及样品PEDV核酸检测结果
2.2 2018-2020年11省市猪场不同季度PEDV核酸检测结果
2018-2020年不同季度猪场和样品PEDV核酸阳性率统计结果见表4。2018年4个季度猪场PEDV核酸阳性率分别为46.67%、10.53%、6.67%和38.89%;2019年4个季度猪场PEDV核酸阳性率分别为14.28%、5.89%、0和6.90%;2020年4个季度猪场PEDV核酸阳性率分别为3.57%、2.63%、2.41%和4.28%。2018年4个季度样品PEDV核酸阳性率分别为40.59%、11.36%、5.30%和39.01%;2019年4个季度样品PEDV核酸阳性率分别为10.99%、6.41%、0和3.91%;2020年4个季度样品PEDV核酸阳性率分别为4.34%、3.37%、4.94%和12.12%。
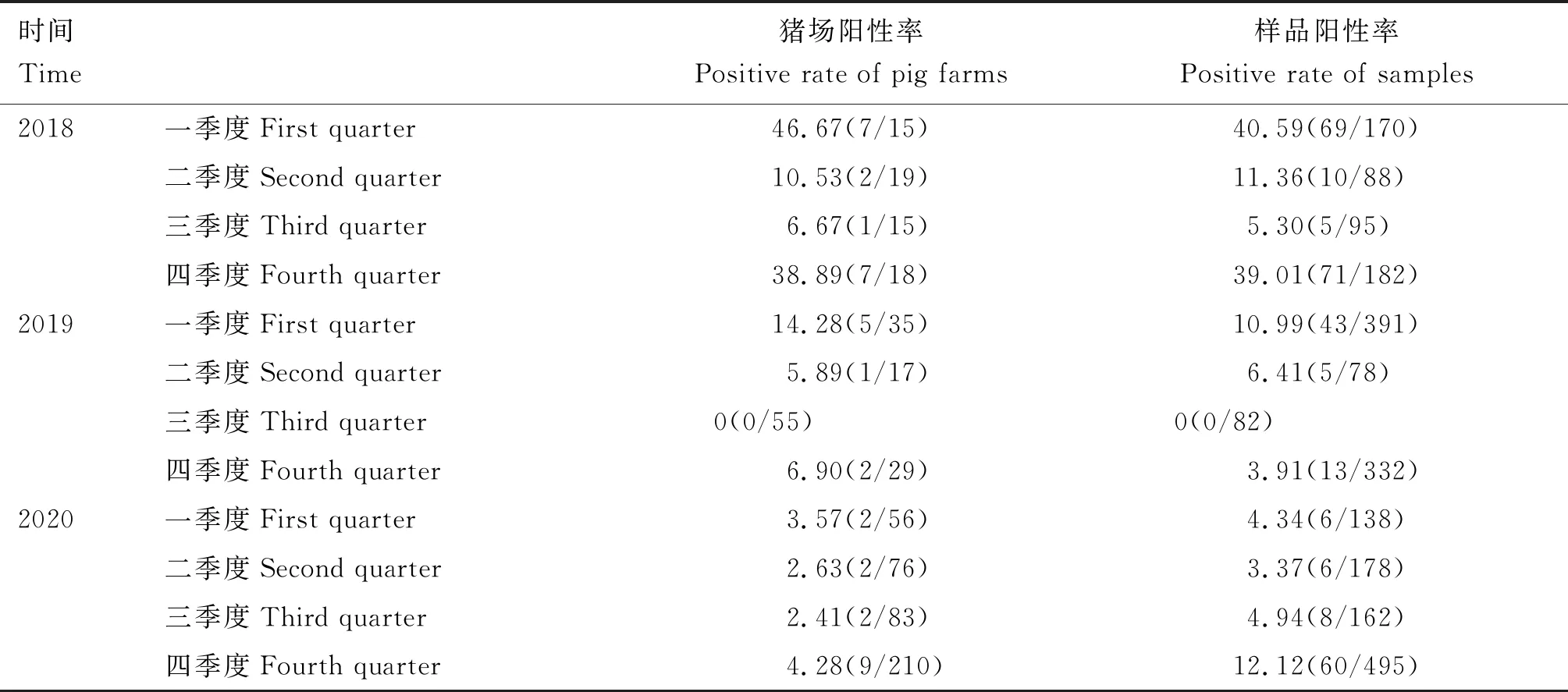
表4 2018-2020年不同季度PEDV核酸检测结果
2.3 PEDV S1基因RT-PCR扩增与测序
将提取的PEDV RNA样品进行反转录,PCR扩增S1基因,结果显示,目的条带约2 800 bp,与预期大小一致,部分样品PCR扩增结果见图1。将PCR产物与pEASY®-Blunt Simple Cloning载体进行连接,并转化大肠杆菌DH5α感受态细胞,采用PCR方法对重组质粒进行鉴定,将阳性克隆菌株送生工生物工程(上海)股份有限公司测序,共获得30条序列,分别命名为CH-AHsz-2018、CH-BJcp-2018、CH-HBhs-2018、CH-HBwh-2018、CH-HNny-2018、CH-SCmy-2018、CH-SDdz-2018、CH-SDly-2018、CH-SDwf-2018、CH-SDyt-2018、CH-HBhs-2019、CH-SCbc-2019、CH-SCmy-2019、CH-SCqs-2019、CH-SCxp-2019、CH-SCyc-2019、CH-SDdz-2019、CH-GXxz-2020、CH-HBfc-2020、CH-HBgl-2020、CH-HBhh-2020、CH-HBhs-2020、CH-NMtl-2020、CH-NMzn-2020、CH-SCls-2020、CH-SDcx-2020、CH-SDdz-2020、CH-SDlq-2020、CH-SDls-2020和CH-SDwl-2020。
M,DL5000 DNA Marker;1,阳性对照;2,阴性对照;3~24,部分样品
2.4 PEDV S1基因序列比对分析
利用DNAStar软件对30株PEDV的S1基因进行相似性比对分析,结果显示,本试验获得的30株毒株序列之间的核苷酸相似性为93.0%~99.5%,氨基酸相似性为91.7%~100%(图2、3),其中22株序列基因长度为2 376 bp,共编码约792个氨基酸,8株序列基因长度为2 367 bp,共编码约789个氨基酸;本试验获得的30株毒株序列与CV777、Vaccine CV777为代表的GⅠ基因型毒株核苷酸和氨基酸序列相似性分别为91.1%~95.2%和89.4%~95.4%;与以BJ2011-1、AJ1102、GER/L00862/2014为代表的GⅡ基因型毒株核苷酸和氨基酸序列相似性分别为93.4%~99.3%和92.1%~99.2%;与2017-2018年流行的CH-SCYA-2018、HLJ-2018-824b、Heb-ZJK-CH-2018Mar、CH-SD-WF01、GX-HZ-CH-2018Jan、HN-YY-CH-2018Mar、Hub-WH-CH-2018Mar、HuN-YY-2018-19c等GⅡ基因型毒株核苷酸和氨基酸序列相似性分别为93.2%~99.6%和91.2%~99.5%。

图2 30株PEDV流行株S1基因核苷酸序列相似性分析
使用Mega 7.0软件采用ClustalW方法将获得的30个毒株与国内外34株具有代表性的参考毒株S1基因核苷酸序列进行比对,构建遗传进化树。由图4可知,进化树分为GⅠ基因型和GⅡ基因型。与国内外34株参考毒株相比,本研究得到的30个毒株均为GⅡ基因型,其中17株毒株为GⅡa基因亚型、5株毒株为GⅡb亚型、8株毒株为GⅡc亚型。 这些毒株与2010年以后国内流行的BJ2011-1、GD-A等GⅡ基因型毒株的亲缘关系较近,与中国早期分离的CV777、Vaccine CV777、LZC等GⅠ基因型毒株的亲缘关系较远。
2.5 PEDV S1基因主要抗原位点分析
对30株PEDV毒株S1蛋白氨基酸序列进行分析,结果见图5。由图5可知,本研究中的22株PEDV流行毒株与2017-2018年流行的CH-SCYA-2018、HLJ-2018-824b、Heb-ZJK-CH-2018Mar、GX-HZ-CH-2018Jan、CH-SD-WF01、HN-YY-CH-2018Mar、Hub-WH-CH-2018Mar、HuN-YY-2018-19c等GⅡ基因型毒株S1氨基酸序列相比表现出几处相同遗传标记,在55-56位氨基酸之间存在4个氨基酸(GENQ)的插入,139-140位氨基酸之间存在1个氨基酸(N)的插入,159-160位氨基酸之间存在2个氨基酸(DG)的缺失;另外8株流行毒株S1基因编码的氨基酸没有相同的插入和缺失,表现出与经典株和S-INDEL毒株相同的遗传标记。

图3 30株PEDV流行株S1基因编码氨基酸序列相似性分析
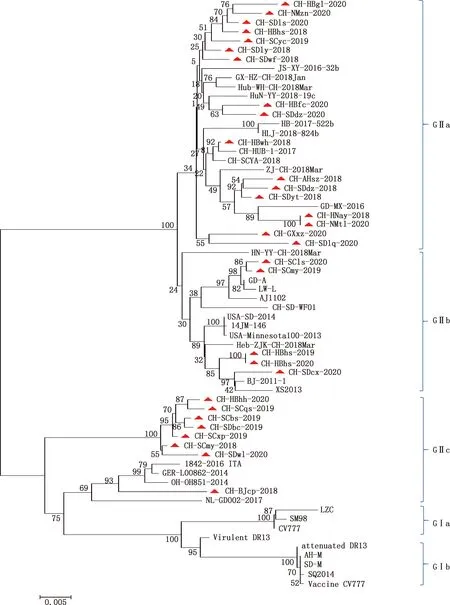
图4 2018-2020年PEDV流行株S1基因遗传进化分析

-,氨基酸缺失
3 讨 论
近年来,中国学者对不同地区PEDV的分子流行病学和遗传变异分析进行了大量研究,张志等[10]2011-2014年对29个省市7 021个猪场采集的1 383份腹泻样品进行PEDV流行病学调查显示,PEDV猪场阳性率为57.83%,样品阳性率为67.82%;蒋新华等[11]对2017年从江西省11个地区采集的182份小肠组织和粪便样品检测结果显示,PEDV阳性率为37.91%;严谨等[12]对2017-2019年从广西地区收集的1 463份样品的检测结果显示,PEDV阳性率为10.12%;袁翠霞等[13]对2017-2019年从贵州地区38个猪场292份疑似腹泻样品进行检测发现,PEDV阳性率为44.2%。PEDV的高阳性率表示PEDV一直很活跃,变异毒株在国内不断循环[14],对中国养猪业依然存在较大的危害,PEDV已成为中国非常重要的病原体,仅次于非洲猪瘟病毒和猪繁殖与呼吸综合征病毒[15],需引起高度重视。本研究对中国不同地区、不同季节猪群PEDV的感染状况进行了监测。结果显示,2018-2020年,11省市猪场PEDV核酸阳性率分为48.57%、10.96%和4.72%,11省市样品PEDV核酸阳性率分别为28.97%、8.27%和7.50%,猪场和样品PEDV核酸阳性率呈现出逐年下降的趋势,这可能与2018年8月非洲猪瘟病毒进入中国之后,猪场加强生物安全管理有关;季度监测结果显示,猪场一年四季均感染PEDV,无明显的季节性,但一季度和四季度频发,说明PEDV在春节和冬季较活跃。
PEDVS1基因是主要抗原基因,常用于PEDV分子流行病学监测[16],本研究扩增得到的30个毒株序列之间的核苷酸相似性为93.0%~99.5%,氨基酸相似性为91.7%~100%,均为GⅡ基因型,其中17株毒株为GⅡa基因亚型、5株毒株为GⅡb基因亚型、8株毒株为GⅡc基因亚型,表明2018-2020年GⅡa基因亚型毒株为中国流行的主要毒株类型。本研究发现,在同一年度同一个地区流行PEDV不同基因亚型毒株,在这些毒株广泛流行的地区确定PEDV变异的来源至关重要,这些地区有可能成为PEDV遗传变异的储存库,从而导致不同PEDV亚基因型之间的重组,这可能是已有经典株疫苗不能完全保护的原因。对30株PEDV毒株S1蛋白氨基酸序列进行分析显示,本研究中的22株PEDV流行毒株与2017-2018年流行的GⅡ基因型毒株S1氨基酸序列表现出几处相同的遗传标记,另外8株流行毒株S1基因编码的氨基酸没有相同的插入和缺失,表现出与经典株和S-INDEL毒株相同的遗传标记,Guo等[8]将其归类为GⅡc基因亚型毒株,是GⅠa和GⅡa基因亚型的重组变异毒株氨基酸序列。
2010年10月,中国南方省份开始暴发PED疫情,免疫疫苗的猪群并未免于PEDV的感染,经典毒株的疫苗未能提供足够的保护作用[17-19],泰国和韩国研究人员证实,所有可用的商业疫苗(GⅠ基因型)均不能针对当前流行的毒株(GⅡ基因型)提供足够的免疫保护[20],这种现象可能是由病毒的急剧变异引起的,疫苗和田间流行毒株之间的抗原性、遗传性(各个S蛋白之间的氨基酸差异>10%)和遗传进化树存在差异(GⅠ与GⅡ)[21-24]。Guo等[8]分析发现,GⅡ基因型毒株中S1蛋白中和表位7个氨基酸的替换(L521H、S523G、V527I、T549S、G594S、A605E和L612F)可能导致传统的GⅡ基因组的灭活疫苗和减毒疫苗不能有效保护GⅡ基因型毒株感染。因此,应使用田间广泛流行的GⅡ基因型 PEDV流行毒株控制PED。来自田间的GⅡ基因型PEDV分离株的重组S1蛋白有效地保护了新生仔猪免受PEDV感染,其有可能被用作预防PED的亚单位疫苗[25]。在中国,疫苗免疫仍是控制PED发生和流行的最佳方法,是预防、控制和净化PED的主要手段,未来开发高效的新型基因工程疫苗是今后疫苗研究的重点方向。本研究结果为监测和分析中国PEDV的变异和演化提供了临床数据支持,为PED防控和疫苗研制提供了参考。
4 结 论
本研究于2018年1月至2020年12月期间对中国11省市PEDV的分子流行病学进行监测与分析,发现获得的30株PEDV都属于GⅡ基因型,表明GⅡ基因型PEDV是目前中国流行的主要基因型毒株。
