电子穿梭体核黄素对菌株Clostridium sp. LQ25异化铁还原性质的影响
2022-03-02刘洪艳
袁 媛,刘洪艳
(天津科技大学海洋与环境学院,天津 300457)
微生物氧化分解释放出电子,电子经呼吸链从有 机物传递到胞外电子受体,此过程称为胞外电子传递(extracellular electron transfer,EET)[1].胞外电子传递过程经历两个阶段[2]:第一阶段是有机物被氧化后产生的电子,经由电子传递链上的组分传递至细胞内膜,再由细胞色素蛋白或其他功能蛋白传递至细胞外膜;第二阶段是电子从细胞外膜到末端电子受体的传递,主要的4种方式为直接接触、纳米导线机制、应电运动和电子穿梭机制[3].
异化铁还原是指微生物将有机物中的电子转移到以Fe(Ⅲ)为末端的电子受体的过程,并在这一过程中将Fe(Ⅲ)还原为Fe(Ⅱ).希瓦氏菌和地杆菌作为呼吸型异化铁还原菌中的模式菌,在其胞外电子传递过程中,细胞色素c作为不可缺少的一类蛋白质,不仅可以将电子从细胞内膜转移到细胞外膜,而且可以分泌到细胞外,作为外膜蛋白参与细胞表面的电子传递[4].Breuer等[5]总结菌株Shewanella oneidensisMR-1存在16种细胞色素c,包括MtrC、MtrF、OmcA、MtrA、MtrD、CymA等.对于呼吸型异化铁还原细菌,胞外电子传递机制的研究主要集中于直接接触机制.而在研究发酵型异化铁还原细菌Anoxybacter fermentansDY22613T的胞外电子传递机制时,Li等[6]未发现该菌株的全基因组序列中有编码细胞色素c的基因.对于缺少细胞色素c的发酵型异化铁还原细菌,利用电子穿梭体可能是胞外电子传递的一种策略[7].
电子穿梭体作为胞外电子传递的重要组成部分,可介导微生物间、微生物与电子受体间以及电子供体与电子受体间的电子转移[8].电子穿梭体参与微生物胞外电子传递的基本过程:氧化态电子穿梭体接受电子变成还原态,还原态电子穿梭体将电子传递给胞外的电子受体完成一次电子传递,而自身因失去电子又变回氧化态进行新一轮的电子传递[9].电子穿梭体按照来源可分为内源电子穿梭体和外源电子穿梭体.内源电子穿梭体是依靠微生物自身分泌的氧化还原物质,实现电子从供体到受体的传递,而外源电子穿梭体是环境中原来就存在的或是人为添加物,在微生物胞外电子传递过程中起到呈递电子的作用;按照化学组成可分为黑色素类、吩嗪类、腐殖质类、醌类和黄素类[10-14].
核黄素作为电子穿梭体是由Canstein等[7]发现并确定的,其研究结果表明菌株奥奈达希瓦氏菌(Shewanella oneidensis)MR-1分泌胞外电子穿梭体黄素单核苷酸(FMN)和核黄素,用于促进菌株MR-1生长和加速还原结晶度较差的Fe(Ⅲ)氧化物.除希瓦氏菌(Shewanellasp.)外,研究者发现在多株细菌中,核黄素具备增强电子传递的能力,例如硝酸盐还原菌(Bacillus licheniformis)[15]可以利用希瓦氏菌分泌的核黄素加速不锈钢的腐蚀,而铁呼吸菌(Methylophilussp.)[16]和丝状芽胞杆菌(Cystobasidium slooffiae)[17]均能自身分泌核黄素,前者用于异化铁还原的胞外电子传递,后者用于提高其生物电产量.核黄素通常以游离的形态作为电子穿梭体发挥作用,即菌体分泌的核黄素在细胞内接受电子变为还原态,而后还原态的核黄素通过扩散将电子呈递至电子受体,自身又变回氧化态,以此过程不断循环[18].也有研究发现核黄素在促进菌株电子传递的过程中并非是单一的发挥作用,而是可以作为细胞色素c和MtrC的辅因子以促进电子传递[11,19-20].
本实验以分离自海洋沉积物中的菌株Clostridiumsp. LQ25为研究对象,分析电子穿梭体核黄素对菌株异化铁还原性质的影响及菌株分泌核黄素的规律,旨在为探究发酵型异化铁还原细菌的胞外电子传递机制提供新的思路.
1 材料与方法
1.1 菌株来源
菌株Clostridiumsp. LQ25[21]由本课题组成员从海洋沉积物中分离得到,GenBank号为MK156151.
1.2 培养方法
培养基成分:葡萄糖20.0g/L,L-半胱氨酸0.5g/L,NaCl 4.0g/L,MgCl20.1g/L,K2HPO41.5g/L,酵母粉1.0g/L,胰蛋白胨4.0g/L,200mmol/L氢氧化铁溶液25mL/L.
200mmol/L 氢氧化铁溶液:称取 16.23g FeCl3·6H2O溶于666mL去离子水中,待完全溶解后使用5mol/L NaOH溶液调节pH至7.0±0.5,最后用去离子水反复洗涤沉淀并定容至300mL,装瓶备用.
培养条件:pH 7.0±0.5,温度35℃,置于厌氧罐(英国Oxoid AnaeroJar公司)培养36h.
1.3 异化Fe(Ⅲ)还原性质
以氢氧化铁为电子受体,厌氧培养菌株50h,间隔取样,测定累积Fe(Ⅱ)浓度,并以此表示菌株LQ25铁还原能力,分析菌株LQ25异化铁还原性质.
1.4 电子穿梭体
外源核黄素:设置核黄素浓度梯度为0、20、40、80、100、120、140mg/L,菌株LQ25分别接种于上述含不同浓度电子穿梭体的培养液中,3组平行样.厌氧培养24h后,测定累积Fe(Ⅱ)浓度,分析外源电子穿梭体对异化铁还原细菌LQ25铁还原性质的影响.
内源核黄素:核黄素避光取样,7600g离心15min,用0.22µm滤膜过滤.间隔时间取样,分别测定菌体密度A600和核黄素分泌量,分析菌体分泌核黄素的规律.
1.5 测定方法
菌株生长测定:分光光度计测定菌液A600,以此值表示菌株生长状况.
Fe(Ⅱ)浓度测定:采用菲洛嗪(Ferrozine)分光光度法测定[22].取0.1mL培养后菌液的上清液,加入到5.0mL菲洛嗪溶液(0.4g菲洛嗪、4.766g 4-羟乙基哌嗪乙磺酸(HEPES)溶于400mL蒸馏水)中,振荡15s,静置30min使其显色完全,分光光度计测定A562.
核黄素含量的测定:采用核黄素荧光分光光度法测定[23].使用日立F-7100型荧光分光光度计测定样品中核黄素在发射波长处的相对荧光强度.首先配制2.5µg/mL的核黄素标准品,用0.22µm滤膜过滤后避光备用,然后扫描标准品的激发光谱,并从中找出吸收波长作为激发波长;设置仪器激发波长,扫描标准品的发射光谱,从中找出吸收最强时对应的波长作为发射波长;设置激发波长后,在460~600nm的范围内测定样品在发射波长处的荧光强度.利用相对荧光强度表示核黄素的含量.首先直接测定样品在发射波长处的荧光强度,记为EM1;接着在样品中添加0.1mL 20%连二亚硫酸钠溶液,再次测定样品在发射波长处的荧光强度,记为EM2;最终样品发射波长的相对荧光强度为EM=EM1-EM2.
1.6 数据处理
所有实验均设置3个平行样,数据表示为“平均值±标准差”;使用t检验对实验组与对照组之间差异进行显著性分析,*表示有显著差异(P<0.05),**表示有极显著差异(P<0.01).
2 结果与讨论
2.1 外源核黄素对菌株LQ25异化铁还原的影响
不同质量浓度的外源核黄素(VB2)对菌株LQ25异化铁还原的影响如图1所示.在设置的质量浓度范围内,核黄素的添加均能促进菌株LQ25的Fe(Ⅲ)还原能力.与对照组(无核黄素添加)相比,实验组的核黄素质量浓度为20mg/L时,菌株LQ25的Fe(Ⅲ)还原能力无明显提高(P>0.05);核黄素质量浓度为40mg/L时,菌株LQ25的Fe(Ⅲ)还原能力显著提高(P<0.05);核黄素质量浓度在80~120mg/L的范围内,菌株LQ25的Fe(Ⅲ)还原能力被极显著提高(P<0.01);核黄素质量浓度为140mg/L时,菌株LQ25的Fe(Ⅲ)还原能力无明显提高(P>0.05).其中当培养基中核黄素质量浓度为100mg/L时,菌株LQ25还原Fe(Ⅲ)的量达到最高,累积Fe(Ⅱ)浓度为(7.73±0.05)mmol/L,当培养基中的核黄素质量浓度高于100mg/L时,菌株LQ25还原Fe(Ⅲ)的量又会降低.
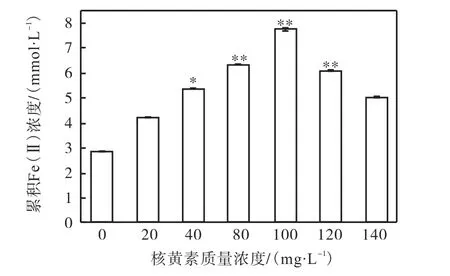
图1 不同浓度的外源核黄素(VB2)对菌株LQ25异化铁还原的影响Fig. 1 Effect of different concentrations of exogenous riboflavin(VB2)on dissimilation iron reduction of strain LQ25
Fuller等[24]研究发现铁还原混合菌群在添加核黄素的培养条件下,其Fe(Ⅱ)浓度比空白组的有所增加,从而推测核黄素可能对胞外Fe(Ⅲ)还原作用较大.You等[25]在接种巨大芽胞杆菌(Bacillus megaterium)LLD-1的微生物燃料细胞中加入100nmol/L核黄素后,输出电压和输出电流分别提高了2.8倍和3.7倍,从而证明菌株LLD-1培养液中的核黄素可以作为电子穿梭物,加强菌株LLD-1向电极的电子传递.Yang等[16]为了验证核黄素对噬甲基菌属(Methylophilussp.)培养过程中电子传递作用的影响,比较了添加核黄素组与不加核黄素组的Fe(Ⅲ)还原率,结果显示前者的Fe(Ⅲ)还原率提高了33%,这表明Fe(Ⅱ)的增加是由于核黄素促进了胞外电子传递.Jin等[15]发现地衣芽胞杆菌(Bacillus licheniformis)和S. oneidensis的混合培养对于金属腐蚀具有协同作用,后经研究证实是由于菌株S. oneidensis分泌的电子穿梭体核黄素提高了B. licheniformis的细胞外电子传递效率.Moradian等[17]在Cystobasidium slooffiaeJSUX1的培养过程中添加核黄素,其最高输出电流约为不添加核黄素的3倍,表明核黄素能促进电子传递过程.
2.2 菌株LQ25分泌核黄素的含量
经测定,激发波长为425nm.核黄素在520nm处有荧光发射,但环境中的血红素可将其猝灭.Miyuki等[23]通过监测此处的荧光发射强度的变化,探测核黄素与蛋白复合物OmcZ的结合情况,结果表明荧光分光光度法可以鉴定出微摩尔级别的核黄素浓度.在本实验中,外源核黄素标准品和内源核黄素样品的荧光发射峰对比如图2所示.
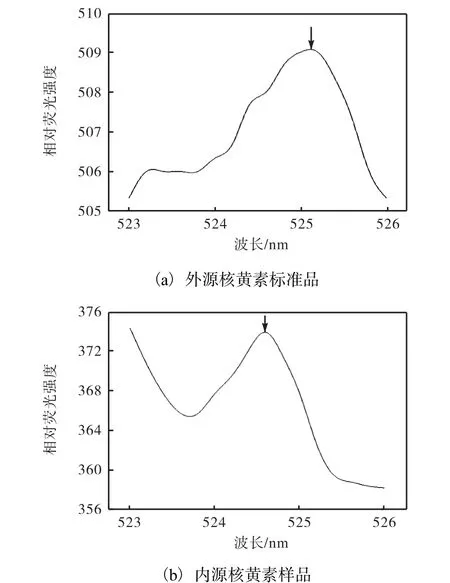
图2 外源核黄素标准品和内源核黄素样品荧光发射峰对比Fig. 2 Comparison of fluorescence emission peak between exogenous riboflavin standard and endogenous riboflavin sample
外源核黄素标准品的荧光发射峰大约在525nm处,内源核黄素样品的荧光发射峰在524.5nm左右.此外,实验同时测定了无生物培养基中的核黄素荧光发射峰,结果显示培养基不含有核黄素.这表明培养液中核黄素荧光发射峰是由于菌株LQ25分泌产生的.由此通过测定525nm处的荧光发射强度,表示菌株培养过程中产生的核黄素含量.
2.3 不同培养时间下核黄素分泌量变化
菌株LQ25生长与核黄素分泌量随时间的变化如图3所示.培养0~10h为菌株生长迟缓期,最大菌体密度A600为0.26±0.01,在此期间未测出核黄素的荧光发射峰;培养10~15h为菌株对数生长期,最大菌体密度A600为1.32±0.06,核黄素的相对荧光强度最高可达11.30±2.00;培养15~35h为菌株生长稳定期,最大菌体密度A600为1.41±0.02,核黄素的相对荧光强度在培养20h时达到最高,为49.50±3.92;培养35h后为菌体的衰退期,菌体密度A600降低,核黄素的相对荧光强度逐渐降低并于40h后荧光发射峰消失.
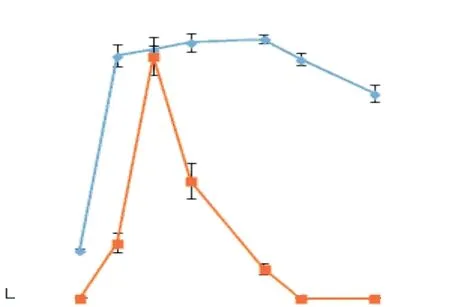
图3 菌株LQ25生长与核黄素分泌随时间的变化Fig. 3 Growth and secretion curve of riboflavin of strain LQ25
由此可见,菌体生长状态和核黄素分泌关系密切,菌株LQ25在旺盛生长时期分泌核黄素,这有利于电子传递合成ATP用于自身生长,随着菌体生长减缓,电子传递过程减弱,分泌核黄素也减少.Baron等[26]发现突变体Shewanella oneidensisMR-1(保留编码核黄素基因)在无外源核黄素的培养条件下仍能检测到存在电子转移,然后使用循环伏安法确定核黄素添加前后的菌液电位均在同一电位处,以上结果表明这种电子转移的产生是由菌株自身分泌核黄素导致的.周雨行等[27]研究菌株Shewanella oneidensis的氧化还原特征峰强度变化,其峰强度经历了由弱增强再减弱的过程,这表明微生物的生长导致大量核黄素产生,电子传递速率加快;当培养基中的物质逐渐耗尽时,微生物的生长活性减弱并进入生长后期,电子传递过程被削弱,因此氧化还原峰强度开始减小.Song等[28]比较Pachysolen tannophilus的生长和核黄素分泌随时间变化的关系,认为菌株P. tannophilus主要在对数生长期分泌核黄素,这与本实验菌株LQ25的分泌规律相似.Jain等[29]发现菌株Shewanella loihicaPV-4在一定时间内,随着孵育时间的增加,培养液中核黄素的相对峰值强度呈现逐渐增加的趋势.Tian等[30]研究发现微生物燃料电池中的蜡样芽胞杆菌(Bacillus cereus)DIF1和赤红球菌(Rhodococcus ruber)DIF2在生长到对数期之前,核黄素浓度不断增加,对数生长期后核黄素浓度又会降低.
大多数细菌可自行分泌核黄素,并且能将核黄素转化为FMN和黄素腺嘌呤二核苷酸(FAD),FMN和核黄素可被分泌到胞外,作为电子穿梭体发挥功能,其浓度高低表征着细胞的生长状态,而FAD主要存在于胞内,可作为细胞裂解的指标[30].由菌株LQ25的生长曲线可知,在培养的前20h,菌株LQ25大量分泌的核黄素用于胞外电子传递以供给生长,此后由于培养基中营养物质等的消耗及生长环境中有害分泌物的积累,导致菌株逐渐走向衰亡,因此推测菌株LQ25分泌的核黄素在培养20h后逐渐分解.此外,实验未采用避光的黑暗培养,长时间的光照也会促使菌株LQ25分泌的核黄素降解[26].
2.4 异化铁培养条件下核黄素分泌量变化
以氢氧化铁为电子受体,对菌株LQ25核黄素分泌量的影响进行研究,结果如图4所示.
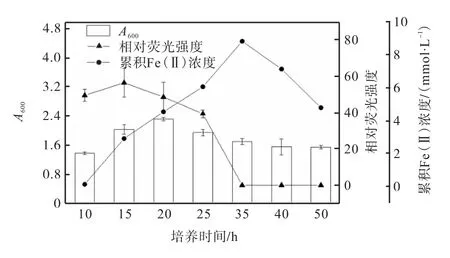
图4 菌株LQ25生长、核黄素分泌及累积Fe(Ⅱ)浓度随时间的变化Fig. 4 Changes of growth,secretion of riboflavin and Fe(Ⅱ) concentration of strain LQ25 with time
由图4可知:培养前10h,菌株LQ25经历快速繁殖的对数生长期,在此阶段核黄素分泌逐渐增加;10h之后进入稳定生长期,20h时菌体密度A600达到最大,为2.32±0.05,15h时培养液中核黄素的相对荧光强度达到最高,为56.23±7.93;20h后菌株开始衰退,菌体密度A600降低,核黄素的相对荧光强度逐渐降低并于35h后荧光发射峰消失.菌株LQ25在培养过程中分泌积累的核黄素呈现逐渐增强再减弱的变化.在对照组(无氢氧化铁添加)条件下培养20h时,菌株LQ25中核黄素含量才达到峰值,20~25h降低51.43%,25~30h降低36.43%;实验组条件下,菌株LQ25分泌积累的核黄素最高值提前至15h,15~20h降低13.98%,20~25h降低16.32%,25~35h降低39.41%.
对比实验组和对照组的核黄素相对荧光强度最高值,实验组的是对照组的1.14倍,实验组中氢氧化铁可能作为电子受体促进了菌体分泌核黄素.Li等[22]对菌株Anoxybacter fermentansDY22613T培养液的高效液相色谱分析发现,核黄素确实在对数期产生,添加氢氧化铁组相比不添加组发酵产生的核黄素浓度高 2倍.Liu等[31]的研究结果显示,在3.8µmol/L苯存在下,微生物不仅保持了完整的细胞形态,并且60h还原Fe(Ⅲ)形成Fe(Ⅱ)的量是无苯条件下的2倍,微生物对Fe(Ⅲ)还原的促进归因于苯诱导的细胞膜通透性的增加,促进了胞外电子传递和核黄素作为电子穿梭因子或辅因子的分泌和释放.
菌株LQ25还原Fe(Ⅲ)并不是与生长同时进行的,培养前10h生长旺盛,但几乎不进行Fe(Ⅲ)还原;培养10~35h时,菌株LQ25大量进行Fe(Ⅲ)还原,35h时培养液中累积的Fe(Ⅱ)浓度达到最高值(8.79±0.01)mmol/L;35h后培养液中累积的Fe(Ⅱ)浓度逐渐减少,由此可见Fe(Ⅲ)的还原过程主要是在菌株生长的后期.
相比对照组(无氢氧化铁添加),菌株LQ25在35h达到生长高峰,氢氧化铁的加入使得菌株LQ25在20h就达到菌体密度最大值,且此刻菌体密度是未添加氢氧化铁的3.27倍.宋文杰等[32]在腐败希瓦氏菌(Shewanella putrefaciens)的培养基中加入柠檬酸铁,实验结果显示Fe(Ⅱ)浓度与其生物活性存在极显著的正相关关系,表明Fe(Ⅲ)还原与微生物的生长耦合在一起.刘洪艳等[33]发现在菌株Klebsiellasp. KB52的生长过程中,无论添加不可溶性电子受体氢氧化铁还是添加可溶性电子受体柠檬酸铁,菌株KB52的细胞生长均高于未添加电子受体的对照组.
菌体分泌核黄素和还原Fe(Ⅲ)密切相关,核黄素的分泌能达到最大积累量主要是在菌体培养前期,还原Fe(Ⅲ)这一过程主要是在培养后期进行.这可能是由于核黄素作为电子穿梭体,将菌体通过分解葡萄糖等营养物质获得的电子从胞内转移至胞外,转移到胞外的电子可用于不溶性氢氧化铁的还原,从而使得培养基中会在菌体培养的后期大量积累Fe(Ⅱ).Dereven’kov等[34]在水钴胺素(H2OCbl)和NADH的混合物中添加的核黄素显著加速了Cbl(Ⅱ)的积累,并且还原速率与核黄素浓度呈线性关系,证明了核黄素对NADH向水合钴胺电子转移的催化作用.周雨行等[27]在探究S. oneidensis的铁硫还原过程时发现,核黄素的加入将菌株的铁硫转化能力提高了3倍,从而推测核黄素是作为电子穿梭体参与到菌株的电子传递过程中,并将电子从乙酸盐呈递给单质硫和黄钾铁矾.Zhou等[35]在S. oneidensisMR-1降解磺胺甲恶唑(SMX)的过程中加入了不同浓度的核黄素,其最大降解率能达到95.3%,从核黄素介导的SMX降解和铁还原的总体性能看,SMX的降解率随着铁还原的加强而逐渐增加.
2.5 外源核黄素对菌株LQ25异化铁还原性质分析
外源核黄素对菌株LQ25异化铁还原性质分析结果如图5所示.培养20h,菌株LQ25的菌体密度相比对照组(无氢氧化铁添加)的菌体密度无显著变化(P>0.05);培养25h,菌株LQ25累积Fe(Ⅱ)浓度为(9.05±0.02)mmol/L,并且随着培养时间的延长,菌株LQ25累积Fe(Ⅱ)浓度还将持续上升.
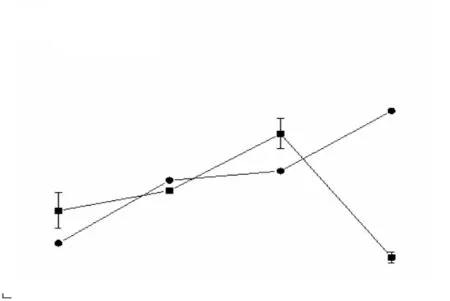
图5 外源核黄素对菌株LQ25异化铁还原性质分析Fig. 5 Dissimilated iron reduction properties of strain LQ25 by riboflavin
外源核黄素对菌株LQ25的生长几乎无影响,但能促进菌株LQ25进行异化铁还原.Yarlagadda等[36]也证明外源电子穿梭体对菌株Clostridiumsp. BC1的生长几乎没有影响.List等[37]分析不同来源的电子穿梭体对菌株丙酮丁醇梭菌(Clostridium acetobutylicum)的异化铁还原性的影响,结果表明外源蒽醌-2-磺酸(AQS)和内源核黄素均能增强菌株的异化铁还原能力,这与本实验的研究结果相似.
3 结 语
(1)外源核黄素可以促进菌株LQ25的异化铁还原能力,当核黄素质量浓度为100mg/L时,异化铁还原能力最高,相比对照组提高了63.26%.
(2)在设定的培养时间内,通过荧光分光光度法测定核黄素,菌株LQ25具有分泌核黄素的能力,最高相对荧光强度可达56.23±7.93.
(3)菌株LQ25核黄素分泌量受到培养时间、Fe(Ⅲ)浓度等因素的影响.目前对呼吸型异化铁还原细菌胞外电子传递机制的研究较为深入,相比之下,发酵型异化铁还原细菌胞外电子传递机制还有待进一步的揭示.本研究结果为丰富发酵型异化铁还原细菌胞外电子传递机制提供了理论支持.
