阿尔茨海默病药物研发进展
2022-03-02滕玉鸥曹梦麟刘夫锋
滕玉鸥,曹梦麟,郁 彭,刘夫锋
(天津科技大学生物工程学院,天津300457)
阿尔茨海默病(Alzheimer’s disease,AD)是目前最常见的老年期痴呆之一,是一种由于自身中枢神经系统变性所致的慢性神经退行性疾病[1].
目前,AD患者约占全部痴呆患者的60%~80%,已成为严重的社会问题[2-3].据统计[3-4],全球AD患者已超过5000万人,预计2050年将突破1.52亿人,其中65岁以上患者将达到1380万人.当前,中国AD患者已超过1000万人,是新发病例全球增速最快的国家之一[5-6].治疗AD的成本负担与流行程度与日俱增,仅2020年美国AD患者的家人和朋友提供了约153亿小时的无偿护理,相当于贡献了2570亿美元[3].到2050年预计总费用将达到1.1兆亿美元(不包括上述无偿护理费用),患者、家庭、社会和医疗机构都面临着巨大压力[3].
1 AD发病机制假说
科学家提出多种广为认可的AD发病机制假说,如Aβ级联假说、胆碱能假说、Tau蛋白异常磷酸化假说、神经炎症假说、金属离子紊乱假说等[7-9],但是其致病机理仍无法明确,目前该疾病仍无法治愈,成为医学界一大难题.
1.1 Aβ级联假说
Aβ级联假说是一项得到实验结果支持的重要假说,该假说指出AD的病变过程受到了淀粉样蛋白前体和β-淀粉样蛋白(Aβ)之间相互作用的影响[10].β-分泌酶剪切产生sAPPβ蛋白并被释放到胞外,而γ-分泌酶的剪切则产生了Aβ多肽和β-淀粉样蛋白前体蛋白胞内结构域(amyloid precursor protein intracellular domain,AICD).Aβ多肽会被释放到胞外并在脑内积累,它们的过度积累造成了Aβ老年斑产生,这是神经元损伤或死亡的重要原因.目前,针对Aβ级联假说所开发的药物包括β-淀粉样蛋白聚集抑制剂、γ-分泌酶和β-分泌酶的抑制剂等,但是相关药物(如γ-分泌酶抑制剂Semagacestat、与可溶性Aβ蛋白特异性结合Solanezumab等)的研发并不顺利,副作用和不良反应较多,主要停留在临床Ⅱ期和临床Ⅲ期[11-12].
1.2 胆碱能假说
胆碱能假说是最早试图解释AD发病机制的假说,认为AD的产生是由于AD患者脑内的神经递质存在缺陷,导致胆碱能神经元受到损伤.该假说认为乙酰胆碱酯酶(AChE)和乙酰胆碱转移酶(ChAT)的活性下降是乙酰胆碱(Ach)浓度下降、胆碱能活性下降的主要原因.目前美国食品药品监督管理局(Food and Drug Administration,FDA)批准上市的抗AD药物中,包括他克林[13]、多奈哌齐[14]、加兰他敏[15]和卡巴拉汀[16]等都与该假说密切相关.他克林是最早问世的乙酰胆碱酯酶抑制剂,但严重的肝毒性使其只能作为参考药物,之后的多奈哌齐、利斯的明和加兰他敏在保持有效性和安全性的同时,对轻度和中度AD患者具有疗效.但是,由于这些与胆碱能假说相关的抗AD药物的疗效并不显著,所以该假说仍存在较大争议.
1.3 Tau蛋白异常磷酸化假说
Tau蛋白是一种微管相关蛋白.在正常情况下,Tau蛋白主要集中于神经元轴突中.由于正常情况下可溶性的Tau蛋白可与微管蛋白结合促进微管的稳定,而在AD患者脑中,高度磷酸化的Tau蛋白会由可溶转变为不可溶的同时高度聚集.这不但会使其自身微管结构受损失,丧失其正常的功能作用,而且会导致突触蛋白失去功能和神经退行性病变引起神经纤维缠结(NFTs)[17].Tau蛋白的磷酸化与AD患者病程中认知功能缺失密切相关[18].在以Tau蛋白为靶点开发候选药物的研究方向主要包括抑制Tau蛋白过度磷酸化、抑制Tau蛋白聚集和促进Tau蛋白分解等[9],但是对于Tau蛋白相关药物的开发仍处于早期阶段.目前,在研的Tau蛋白抑制剂包括Semorine-mab、Gosuranemab、Zagotenemab等,绝大多数仍处于临床Ⅱ期,后续研究进展仍有待观察.
1.4 神经炎症假说
由于在AD患者大脑功能的检测中存在炎症因子、急性期反应物等诸多炎症指标,证明炎症与AD的病程发展密切相关,而神经炎症主要是由小胶质细胞介导的.小胶质细胞在免疫防御中发挥巨噬细胞的作用,脑内β-淀粉样蛋白的聚集可能会引起小胶质细胞过度激活,导致促炎因子大量释放促进AD的发展.因此,阻断小胶质细胞的炎症通路或可作为抗AD药物开发的思路.
1.5 金属离子紊乱假说
与正常人群脑内金属离子浓度相比,AD患者脑内淀粉样斑块中的金属离子浓度为正常大脑的5倍左右.AD患者脑内高浓度的铜离子、铁离子和锌离子等金属离子会引起氧化应激作用,同时与Aβ多肽聚合形成更具毒性的Aβ寡聚体[19-20].其中Aβ-Cu2+复合物会催化产生氧簇自由基造成氧化损伤严重,破坏细胞功能,而Aβ寡聚体与锌离子、铁离子的结合在加剧氧化应激过程的同时,也会导致神经元受损,最终加剧AD进程.金属离子紊乱假说是比较新的假说,所以可能成为抗AD药物开发的新方向.
2 上市药物
目前上市的抗AD药物包括4种,胆碱酯酶抑制剂、NMDA受体拮抗剂、Aβ抑制剂以及肠道菌群调节剂,这些药物可以通过抑制乙酰胆碱活性促进或恢复胆碱功能,对于初期和中期AD患者起治疗作用,维持患者认知状态[21-22].但是,这些药物并不能改善AD患者病情发展,只能发挥延迟作用,而且基本都具有严重副作用,如他克林具有肝毒性,卡巴拉汀有恶心、呕吐等胃肠道不良反应等[23].并且在治疗效果上,这些药物也仅仅能延缓疾病进展以及改善症状,并不能够根治疾病.这显然亟需开发更有效的药物.
从2003年开始,AD一直没有新的药物获批上市,直到2019年和2021年,才有新的药物获批,分别是Aducanumab[24]和GV-971[25].
2019年11月2日我国上市了由中国海洋大学、中科院上海药物所与上海绿谷自主研发的抗AD药物GV-971(甘露特钠胶囊,商品名“九期一”).它是从海藻中获得的甘露寡糖二酸,是中国原创、全球首个靶向脑-肠轴的AD治疗新药,通过重塑肠道菌群平衡,从而改善认知功能障碍,应用于轻度至中度AD治疗.2020年4月,该药获批在美国进入临床试验.这款药物也一定程度上填补了市场的空白.
GV-971研究者通过表面等离子共振(SPR)芯片筛选方法获得国际首个靶向Aβ的寡糖分子971.通过体内研究表明971能够明显改善转基因小鼠的学习记忆能力以及日常生活能力,可通过多环节抑制Aβ的神经细胞毒性.在研究过程中,研究者使用AD小鼠模型,通过粪便移植实验证明了肠道微生物群的失调与AD发病机理中的神经炎症存在着某种潜在的机制联系[26].通过对小鼠的菌群变化和体内相关指标的分析发现,在AD进展过程中,肠道菌群组成的改变会导致苯丙氨酸和异亮氨酸的外周积累,进而刺激促炎性Th1细胞的分化和增殖[26].而脑浸润的外周血Th1免疫细胞与M1小胶质细胞激活相关,会促成神经炎症[27].GV-971可恢复正常的微生物特征,降低苯丙氨酸和异亮氨酸的浓度,从而减少与Th1细胞相关的神经发炎.因此,GV-971的出现揭示了肠道菌群失调促进神经炎症在AD进展中的作用,提出了通过重塑肠道菌群平衡,抑制肠道菌群特定代谢产物的异常增多,减少外周及中枢炎症,降低Aβ沉积和Tau蛋白过度磷酸化,为抗AD药物的研发提供新思路[27].
事实上,在过去一段时间内,GV-971这款新药一直伴随着学术界和业界的争议.鉴于AD疗法的紧缺性和病患的需求,国家药监局批准了GV-971的上市申请,但在这款药物上市后,仍然被要求继续进行药理机制方面的研究,继续进行长期安全性有效性研究,并完善寡糖的分析方法.如果后续数据不理想,可能意味着这款药物会被撤回.
在2021年6月7日,美国FDA批准了渤健与卫材公司联合开发的Aducanumab上市.这是近20年间,美国FDA针对AD唯一批准上市的新药.它是一款基于β-淀粉样蛋白靶点研发的人类单克隆抗体.它能够有选择性地与AD患者大脑中的β-淀粉样蛋白沉积结合,然后通过激活免疫系统,将沉积蛋白清理出大脑.患者使用Aducanumab后,能显著改善其认知能力[28-29].另外,之前基于β-淀粉样蛋白的在研药物基本都失败于临床试验中,这导致β-淀粉样蛋白假说一直备受争议.Aducanumab的成功也进一步证实β-淀粉样蛋白沉积假说的正确性.虽然Aducanumab在临床试验中历经坎坷,但是其成功获批上市,给正在进行AD药物研发的公司带来希望,坚定研发信心.
总结目前抗AD的上市药物见表1.
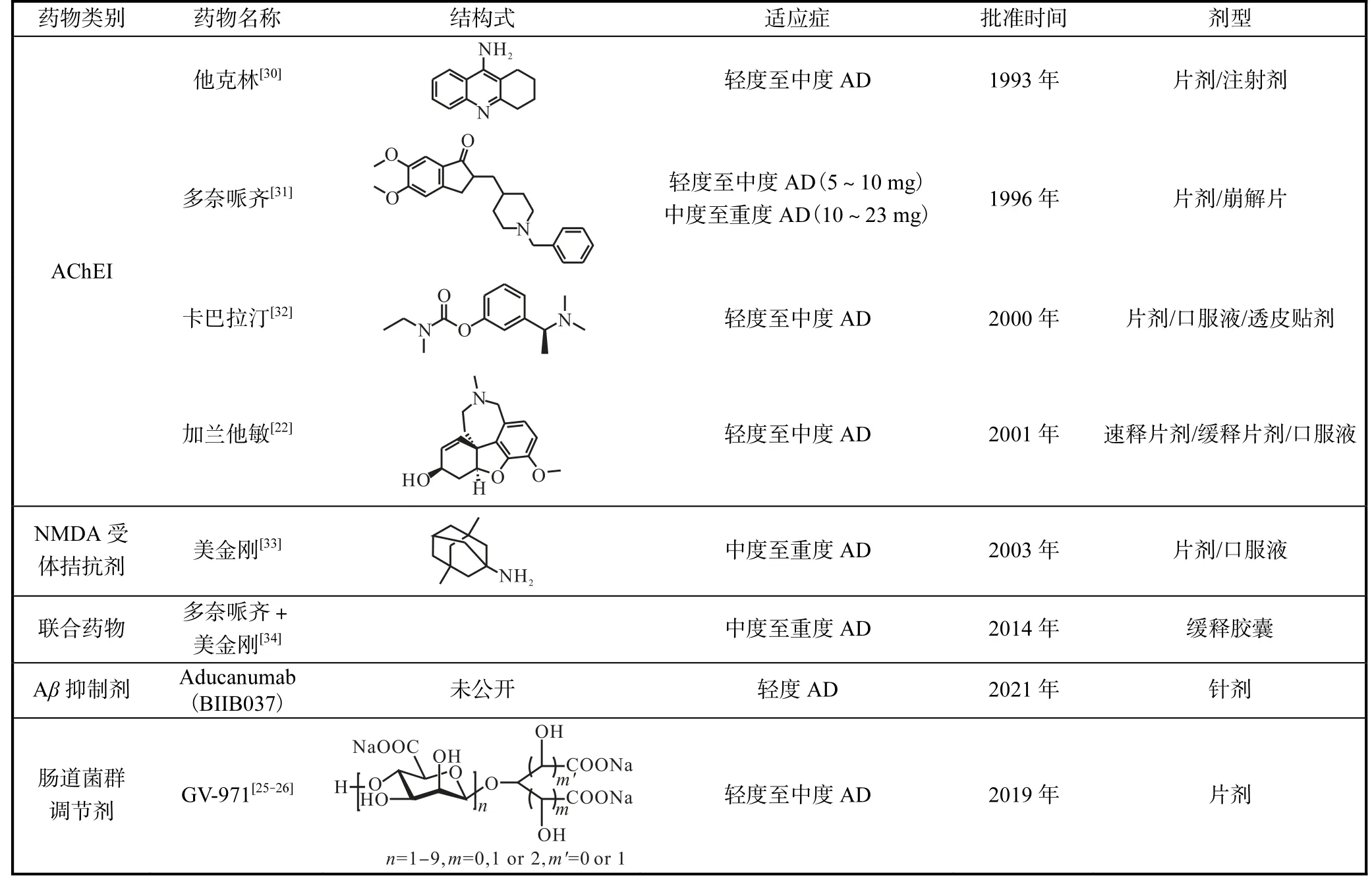
表1 抗AD的上市药物Tab. 1 Anti-AD drugs on the market
3 失败药物
许多潜在的治疗AD药物在开发过程或者后期临床试验中出现疗效或者安全性问题,药物研发不得不宣告失败[10](表2),另外还有部分在研药物其研发进展停滞不前,处于“休眠期”.关于治疗AD药物的研发,其成功率接近零.研究[25-37]显示,全世界约有120种AD药物正在开发中,而恶性肿瘤药物为6833种,糖尿病为433种;AD临床试验的失败率高达99.6%,而癌症药物的失败率为92%.而每一种药物的研发,在时间上为10~15年,在金钱上花费近30亿美元.本世纪以来,各大制药企为AD市场投入了约2000多亿美元,但仅2018年至2019年初,就有8种药物因为疗效差或毒性高,Ⅲ期临床试验均宣布失败.
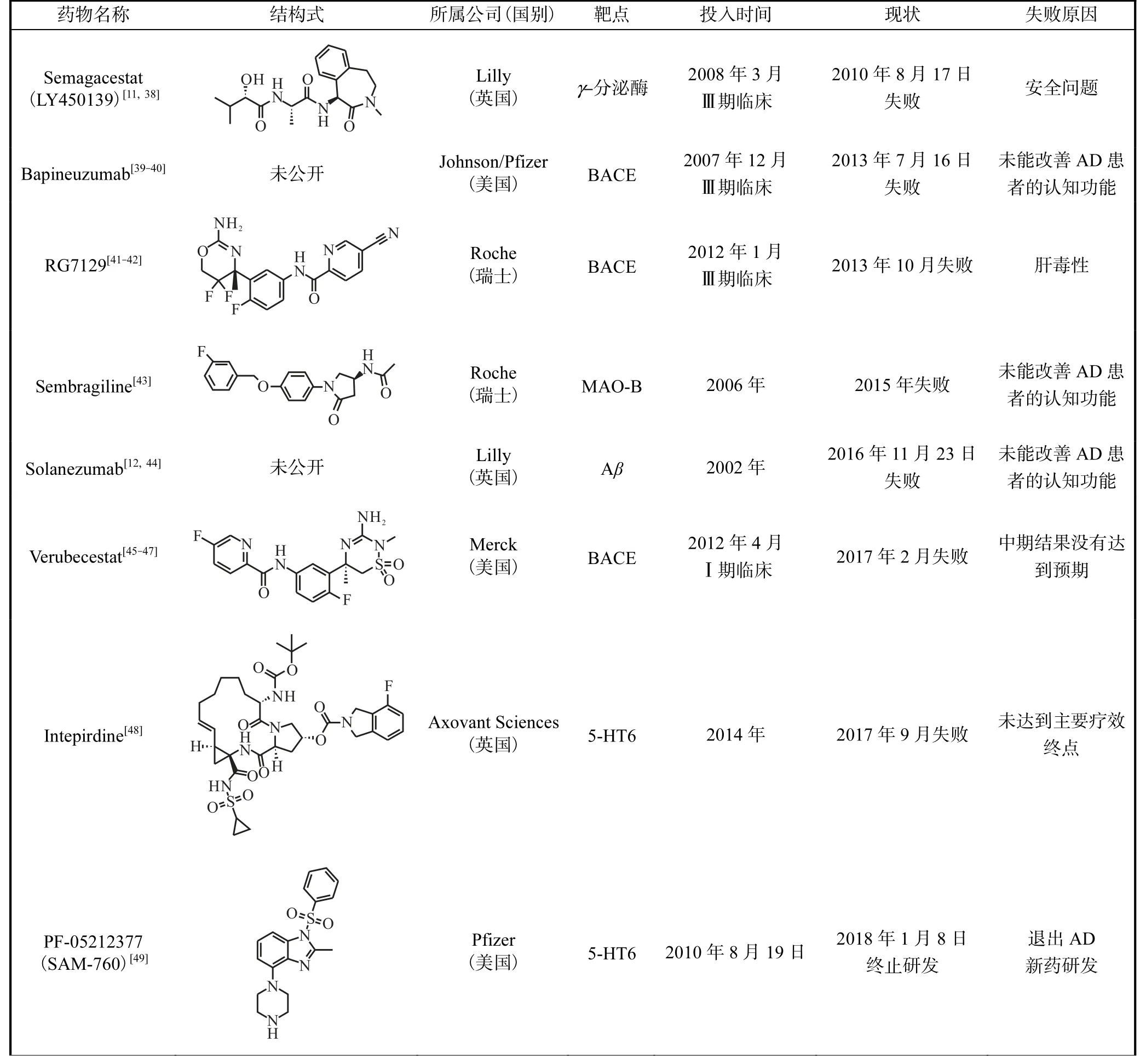
表2 部分研发失败的AD药物Tab. 2 Some AD drug candidates that have been terminated
针对治疗AD药物的研发领域,由于AD的生物学定义不明确、生物标志物有限,并且研发试验时间长、费用高等原因,大型药企频频受挫,对其打击重大.世界上几家制药巨头公司已纷纷中止几项大型AD症Ⅲ期临床试验,例如美国辉瑞公司在2018年就宣布退出AD症研发领域.在全球医药界,AD药物的研发始终是一大难题.
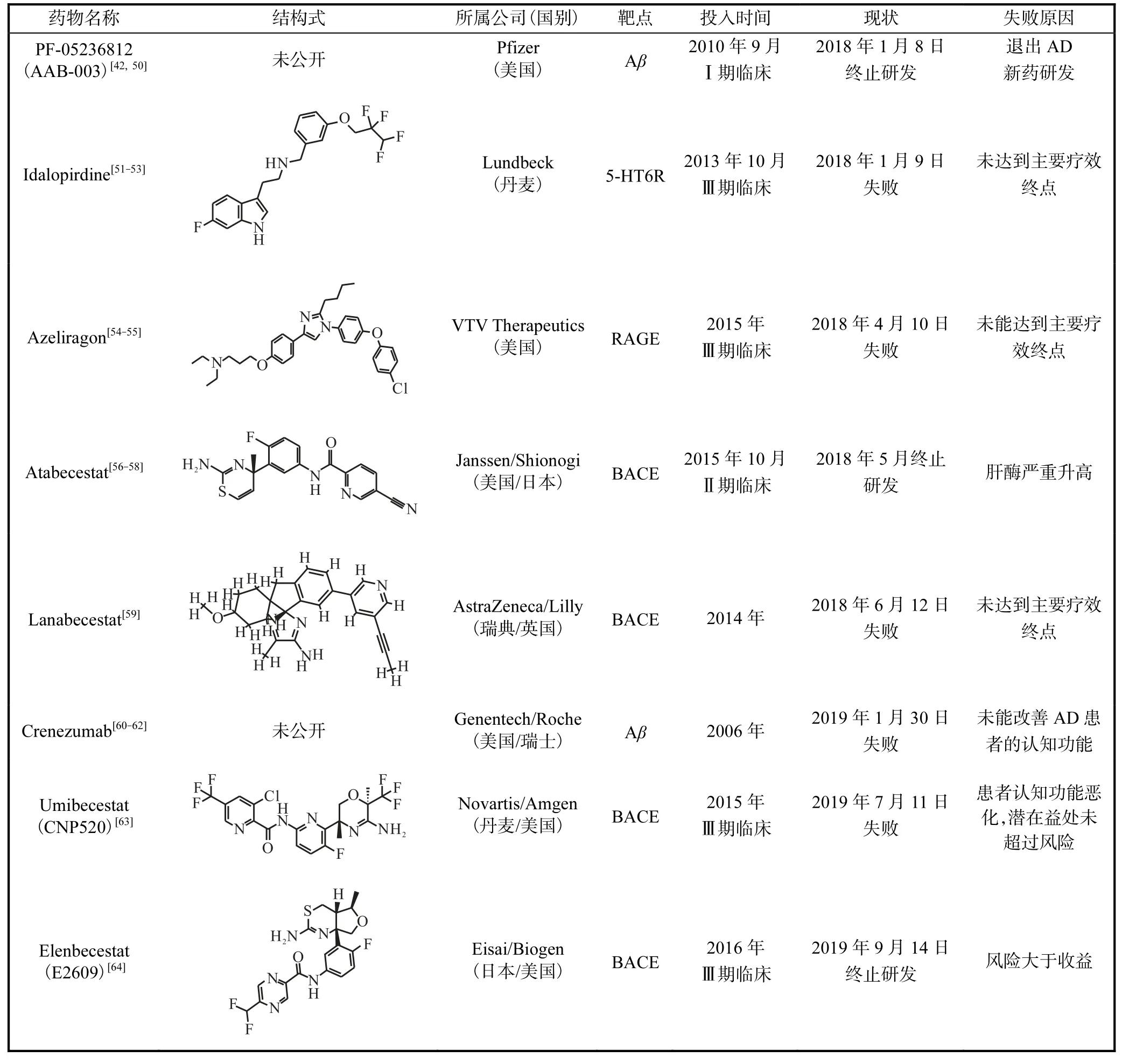
续表
4 在研药物
根据“创新药周期理论”,AD药物将是下一个医药大市场,尽管目前AD药物的研发可谓举步维艰,但依然有很多公司仍愿意屡败屡战,未来癌症如果得到有效控制,创新药市场的一大盛宴将是AD.因此,为了研发治疗AD药物,全球制药企业和科研人员仍在不懈努力,其进展在各界均备受关注[65].
尽管2019年有大规模的Ⅱ/Ⅲ期、Ⅲ期临床试验中止,但是截至2021年1月,在全球临床试验数据库clinicaltrials.gov搜索,仍有232项尚未招募/正在招募/正在进行的AD临床试验.在研的AD药物有126种[36,66-67],其中处于Ⅲ期临床试验中的有28种,Ⅱ期临床试验中的有74种,Ⅰ期临床试验中的有24种[60-67].目前有21种药物披露了临床试验数据(表3).综上所述,与2020年的121种相比,增加了5种(Ⅲ期减少1个药剂,Ⅱ期增加9个药剂,Ⅰ期减少3个药剂),且针对Aβ或Tau蛋白以外的在研药物数量有所增加.自2020年以来,Ⅲ期临床试验有5个预防试验,Ⅱ期临床试验有2个预防试验;在过去的6年中,Ⅲ期临床试验的数量保持不变,而Ⅱ期预防试验的数量则有所不同(0~4次)[67].因此,AD药物研发的势头仍然迅猛.
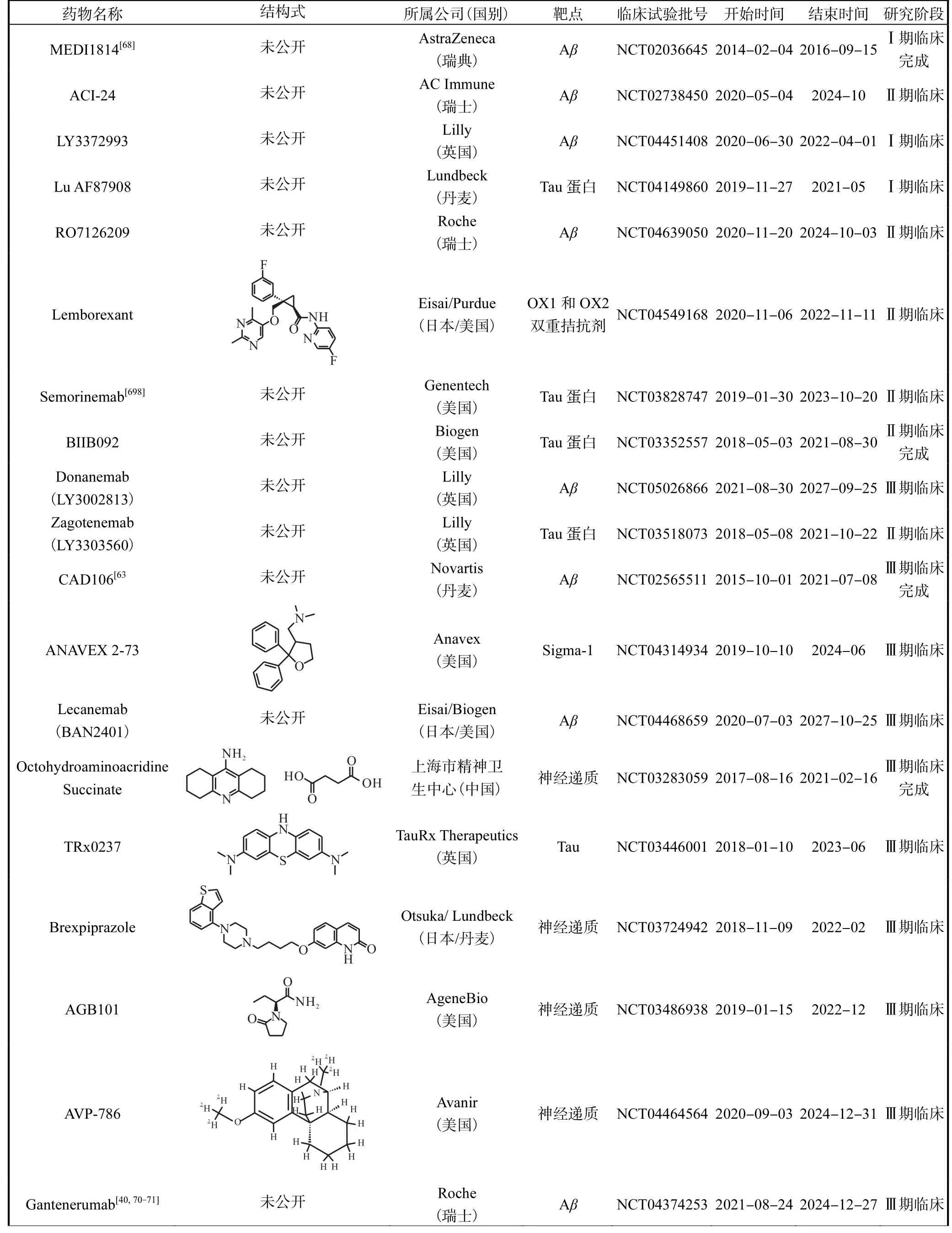
表3 部分正在临床研究的AD药物Tab. 3 Some AD drug candidates under clinical study

续表
5 抗AD新药的研发展望
(1)高效生物标志物的发现.目前医药公司的研发重点为症状明显的临床治疗阶段,对于预防研究相对较少.当AD患者出现早期临床症状时,体内病理现象早已出现,单纯的药物治疗无法根治,因此寻找有效的AD生物标志物是早期发现AD患者的前提,也是治疗AD的关键.
(2)新发病机制的探究.过去百年间,由于AD发病机制尚不明确,虽有几种药物被FDA获批,但其不能改变疾病的进展,并且能引起严重的副作用,导致AD治疗药物的研发艰难而缓慢.直到最近GV-971的成功上市,说明了AD的发生可能与葡萄糖代谢、慢性炎症反应和脑-肠轴等方面息息相关,提供新的思路拓展AD研究的新领域,也意味着AD新发病机制的探究迫在眉睫.
(3)新研发思路的探究.固有无序蛋白(IDP)是一种结构会随着微环境的改变而变化的蛋白质.目前,Graffinity制药公司发现了一些能够抑制在AD中发挥重要作用的无序蛋白的小分子.因此,IDP有望成为抗AD新药研发新靶点.
随着科技发展,CRISPR-Cas9编辑技术不仅可以治疗基因缺陷方面的疾病(例如通过去掉编码AD疾病相关蛋白的基因,中止致病蛋白的合成),而且可以成功培育理想的AD动物模型,精准模拟人类神经退行性疾病,为治疗老年痴呆等疾病提供稳定、可靠的动物模型,推动药物筛选和治疗方案制定.
随着医学、生物学等基础研究的不断发展,人们在不断对AD进行探索,先前失败的经验也为未来药物研发提供了新的线索,在此基础上不断调整药物研发方向并转变思路,AD药物研发仍充满希望.
