老年房颤患者前循环急性缺血性脑卒中机械取栓预后分析
2022-03-02焦锦程郦明芳程弘毅贾振宇施海彬陈明龙
焦锦程,郦明芳,刘 圣,崔 畅,程弘毅,贾振宇,施海彬,陈明龙*
1南京医科大学第一附属医院心血管内科,2放射介入科,江苏 南京 210029
心房颤动(atrial fibrillation,AF)是心源性脑栓塞最常见的原因,约占急性缺血性卒中(acute isch⁃emic stroke,AIS)的20%~30%[1]。AIS的患者中有1/3是年龄≥80 岁的老年患者[2]。AF 的发生率及AF 相关脑卒中的发生风险随年龄的增加而显著增加,尤其是≥80岁的老年患者,因此在AIS合并AF的患者中,老年人比例很高[3]。
2015 年,随着针对AIS 机械取栓(mechanical thrombectomy,MT)治疗的随机对照研究[4]相继发表,MT 已经成了发病6 h 内前循环大血管闭塞(large vessel occlusion,LVO)的一线治疗方法。近年来,对时间窗在6~24 h内且符合DAWN[5]或DEFUSE 3[6]入排标准的患者,也推荐行机械取栓治疗。然而,5项RCT 研究的Meta 分析[7]显示,年龄≥80岁的患者90 d 改良Rankin 量表评分(mRS)明显高于年龄较小的患者。此外,最近研究发现[8],相比保守治疗,老年患者MT 治疗后90 d,临床预后并未得到明显改善,同时术后出血转化风险更高。
AIS合并AF的老年患者因存在合并症多,器官功能下降、耐受性差、静脉溶栓出血风险高等问题,往往治疗手段受限,保守治疗预后差。与此同时,对于≥80 岁合并AF 的AIS 患者,MT 治疗的获益目前尚不明确。
本研究旨在评估AIS合并AF的老年患者MT治疗后的临床结局及其影响预后的相关因素。
1 对象和方法
1.1 对象
这是一项单中心回顾性观察研究。收集了南京医科大学第一附属医院卒中中心2019 年1 月—2021年7月,所有接受MT治疗的AIS患者。所有考虑AIS 的患者都接受了计算机断层扫描血管造影(computed tomography angiography,CTA)检查,明确颅内LVO。2019 年9 月,CTA 被计算机断层血流灌注平扫(computed tomography perfusion,CTP)取代。神经内科和神经介入的医生在对患者基本情况和影像学进行评估后,制定相应的治疗策略。所有入组患者均符合美国心脏协会/美国卒中协会(American Heart Association/American Stroke Associ⁃ation,AHA/ASA)指南[9]中取栓治疗的相关要求。
本研究的排除标准如下:①非AF;②院内卒中;③基线资料丢失或失访;④仅接受血管造影或动脉内溶栓;⑤椎基底动脉闭塞。
本研究得到了南京医科大学第一附属医院医学伦理委员会的批准(2014⁃SR⁃113),所有入组患者均签署了知情同意书。
1.2 方法
1.2.1 MT
所有AIS且有取栓适应证的患者平卧手术床上,消毒、铺巾、局部麻醉,股动脉穿刺,造影评估栓塞部位,导丝越过栓塞部位,评估明确栓塞近端、远端血管情况,使用抽吸导管单纯抽吸或释放Solitaire AB 支架(Medtronic,Irvine,美国)进行1次或多次取栓。每次取栓后评估血流恢复情况,对于原位狭窄重,取栓后仍有残余狭窄的患者,予球囊成形或支架置入,必要时可行动脉内溶栓或导管内注射替罗非班治疗。
1.2.2 临床基线资料收集及评估
收集患者年龄、性别、既往史[AF、高血压、糖尿病、冠状动脉粥样硬化疾病(cornhary atherosclerotic heart disease,CAD)、心力衰竭、卒中或短暂性脑缺血发作(transient Ischemic attack,TIA)、瓣膜性心脏病,以及抗血栓药物使用史]。入院后立即评估并记录患者美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分、Alberta卒中计划早期CT 量表(Alberta stroke program early CT score,ASPECTS)评分和CHA2DS2⁃VASc 评分(变量包括年龄、心力衰竭、高血压、糖尿病、血管疾病、卒中和全身栓塞、性别)。
逐一记录患者发病、入院、股动脉穿刺、血管再开通时间,取栓次数,末次造影血流再通分级,即改良脑梗死溶栓血流分级(modified thrombolysis in ce⁃rebral infarction scale,mTICI)。
采集患者外周血,送检血常规、凝血功能、心肌肌钙蛋白T(c⁃TnT)、心房脑钠肽前体(NT⁃pro⁃BNP)、血清电解质、肝肾功能等。
1.2.3 AF诊断及有效抗凝定义
在本研究中,AF的诊断是基于患者既往房颤病史、入院时记录的心电图或术中心电监护捕捉到的AF发作。此外,对于不明原因栓塞患者(没有AF证据,末次造影无明显狭窄即缺血区供给血管因动脉粥样硬化导致的动脉血管腔狭窄<50%),术后进行1 次或者多次的24~72 h 长程动态心电图监测。非阵发性AF被定义为永久性或持续性AF。服用华法林患者卒中当日的国际标准化比值(INR)≥1.7或卒中发作前48 h内口服新型抗凝药物(NOAC)被认为有效抗凝[10]。
1.2.4 临床预后
所有患者在卒中后90 d,通过门诊复诊或电话进行随访。主要终点定义为脑卒中后90 d 改良后的Rankin积分(modified Rankin scale,mRS),mRS 0⁃2 为预后良好。次要终点是90 d 的全因死亡率、mTICI(2b⁃3 为血流开通良好)和颅内出血转化(in⁃tracranial hemorrhage,ICH)。
1.3 统计学方法
所有统计分析均使用SPSS 软件26.0。连续变量以平均数±标准差()或中位数四分位数[M(P25,P75)]表示。连续变量为正态分布时采用un⁃paired Student’s t检验,非正态分布时采用非参数检验。分类变量以百分数表示,并用卡方检验或Fish⁃er 精确检验进行比较。P<0.05 为差异有统计学意义。采用多因素Logistic 回归分析年龄≥80 岁患者基线参数是否对机械取栓预后有独立影响。将单因素分析中P值<0.05的变量纳入多因素Logistic回归模型。计算比值比(odds ratio,OR)和相应的95%CI(confidence interval,CI)来评估相关性。
2 结果
2.1 基线及介入参数
共纳入74 例前循环AIS 合并AF 的老年患者。男22例(29.7%),平均(84.4±3.1)岁,阵发性AF 19例(25.7%),CHA2DS2⁃VASc 平均(4.6±1.5)分,中位基线NIHSS 评分19(14,26)分。2.7%(2/74)患者脑梗前接受了有效的抗凝(表1)。发病至穿刺中位数时间284(216,456)min,取栓治疗中位数时间81(46,117)min,中位取栓次数2(1,3)次(表2)。

表1 基线资料Table 1 Baseline clinical characteristics(n=74)
2.2 临床预后
AIS 合并AF 的老年患者接受机械取栓治疗,90d 良好预后(mRS 0⁃2)率为21.6%,血流良好再通(mTICI 2b⁃3)比例为77.0%,全因死亡率为36.4%,颅内出血转化率为35.1%(表2)。
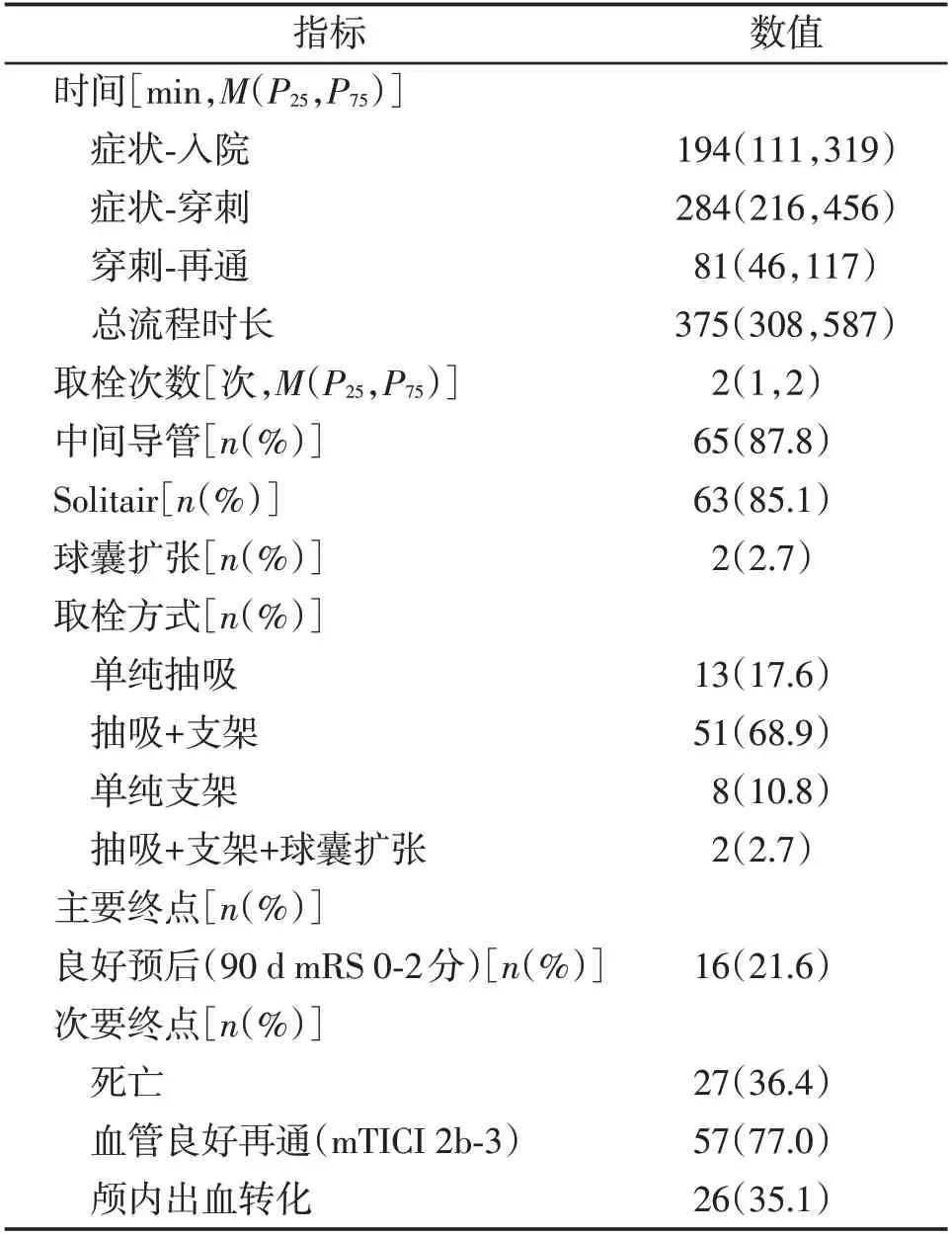
表2 介入参数和临床结局Table 2 Operation parameters and clinical outcomes
单因素分析性别、年龄、基线mRS、合并症(高血压、糖尿病、冠心病、卒中史、心衰)、卒中类型、栓塞部位、血清学指标、取栓次数、取栓方式、血流再通等级对患者预后无显著影响,取栓前静脉溶栓桥接治疗(OR=2.57,95%CI:0.52~12.68)和高CHA2DS2⁃VASc 评分(OR=1.55,95%CI:0.97~2.49)有增加不良预后风险的趋势。单因素、多因素Logistic回归模型分析(表3)表明,非阵发性AF(OR=18.35,95%CI:1.98~169.77,P=0.010),基线NIHSS 评分(OR=1.42,95% CI:1.15~1.75,P<0.001),从发病到取栓结束的总流程时长(OR=1.01,95%CI:1.00~1.02,P=0.030)是不良预后(mRS 3~6)的独立危险因素(AUC=0.92,95%CI:0.84~1.00,P<0.001,图1)。
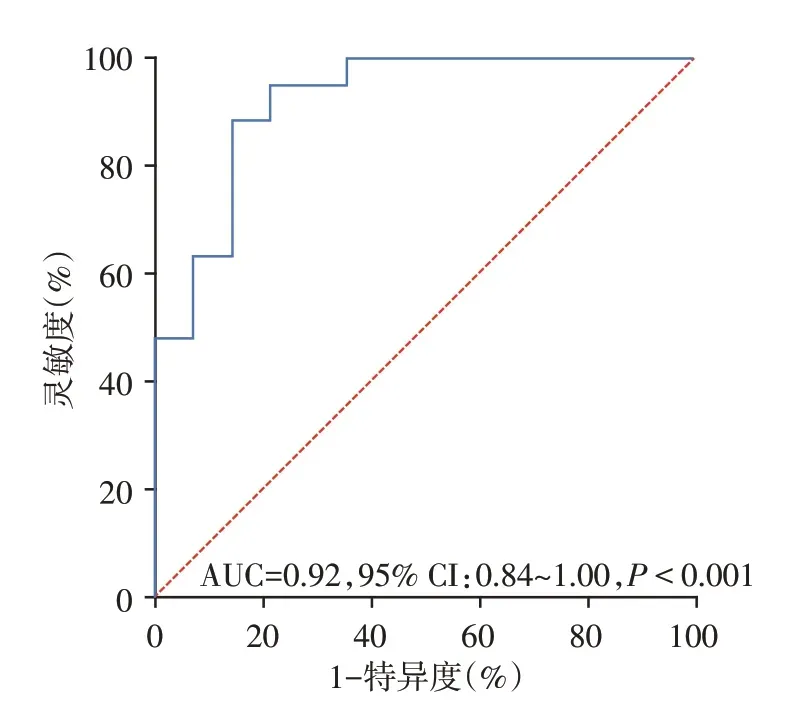
图1 多因素分析预测模型ROC曲线Figure 1 ROC curve of multivariate logistic regression model
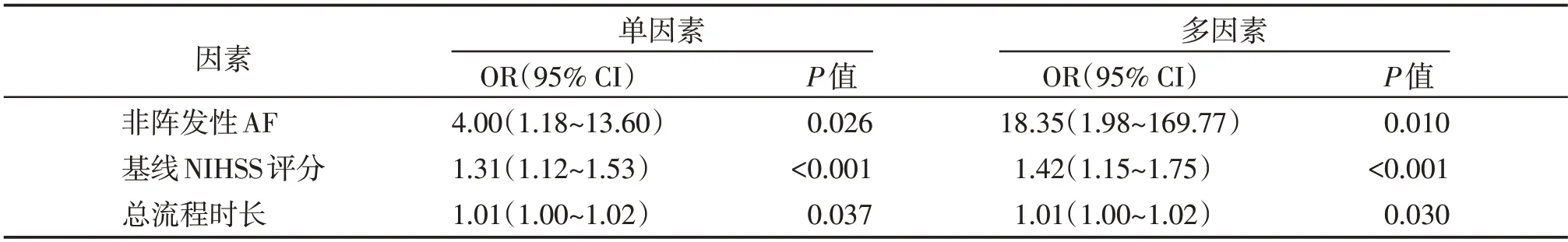
表3 不良预后(90 d mRS 3⁃6)的单因素和多因素分析模型Table 3 Univariate and multivariate logistic regression to predict unfavorable functional outcome(a Modified Rankin Scale score of 3⁃6)at 90 days
共有27 例患者在机械取栓治疗后90 d 内死亡。致死原因分别为:大面积脑梗死(13例)、脑出血(7 例)、严重肺部感染(6 例)、室性心动过速(1 例)。Kaplan⁃Meier 生存曲线显示(图2),与阵发性AF 相比,非阵发性AF 的死亡率更高(HR=3.45,95%CI:1.04~11.47,P=0.034)。
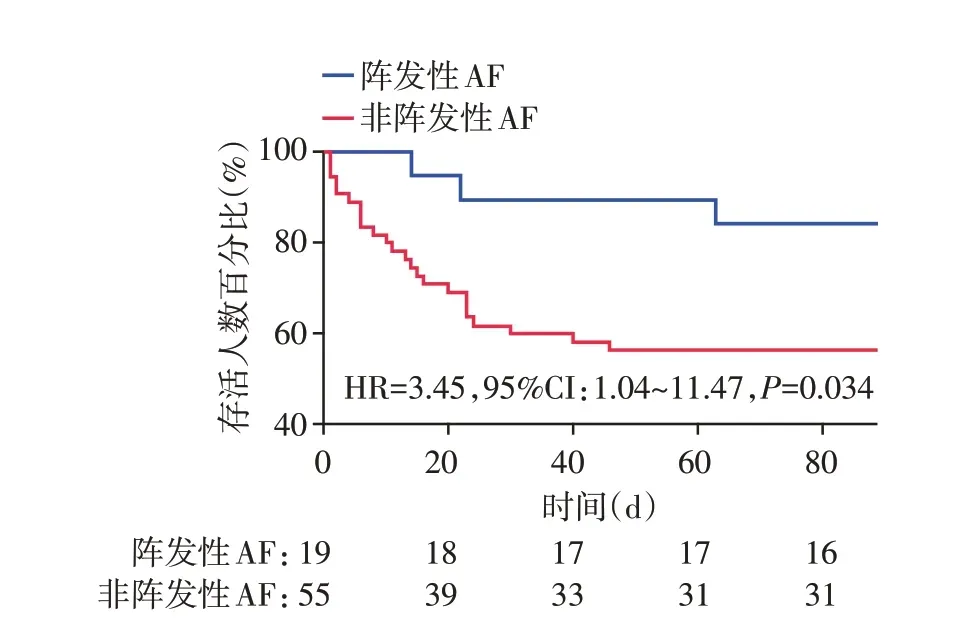
图2 阵发性AF 和非阵发性AF 取栓术后90 d 全因死亡率比较Figure 2 Comparison of all⁃cause mortality during 90 days after MT between paroxysmal and non⁃paroxysmal AF
在随访期间,47 例生存者中有26 例(55.3%)患
(n=74)者在机械取栓后口服抗凝药;其中华法林4例,利伐沙班15例,达比加群7例。
3 讨论
本次回顾性观察性研究发现,AIS合并AF的老年患者取栓总体预后较差,血流再通等级差,病死率、出血转化风险高。非阵发性AF、基线NIHSS 评分高、总流程时长是预后不良的独立危险因素;同时非阵发性AF是影响全因病死率的重要因素。
AF 已被证实是AIS 患者预后不良的独立预测因子[11],合并AF 的AIS 患者静脉溶栓、动脉取栓后脑出血的风险较高,这可能与AF 相关的脑卒中患者血栓负荷重,容易导致颅内大血管闭塞,进而形成较大的缺血区域和核心梗死体积有关[12-13]。虽然指南推荐对符合取栓标准的AIS 患者进行取栓治疗,但MR CLEAN 亚组[14]研究和近期一项单中心观察研究[15]的分析均发现,与无AF患者相比,接受取栓治疗的AIS 合并AF 患者90 d mRS 评分更差。此外,另一项研究也发现AIS合并AF患者取栓术后出血转化率更高[16]。
老年AF 患者的血管质量较差,容易导致再通失败和脑出血。ENDO⁃STROKE 研究发现[17],患者年龄越大,特别是80 岁以上,前循环血管再通成功率越低。持续性或永久性AF 引起的异常血流所产生的剪切力可损伤脑血管内皮,促使动脉斑块、动脉粥样硬化甚至狭窄的形成[18],这可能会增加再通的难度,增加脑出血的风险。NIHSS评分越高,提示累及功能区越多,脑损害越重,这在既往研究中多有报道,被认为是预测卒中后不良结局的重要危险因素[7]。
多因素回归分析发现,总流程时长越短,临床预后越好。这主要是因为与颈动脉粥样硬化性脑卒中患者相比,AF 相关性脑卒中患者侧支循环较少。既往研究表明,颅内血管狭窄程度与侧支循环的建立有关,严重的血管狭窄可促进侧支循环的代偿[19]。心源性卒中患者因血栓脱落导致颅内大血管闭塞,此时侧支循环尚不能及时建立,供血区脑组织血流供给显著减少甚至中断,短时间内脑组织受累范围广、损害严重。本研究27 例死亡,13 例(48.1%)考虑大面积脑梗死致死,由此可见一斑。因此,对于AIS 合并AF 的老年患者来说,需要尽可能缩短总流程时长。
本研究还表明,与直接取栓相比,静脉使用阿替普酶桥接治疗有增加不良预后风险的趋势。已有研究证实,在AIS患者大血管闭塞症状出现后4.5 h内直接取栓与桥接治疗相比,预后相似[20]。此外,溶栓不仅增加了取栓过程中脑出血风险,溶栓及溶栓后评估同时增加了血流再灌注的总时长。因此直接取栓可能对老年AIS 合并AF 患者的临床预后更有利。
因此,对于老年AIS 合并AF 的患者,尤其是合并非阵发性AF、高基线NIHSS 评分、发病时间久的患者,是否选择取栓治疗需更为谨慎,应尤神经内科、介入科、急诊、心内科等多学科综合评估患者基本情况,充分告知患者家属风险及其预后。此外,抗凝药物的使用可有效预防老年AF 患者发生脑卒中[10]。本研究中极少有老年AF 患者在AIS 发病前进行有效抗凝。考虑到老年AF 患者的取栓治疗预后较差,提高在该人群抗凝药物的使用率以预防脑卒中发生显得尤为迫切。
本研究有一定局限性。首先,这是一个小样本量的单中心回顾性分析;其次,本研究只分析了前循环闭塞的老年患者的临床基线数据,对后循环取栓预后,以及其他未纳入的潜在因素并未有效论证。因此,需要更大规模研究来阐明机械取栓对AIS合并AF的老年患者的治疗效果。
老年AF 患者前循环急性缺血性脑卒中时,如合并基线NIHSS 评分高和/或非阵发性AF 时,选择取栓治疗要更慎重。此外,需进一步提高老年AF患者的抗凝率预防脑卒中。
