白三叶草一种叶斑病病原菌的分离鉴定
2022-03-02任爱芝赵培宝
商 娜,任爱芝,刘 冰,赵培宝
(1聊城大学农学院,山东 聊城 252000;2聊城市农业科学院,山东 聊城 252000)
0 引言
白三叶草(Trifolium repens)属豆科(Fabaceae)车轴草属(Trifolium),是一种可用作豆科牧草或地被绿化的多年生草本植物。白三叶作为一种优质牧草,具有营养丰富[1-2]、适口性好、抗逆性强[3-4]等特点,且根部富有大量根瘤菌,固氮能力强,固氮量高[5],越来越多的应用于畜牧业中。白三叶草的茎匍匐蔓生,根系发达,成坪速度快,返青早,青绿期长,花朵饱满,观赏期长[6],耐踩踏,管理成本低,对铜、镉、铅等重金属污染土壤[7-8]和柴油、二噁英等有机物污染土壤[9-11]有良好的修复能力,可在国内外园林绿化、水土保持[12]、土壤修复等方面发挥重要作用。
白三叶草应用逐渐广泛,种植面积不断扩大,真菌病害和病毒病害也日益严重[13]。白三叶草染病,严重时可造成草坪成片枯死,草地稀疏、秃斑,不仅严重影响草坪的观赏性,还大大降低了牧草的产量和品质。尹亚丽[14]、杨红[15]、勇作山[16]、杨照坤[17]等调查研究发现,白三叶草常见的病害有锈病、叶斑病、白绢病、白粉病、褐斑病、黑斑病、菌核病和病毒病等。
2019年在山东省聊城市调查白三叶草病害时,笔者发现叶斑病较为普遍。本研究以具有叶斑病的白三叶叶片为材料,分离病原菌并进行致病性测定,利用形态学和分子生物学手段进行病原菌种类鉴定,以期为白三叶草叶斑病的诊断及防控提供理论基础。
1 材料与方法
1.1 试验时间、地点
试验于2019年5月—2020年1月在聊城大学农学院实验室进行。
1.2 试验材料
2019年5月31日在聊城市东昌府区白三叶草草坪采集新鲜病叶,记录病叶发病情况并拍照,放于4℃冰箱保存。
1.3 病原菌的分离
用组织分离法分离叶斑病病原菌。选取有典型病症的白三叶草叶片,冲洗干净后晾干。在超净工作台中,于病健交界处剪取2~4 mm见方的病组织。先用75%酒精浸泡10 s,再用3%的次氯酸钠溶液浸泡3 min,最后用无菌水漂洗3次,待水分挥发干后放置于含有1‰乳酸的PDA平板上,每个处理放3个培养皿,每皿4片。28℃恒温恒湿培养3~4天,待长出菌落后,选择代表性菌落再次分离,进一步纯化得到菌落大小、颜色、形状、菌丝形状、菌丝生长快慢等一致的纯菌种,分离得到纯化的病原菌SY1。把纯化的病原菌SY1接种于PDA斜面培养基上,放置于4℃冰箱冷藏备用。
1.4 病原菌的致病性测定
采用无菌水清洗后的健康白三叶草进行接种试验,用针刺法对白三叶草叶片造成微伤口,将培养7天的病原菌SY1用打孔器打成直径5 mm的菌饼,将菌饼的菌丝面贴置于伤口上。在培养皿中放入含有少量水的无菌滤纸,把接种后的白三叶叶柄用湿润脱脂棉包裹后放于培养皿中,于25℃条件下恒温保湿培养,设3次重复。待接种的白三叶叶片发病后,观察其症状,并按照柯赫氏法则,对病原菌重新分离纯化,检测分离的病原菌是否和接种的病原菌SY1一致。
1.5 病原菌形态学鉴定
首先活化菌株SY1,将保存的病原菌菌株SY1用接种针挑取小块带菌培养基转接到PDA培养基上培养5天,用6 mm直径打孔器在菌落边缘长势一致处打孔得到菌饼,接种到PDA培养基上,28℃恒温恒湿培养,观察其菌落颜色、形态、生长速度等;用移液枪将PDA培养基滴在载玻片上,放于提前装好2层无菌滤纸的培养皿内,并向滤纸上加3 mL无菌水保持湿度。待PDA培养基凝固后进行病原菌接种,放置于28℃培养箱中5天,显微镜下观察其形态特征,并对病原菌进行形态鉴定[18]。
1.6 病原菌分子生物学鉴定
刮取纯化后的菌株SY1菌丝,液氮研磨,75℃烘干3 h。使用真菌基因组DNA提取试剂盒提取DNA,琼脂糖凝胶电泳检测,-20℃保存备用。使用真菌通用引物 ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和ITS5(5′-GGAAGTAAAAGTCGTAACAAGG-3′)进行 PCR扩增。
PCR反应体系为25 μL,DNA模板2.0 μL、上下游引物 (10 μmol/L)各1.0μL,2 × Power Taq PCR MasterMix 5.0 μL,dd H2O 16.0 μL。PCR反应程序为94℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,32个循环;最后72℃延伸10 min。将PCR扩增产物的测序结果通过NCBI网站的BLAST进行比对,并用MEGA-X软件构建系统发育树。
2 结果与分析
2.1 白三叶草叶斑病的症状
发病初期,叶片表面出现小的淡红色斑点,随着时间的推移,斑点逐渐变成不规则的暗红色。斑点的边缘变成了黄色。最后,患病叶子的正反两面变成暗红色(图1)。

图1 山东省聊城市白三叶草叶斑病症状
2.2 病原菌致病性测定
将直径5 mm的纯化后的病原菌SY1菌饼接种于白三叶草叶片上。3天后,白三叶草叶片接触菌饼的部位开始出现病斑,随着时间的推移,病斑不断扩大,对照组无发病现象。5天后移除菌饼,可明显看到不规则病斑(图2)。对接种后发病叶片重新组织分离,得到与接种菌培养和形态特征相同的病原菌,证明原接种菌株SY1为白三叶草的致病菌。
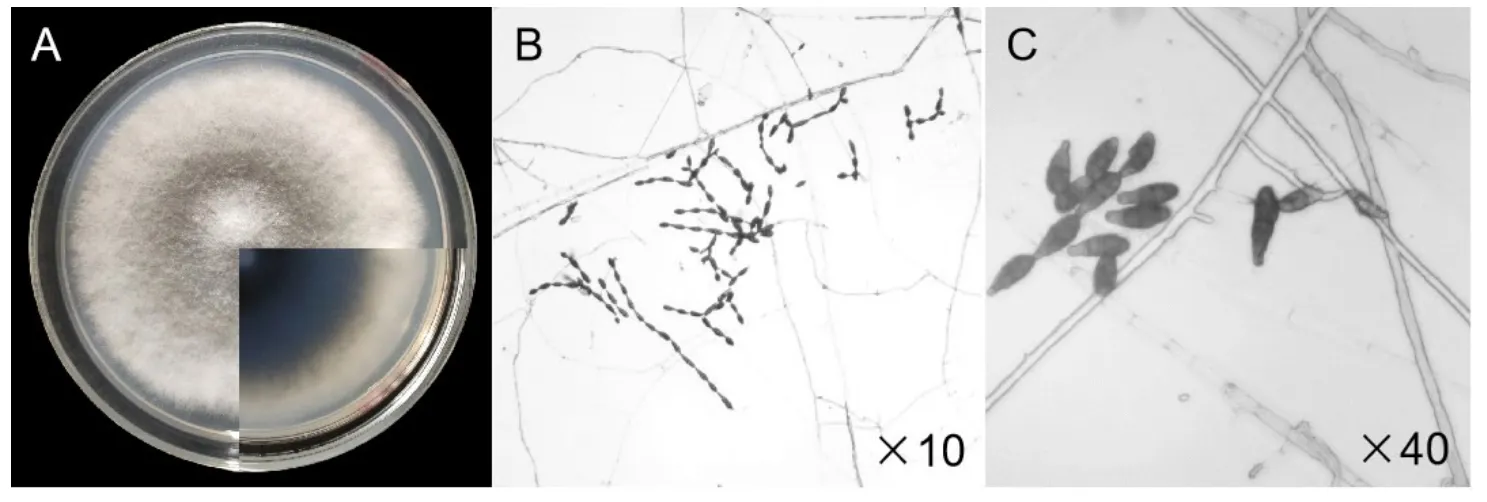
图2 病原菌菌落、菌丝和分生孢子形态特征
2.3 病原菌的形态学鉴定
将分离到的病原菌SY1接种于PDA培养基上28℃培养24 h后,长出白色菌丝,向四周辐射状延伸,逐渐形成圆形菌落。菌落初为乳白色,3~4天后变为浅灰褐色,背面由灰变为黑色。菌丝茂盛、疏松、呈絮状。菌落边缘齐整,7天后长满培养皿(Φ=9 cm)。显微镜检测表明菌丝体有隔,分生孢子梗单生、分枝或不分枝。分生孢子单生或链生,链长1~6个孢子。分生孢子阔倒棒状、卵形、近椭圆形,有1~5个横膈膜,0~3个纵/斜膈膜,分割处略缢缩或不缢缩,孢身大小为(18.81~26.64)μm×(7.98~11.02)μm。
2.4 病原菌分子生物学鉴定
在对病原菌SY1进行形态特征鉴定的基础上,开展了分子系统学鉴定。以所提菌株DNA为模板进行rDNA-ITS序列扩增,经电泳检测得到大小约600 bp的片段(图3)。

图3 病原菌rDNA-ITS扩增片段电泳
将电泳条带胶回收,送至铂尚生物技术(上海)有限公司测序。将菌株SY1的rDNA-ITS序列提交至NCBI,经BLAST分析显示,白三叶草病害的病原菌SY1与链格孢属(Alternaria spp.)有很多种相似,相似性均达到99%以上,与乔木链格孢(A.arborescens)(序列号KC464334.1)的相似性为100%。从NCBI中下载相关菌株序列,使用软件MEGA-X采用邻接法(bootstrap检验1000次)构建系统发育树(图4)。结合形态特征确定白三叶草叶斑病病原菌SY1为乔木链格孢。
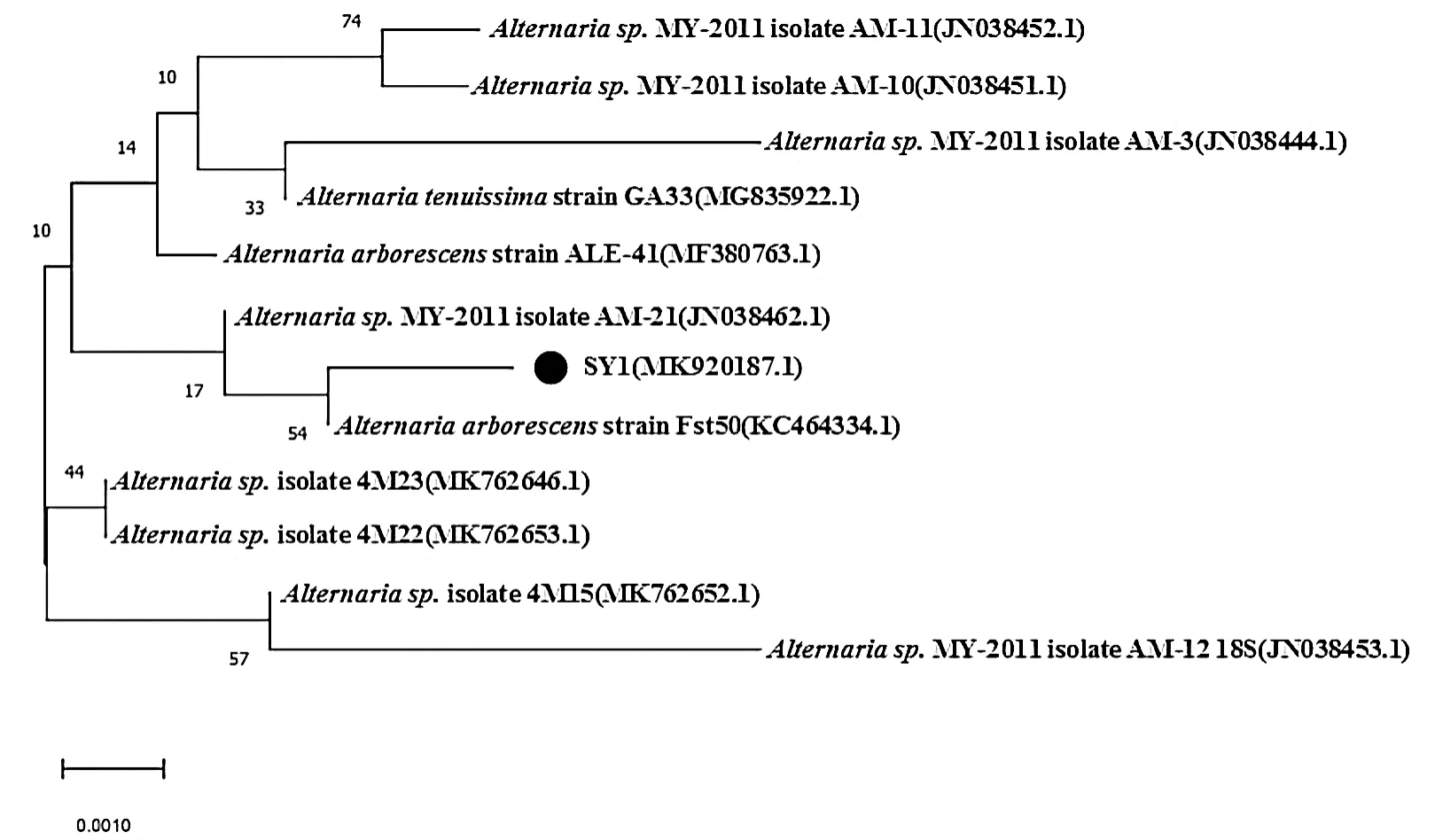
图4 基于rDNA-ITS序列采用邻接法构建病原菌与其相关菌株的系统发育树
3 结论与讨论
对聊城市东昌府区白三叶叶斑病的症状观察,以及对病叶分离病原菌的形态学和分子生物学鉴定,结果表明,引起白三叶叶斑病的病原菌为乔木链格孢(A.arborescens),为国内首次报道乔木链格孢引起白三叶叶斑病。
链格孢属病原菌可侵染多达200种以上作物,可引起小麦黑胚病[19]、油菜黑斑病[20]、向日葵黑斑病[21]、番茄早疫病[22]、马铃薯早疫病[22]、万寿菊黑斑病[23]等。除引起病害外,链格孢极易引起霉变,导致蔬菜、瓜果等腐败变质,给农业生产带来巨大损失。有些链格孢具有产毒能力,产生的植物毒素积累在农产品中,严重威胁食品安全。国内的库尔勒香梨、中华猕猴桃、河北鸭梨、柑橘、大樱桃等瓜果,美国加利福尼亚的开心果,阿根廷的蓝莓也受到链格孢的严重危害[24]。本研究从白三叶草叶片中分离得到病原菌乔木链格孢,为乔木链格孢在国内引起白三叶草病害的首次报道。近年来,乔木链格孢在国内外引起多种病害,如梨黑斑病[25]、葡萄叶斑病[26]、柑橘褐斑病[27]、苹果斑点落叶病[28-29]等,由乔木链格孢引起的病害逐渐受到关注。
传统的链格孢属真菌鉴定主要基于其形态学特征,但由于其菌落形态和产孢结构易受到环境的影响,容易造成鉴定结果的不准确[30]。本文综合真菌形态特征和分子生物学鉴定方法对白三叶叶斑病病原菌进行鉴定,并通过基因对比构建系统发育树,相对更准确地鉴定了病原菌,为该病害的综合防治提供了理论依据,但该病原菌的寄主范围、致病机理等目前尚不明确,需要进一步研究。
