胃肠超声造影定量评价高压力生活状态下大学生胃动力变化
2022-03-01袁玮琪岳文胜刘燕清
袁玮琪,岳文胜,刘燕清,杨 芳,邹 媛,袁 源
(1.川北医学院附属医院超声科 川北医学院附属医院院士工作站 川北医学院附属医院超声研究室医学影像四川省重点实验室 超声医学工程南充市重点实验室,四川 南充 637000;2.南充市中心医院超声科,四川 南充 637000;3.川北医学院临床医学系,四川 南充 637000)
功能性胃肠病(functional gastrointestinal disorder, FGID)在世界范围内发病率较高[1],且患病人群呈逐渐低龄化[2]。大学生群体长期面对学习、情感及就业等压力,精神状态高度紧张,易致胃功能障碍[3]及FGID发病率增加[4]。目前临床诊断FGID主要依靠对症状进行主观评价,缺乏与疾病进展程度相关的定量分析方法。本研究以胃肠超声造影定量分析高压力生活状态下大学生胃结构及动力变化。
1 资料与方法
1.1 研究对象 于2018年3月—12月采用整群随机抽样方法对779名南充市在校大学生进行问卷调查,根据汉密尔顿焦虑量表,将52名总分>7分者归入高压力组,男15名,女37名,年龄18~24岁,平均(21.9±2.0)岁;另随机抽取60名总分≤7分作为非高压力组,男27名,女33名,年龄17~26岁,平均(21.8±1.9)岁。排除标准:①罹患消化系统器质性病变及全身代谢性疾病;②近1个月内服用解痉类、抗胆碱类、抗抑郁类、非甾体类抗炎或促胃动力药物;③乳糖不耐受;④乳糜泻。本研究经川北医学院附属医院医学伦理委员会审查通过[编号:2019ER(R)020]。检查前受试者均签署知情同意书。
1.2 仪器与方法 采用GE Logiq E9彩色多普勒超声诊断仪,C1-6-D凸阵探头,频率2.8~3.7 MHz;或ML6-15-D线阵探头,频率8.3~11.1 MHz。嘱受试者禁食、禁水8~12 h,检查前静息状态下休息10 min。以100℃饮用水冲泡胃肠超声助显影剂(湖州东亚医药用品有限公司)至约1 000 ml,冷却至37℃备用。行胃容受性舒张试验,嘱受试者站立,于5 min内饮尽助显影剂,根据是否出现饱胀(2分)、恶心(2分)、呕吐(3分)及腹痛(3分)进行标准化视觉模拟评分,评分为2~4分时记录初始饱感饮入量,评分为7~10分时记录最大饱感饮入量。
嘱受试者取半卧位,与检查床成45°~60°角,行胃排空功能检查,由1名具有2年工作经验的超声科医师(医师1)于饮尽助显影剂0、30、60、90及120 min时测量相关参数,并留存预设标准化动态图像。将探头置于剑突下T11~T12水平,显示贲门、食管下段长轴切面,于贲门下3 cm处逆时针旋转探头90°,向左平移探头显示近端胃(左界为肝左叶,下界为胰尾),于呼气末屏气测量近端胃横轴面面积。将探头横置于上腹部L1~L2水平,需显示腹主动脉、胰腺、下腔静脉及脾静脉于同一切面(胃角横切面),此时胃窦与胃体呈“∞”形,左侧环为胃体部,右侧环为胃窦部,于呼气末屏气测量远端胃横轴面面积。计算不同时间点胃排空率(gastric evacuation rate, GER),GER=(最大胃面积-不同时间点胃面积)/最大胃面积×100%,最大胃面积为饮尽助显影剂后即刻测量结果。记录胃内容物排出一半所需时间,即胃半排空时间(gastric half-emptying time, T50)。
将探头长轴斜置于脐部与右上腹间,显示胃窦长轴切面,将M型超声取样线置于胃窦部正中,垂直于胃前后壁,扫描速度调至“0”刻度,记录2 min内胃窦部蠕动次数,计算胃蠕动波频率;测量胃后壁收缩时厚度(S0)及舒张时厚度(S1),计算胃壁增厚率,胃壁增厚率=(S0-S1)/S0×100%;测量胃蠕动波凹陷时腔径D1、蠕动波两侧非凹陷处腔径D2及D3、胃蠕动波向幽门移动的距离(X)及移动时间(t),计算以下参数:蠕动波幅度(d)=(D2+D3)/2-D1[5];胃蠕动波速度(V)=ΔX/t;胃动力指数=ΔV/d[6]。见图1~3。由另2名具有5年以上工作经验的超声科医师(医师2、3)根据留存的标准化动态图像再次测量以上参数,其中1名测量2次。
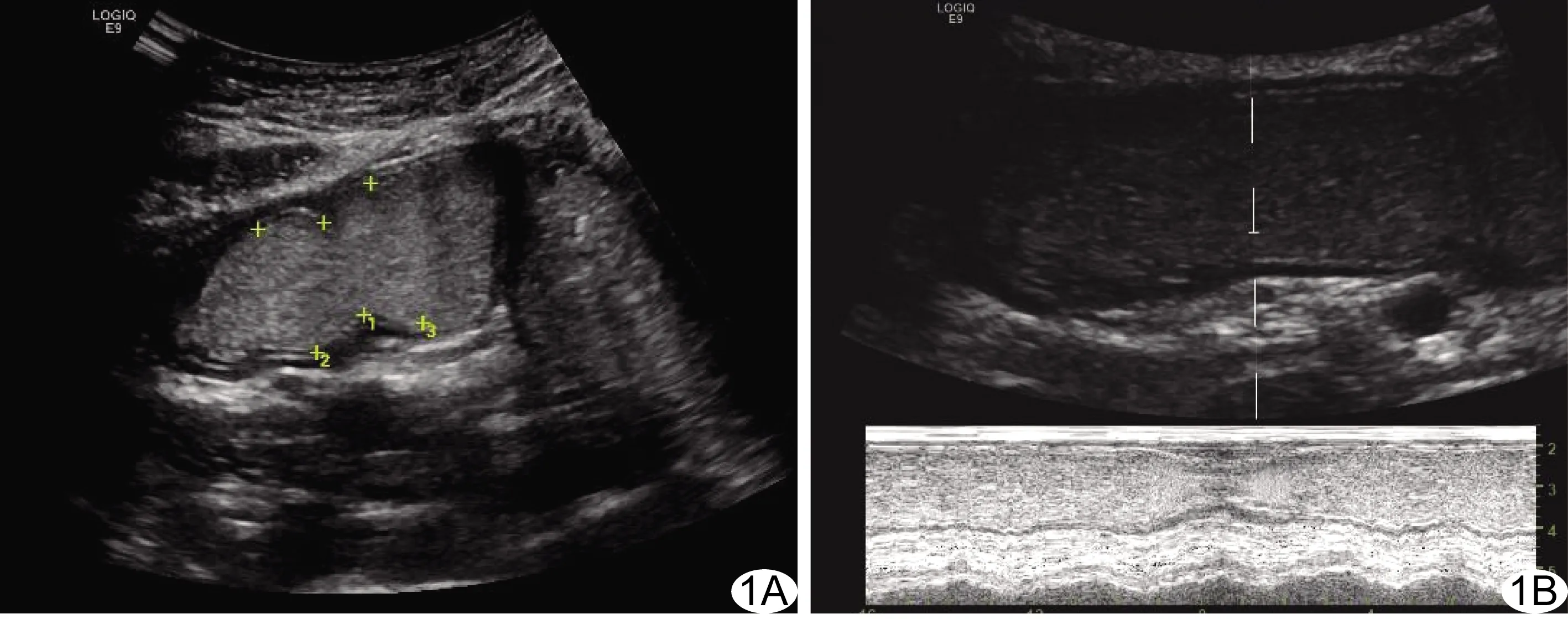
图1 非高压力组受试者,男,20岁 A.超声测量蠕动波幅度,D1=1.7 cm,D2=2.3 cm,D3=2.5 cm; B.于胃壁M型超声图像中计数胃蠕动波通过取样线的次数
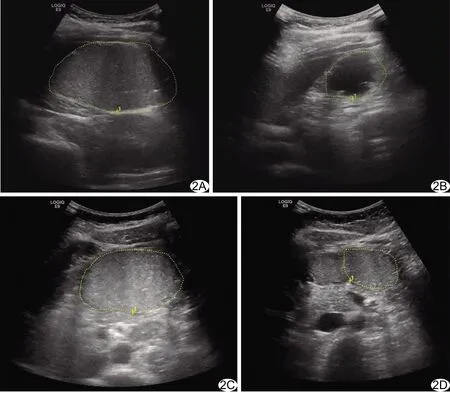
图2 高压力组受试者,女,20岁 A、B.超声分别测量饮尽助显影剂0 min(A)及120 min(B)后近端胃横轴面面积分别为37.9、9.2 cm2; C、D.0 min(C)及120 min(D)远端胃横轴面面积分别为24.2、10.0 cm2
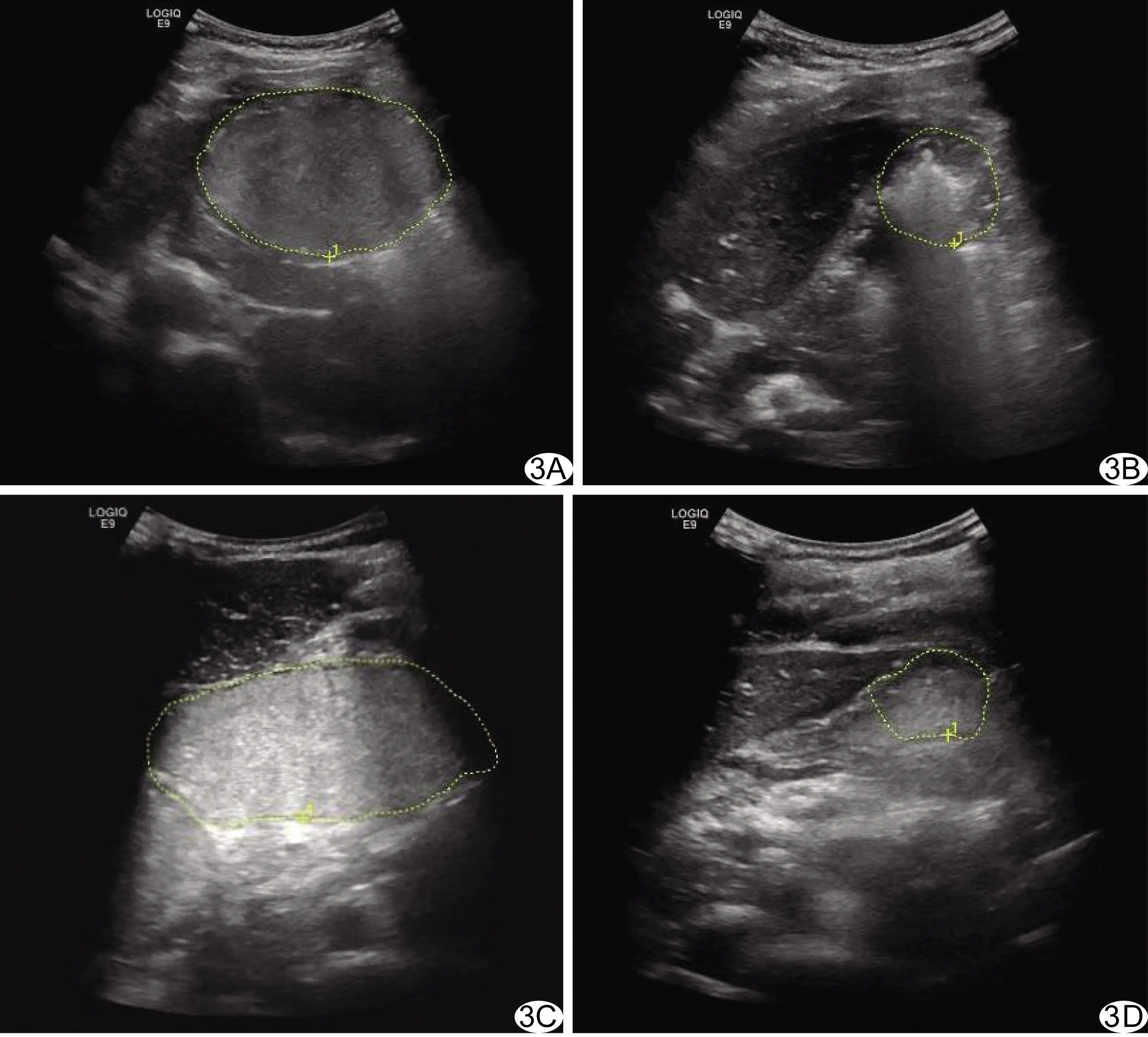
图3 非高压力组受试者,女,21岁 A、B.超声测量饮尽助显影剂0 min(A)及120 min(B)后近端胃横轴面面积分别为33.3、7.2 cm2; C、D.0 min(C)及120 min(D)远端胃横轴面面积分别为31.7、5.2 cm2
1.3 基本资料 详细记录受试者生活、饮食习惯及有无上腹痛、食欲改变或失眠等。
1.4 统计学分析 采用SPSS 17.0统计分析软件。以组内相关系数(intra-class correlation coefficient, ICC)评价观察者间与观察者内测量结果的一致性(医师2、3),ICC<0.40为一致性较差,0.40~0.75为一致性一般,>0.75为一致性良好。基于医师1测量结果,以±s表示符合正态分布的计量资料,组间比较行两独立样本t检验;以中位数(上下四分位数)表示不符合正态分布的计量资料,组间比较行秩和检验。以频数表示计数资料,组间比较行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 基本资料 2组受试者性别(χ2=3.10,P=0.08)及年龄(t=0.34,P=0.74)差异均无统计学意义。高压力组每天学习时间>4 h并出现失眠、食欲降低、上腹痛综合征、餐后窘迫综合征者占比明显高于非高压力组(P均<0.05);组间其余生活及饮食习惯差异均无统计学意义(P均>0.05),见表1。
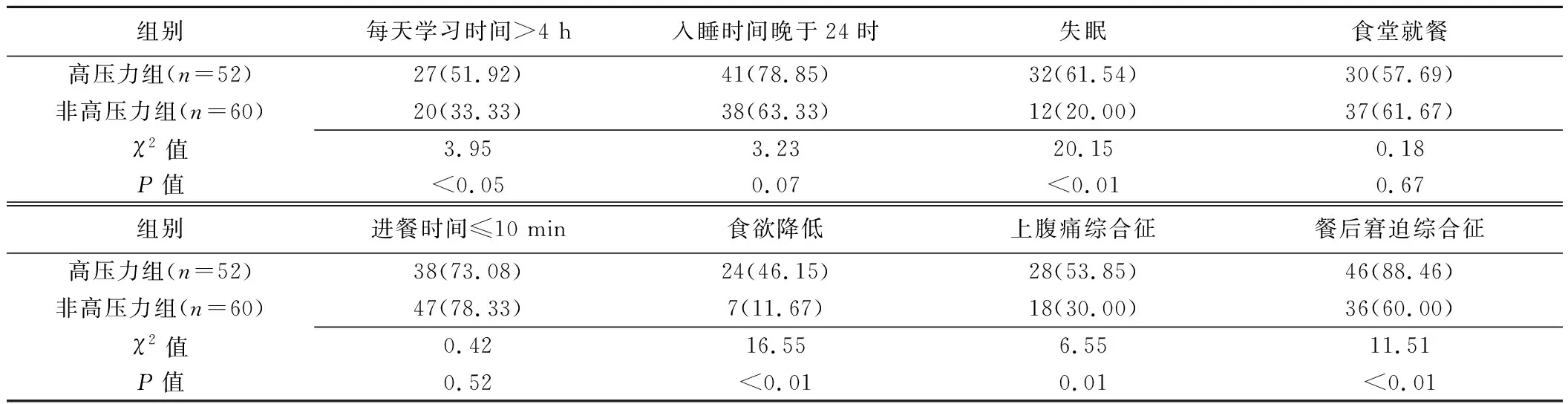
表1 高压力与非高压力在校大学生基本资料比较[例(%)]
2.2 胃容受性舒张试验 高压力组平均初始饱感饮入量为260.0(200.0,350.0)ml,非高压力组为250.0(200.0,322.5)ml,差异无统计学意义(Z=-0.88,P=0.38);高压力组平均最大饱感饮入量为500.0(400.0,500.0)ml,非高压力组为450.0(400.0,500.0)ml,差异无统计学意义(Z=-0.81,P=0.42)。
2.3 胃动力参数 观察者间及观察者内测量各参数的一致性均良好(ICC:0.89~0.96,P均<0.05)。高压力组各时间点胃近端与胃远端GER均显著低于非高压力组(P均<0.05),见表2;高压力组胃近、远端T50均大于非高压力组(P均<0.05),胃蠕动波的频率、胃壁增厚率、胃蠕动波速度及胃动力指数均低于非高压力组(P均<0.05),见表3。
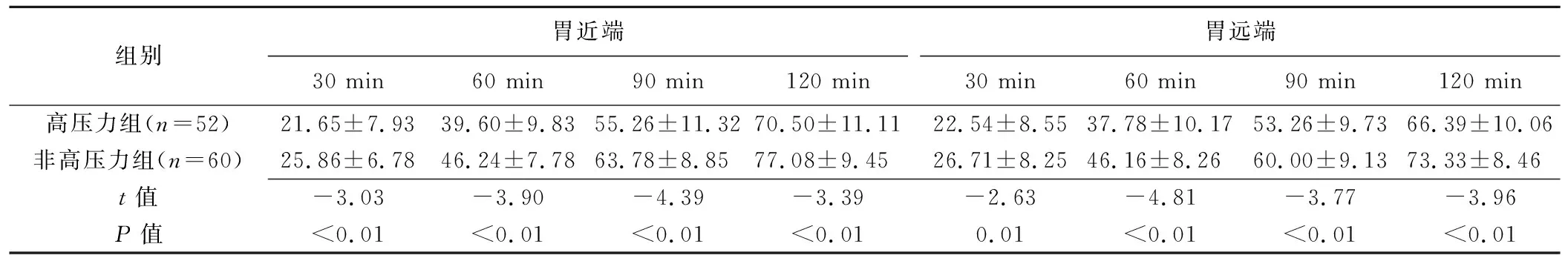
表2 高压力与非高压力在校大学生各时间点GER比较(%)

表3 高压力与非高压力在校大学生胃动力参数比较
3 讨论
FGID与多种病理生理因素相互作用有关,如动力紊乱、内脏高敏感性、黏膜和免疫功能改变、肠道菌群改变和中枢神经系统处理功能异常[7]。肠-脑互动与FGID密切相关,精神心理因素可能为FGID发病因素之一[8]。FGID患者常有焦虑、抑郁等情绪异常,有学者[9]认为FGID是焦虑、抑郁情绪所衍生的躯体表现,心理压力或对压力产生的情绪反应可能加重胃肠道症状,导致病情进一步发展。本研究结果亦显示高压力组大学生更易出现上腹部疼痛或灼烧感、餐后饱胀及早期饱腹感等相关胃肠道症状。
大脑-肠神经轴通过双向信息传递将胃肠道功能与中枢情感认知中心相联系,来自上消化道的内脏信号通过明确的上行通路到达脑干及更高皮层区域,外界应激或内脏感觉信息可影响胃肠道神经支配,而焦虑、抑郁、痛苦、恐惧及愤怒等情绪变化则会延迟胃排空和肠道蠕动[10]。高压力应激下,血液中的促肾上腺皮质激素及肾上腺糖皮质激素浓度增高,介导肥大细胞活化,增加胃黏膜通透性,损害黏膜分泌和屏障功能,抑制胃肠蠕动,导致胃排空功能下降。胃壁增厚率可间接反映胃壁平滑肌的收缩能力,收缩幅度越大,幽门周围压力增加越明显,排空量越多,胃近、远端排空时间越短,即胃动力增强。
早期饱腹感是胃底扩张及调节功能受损的主要症状。胃底扩张是既定的生理逻辑反应,允许胃内体积增加而不增加胃内压力[11]。胃调节功能受损患者胃近端无法放松并改变容量,进食后胃内压力增加,导致餐后不适[12]。本研究高压力组初始饱感饮入量与非高压力组比较无明显差异,提示精神压力因素对胃近端储存食物能力无显著影响;而既往研究[13]认为生活及社会压力较大的人群饮食量更多,以缓解压力。此外,本研究中高压力组失眠率高于非高压力组,学习时间延长可能使机体无法得到正常休息及调整,过度负荷状态导致中枢神经系统受到刺激,最终导致胃肠消化功能障碍[14]。
本研究的局限性:①仅基于问卷调查筛选受检者,不能排除器质性胃疾病;②研究对象为本地在校大学生,无法完全代表同年龄大学生人群;③胃近、远端形态不规则,部分受试者胃肠助显影剂排空后胃腔变小,受气体干扰,局部胃壁与显影剂分界面显示稍欠清晰,仅依赖局部胃壁解剖结构测量面积,可能对测量结果造成影响。
综上,长期高压力生活状态下,大学生易出现胃排空延迟和胃肠运动功能减弱。实时胃肠超声造影可用于诊断及监测胃功能改变。
