lnc-SNHG5及miR-155在子痫前期患者血清及外泌体中的表达及其胎盘源性检测
2022-03-01许洪梅张媛章乐霞周淑
许洪梅,张媛,章乐霞,周淑
子痫前期(preeclampsia,PE)是产科严重并发症之一,在孕妇中发病率约为4%~6%,也是导致产妇死亡的重要因素之一[1]。PE病情变化复杂,病因不明,目前研究认为该疾病为多种因素共同导致[2]。胎盘功能障碍是该疾病的主要表型,胎盘源性因素作用于全身系统,引发的一系列病理表现可能为PE发生的潜在机制。同时相关研究表明,多种非编码RNA(non-coding RNA,ncRNA)包括lncRNA、miRNA等在PE患者胎盘组织中差异性表达[3-4],这些ncRNA能够通过交互调控,影响下游靶基因,在调节滋养细胞功能、子宫螺旋动脉重铸等过程中发挥作用,从而参与PE发病。然而,发生PE时胎盘-母体间的“对话”方式尚不明晰。
许晨等[5]研究发现miR-155在PE胎盘组织中表达增高,而我们的研究发现:在PE胎盘中低表达的lnc-SNHG5能够发挥竞争性内源性RNA样作用,并通过影响miR-155/特异性趋化因子受体4(chemokine receptor 4,CXCR4)途径,抑制滋养细胞侵袭,从而进一步明确了lnc-SNHG5与PE的相关性[6]。外泌体(exosomes,exo)中富含包括miRNA在内的多种成分,能够通过转运至效应器官/组织细胞,发挥诸多的生理调控作用[7]。因此,胎盘组织中差异性表达的lnc-SNHG5、miR-155能否以被外泌体装载的方式作用于PE患者全身,从而引发一系列的病理变化产生,值得探究。
1 材料和方法
1.1 研究对象
收集2020年11月至2021年3月在乐山市人民医院产科住院接受剖宫产分娩的30例产妇;其中NC组15例,均为正常晚孕孕妇,无任何孕产期合并症,平均(25.45±6.17)岁,体质量指数(body mass index,BMI)≤25 kg/m2,平均孕周(38.85±3.01)周;PE组15例,均按照人卫第九版《妇产科学》标准诊断为PE,且未接受任何治疗,平均(27.67±4.17)岁,BMI≤25 kg/m2,平均孕周(36.38±2.71)周。两组患者均为单胎初产患者;既往无遗传性、传染性疾及代谢性疾病病史;无孕早期药物、放射线及毒物接触史。本研究经我院伦理委员同意并批准,所有研究对象均签署知情同意书。
1.2 主要试剂和材料
exoEasy Maxi Kit外泌体提取试剂盒(德国Qiagen公司);exoRNeasy Serum(德国Qiagen公司);PrimeScript RT reagent kit、SYBR Premix Extaq RT-PCR kit(日本Takara公司);TRIzol(美国invitrogen公司);RIPA裂解液、BCA蛋白浓度测定试剂盒(中国碧云天公司);CD63多克隆抗体(中国武汉三鹰公司);CD9单克隆抗体(英国Abcam公司);PLAP单克隆抗体、HRP标记羊抗兔二抗(武汉博士德生物工程有限公司);PVDF膜(美国Millipore公司);ECL底物液(北京普利莱基因技术有限公司)。
1.3 方法
1.3.1 血清标本收集 入院后在接受药物及手术治疗前,分次采集、收集纳入孕妇晨起空腹肘静脉血共计15 mL。所有血浆样本均在采集后置促凝管中,4℃静置过夜后2 000 r/min离心5 min,吸取上层血清至EP管中,-80℃冰箱保存备用。
1.3.2 血清标本外泌体提取 使用0.8 μm的滤膜过滤两组血清,按照exoEasy Maxi Kit说明书步骤将过滤后血清与缓冲液1∶1混合,倒置混合均匀后加入至exoEasy自旋柱上,2 000 r/min离心1 min;收集离心液并加入缓冲液,5 000 r/min离心5 min;将旋转柱转移到新的收集管中,加入400 μL缓冲液孵育1 min,500 r/min离心5 min,磷酸盐缓冲液重悬离心沉淀,即得到两组exo(PE组exo、NC组exo),留存备测。
1.3.3 血清标本exo鉴定 使用Nanosight NS300系统进行exoNTA鉴定,PBS缓冲液多次稀释exo样本,直至影像学判断样品于合适浓度下观察;依据收集的影像动态记录片段,分析测量exo样本颗粒粒径(nm)及对应颗粒浓度(颗粒个数/mL)。
使用2.5%的戊二醛4℃下固定两组外泌体,磷酸缓冲液(phosphate buffer saline,PBS)漂洗3次(每次15 min);随后使用2%锇酸溶液室温(20℃)下固定2 h;再次PBS液漂洗3次(每次15 min);梯度乙醇脱水(20 min);丙酮:812包埋剂(1∶1)混合液渗透过夜,纯812包埋剂渗透过夜;将包埋板于60℃下聚合48 h;切片(成片厚度60 nm~80 nm);2%醋酸铀饱和水溶液及枸橼酸铅,各染色切片15 min后,室温干燥过夜;最后于透射电镜下拍照。
1.3.4 血清标本exo特征性蛋白及胎盘源性特异性蛋白检测 RIPA裂解液提取PE组exo、对照组exo总蛋白;检测蛋白浓度后,Western blot检测exo特征性蛋白:配胶后十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE);将目的条带电转至PVDF膜;用含5%脱脂奶粉的TBST室温摇床封闭2 h;PVDF膜浸泡于一抗孵育液中,4℃孵育过夜(抗体浓度:exo特征性蛋白CD9 1∶2 000、CD63 1∶400;胎盘源性特异性蛋白PLAP 1∶500);TBST洗涤PVDF膜;PVDF膜浸泡于HRP标记二抗(1∶50 000)孵育液中,室温孵育2 h;ECL显影、定影,BandScan分析胶片灰度值。
1.3.5 血清标本及exo中lnc-SNHG5、miR-155在mRNA水平的表达检测 Trizol法及按照exoRNeasy Serum说明书步骤分别提取血清标本及exo中总RNA;检测RNA质量后,按照PrimeScript RT reagent kit、SYBR Premix Extaq RT-PCR kit说明书步骤进行实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)。引物序列详见表1。反应条件:95°C 10 min,95℃ 15 s,60℃ 60 s,95℃ 15 s,40个循环。以U6为内参,进行PCR反应。每次检测设定3个复孔,每个样本重复3次。根据PCR扩增曲线,使用 2-△△Ct法计算各组中目的基因lnc-SNHG5、miR-155 mRNA水平的表达情况。
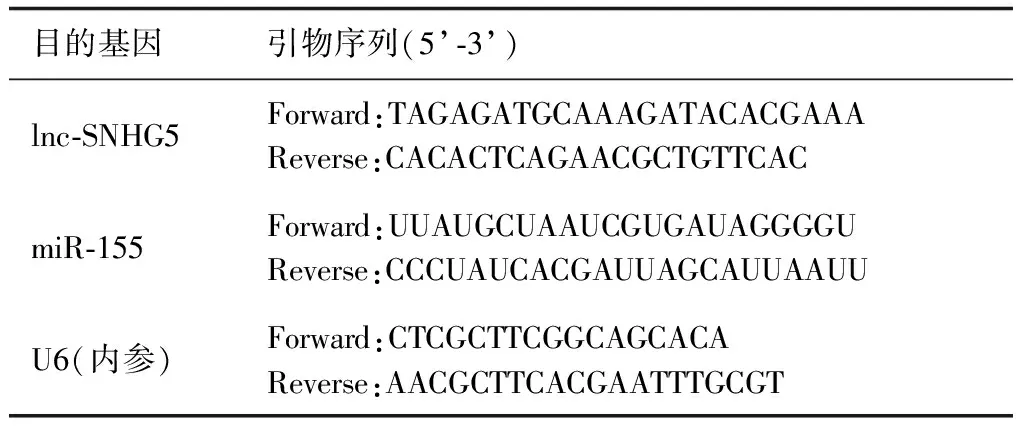
表1 目的基因引物序列
1.4 统计学方法
2 结果
2.1 血清标本外泌体鉴定
NTA鉴定结果显示,PE组exo及NC组exo的粒径大小均主要集中于30 nm~200 nm范围内;粒子浓度分别为:为2.84×109particles/mL、 2.31×109particles/mL,见图1。

图1 NTA检测PE组exo及NC组exo粒径、浓度
于透射电镜下观察血清标本中所提取的PE组exo及NC组exo,可见两组形态均为典型囊泡状,圆盘双凹形;直径大小大多位于50 nm~150 nm范围内,见图2。

图2 PE组exo及NC组exo透射电镜图(比例尺200 nm)
2.2 血清标本外泌体特征性蛋白及胎盘源性特异性蛋白表达
Western blot结果显示,PE组exo及NC组exo均可表达exo表面特征性蛋白CD9、CD63以及胎盘源性特异性蛋白PLAP,见图3。
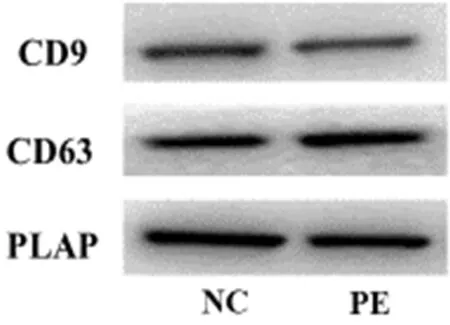
图3 Western blot检测PE组exo及NC组exo CD9、CD63、PLAP蛋白水平表达
2.3 血清标本及外泌体中lnc-SNHG5、miR-155在mRNA水平的表达情况
qRT-PCR结果显示,与NC组比较,PE组lnc-SNHG5 mRNA表达水平在血清及exo中均降低(P<0.05);PE组miR-155 mRNA表达水平在血清及exo中均升高(P<0.05),详见表4。
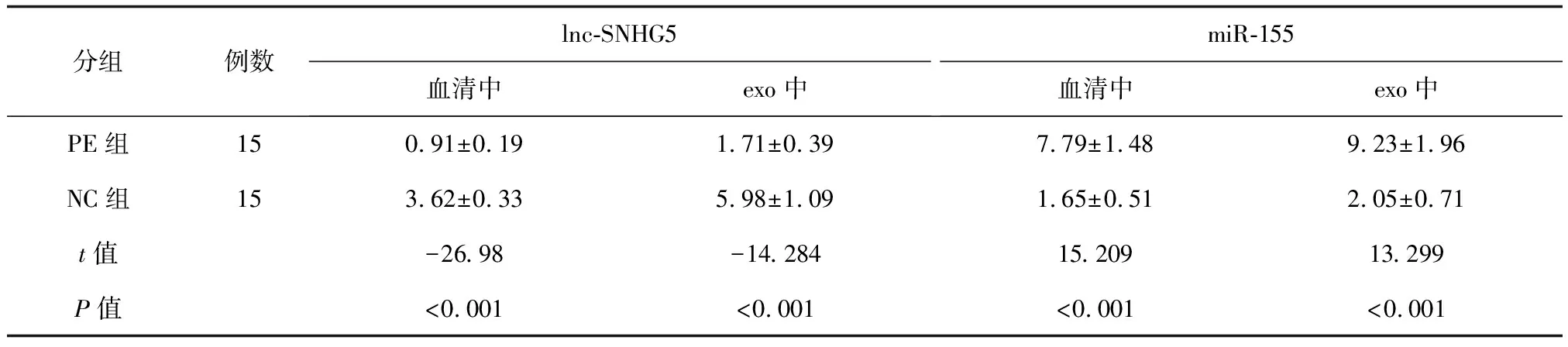
表4 血清及exo中lnc-SNHG5、miR-155在mRNA水平的表达
3 讨论
PE是以高血压、蛋白尿等多系统器官功能紊乱为主要表现的全身性疾病,是妊娠期导致孕产妇及胎儿不良结局的常见疾病[1]。胎盘娩出,PE症状即可缓解或消失[8],提示胎盘功能异常在PE发病中的重要作用。有研究显示,妊娠状态下胎盘细胞分泌的微小脂质囊泡,即exo能够参与母体-胎盘间部分“对话”过程,从而起到传递及调节胎盘功能的作用[9]。因此提示,胎盘源性exo在PE发生发展过程中可能发挥重要作用。
exo直径仅为30 nm~100 nm,其存在于各种组织、体液、细胞中,并携带脂质组、蛋白质、核酸物质、非编码RNA[7]等成分,以发挥其病理及生理调节作用[10]。在exo所携带的各类分子成分中,miRNA能够发挥其对靶基因的定向调控作用,参与多种病理生理过程,已经在多个生命科学领域中得到了明确[11]。既往研究提示:在胎盘组织中病理性高表达的miR-155能够调控多个靶基因,参与滋养细胞凋亡、侵袭、血管生成以及炎症反应等多种生理过程,从而参与PE发病[12];后续我们研究中进一步发现,lnc-SNHG5在胎盘组织中低表达,其能够负向调控miR-155,进而影响miR-155靶基因CXCR4的表达,从而抑制滋养细胞侵袭;提示lnc-SNHG5与miR-155之间构成的调节系统在PE发病中起到了一定作用[6]。但是,上述PE相关的差异性表达的非编码RNA(lnc-SNHG5、miR-155)是在胎盘组织中所发现,组织中的差异表达趋势,是否也同样存在于母体中?本研究中我们进一步检测了母体血清中lnc-SNHG5、miR-155的表达情况,结果提示:与对照组相比,PE组lnc-SNHG5 mRNA表达水平在血清中降低、miR-155 mRNA表达水平在血清升高;这与前期研究中,在胎盘组织中发现的lnc-SNHG5、miR-155差异表达趋势一致;进一步验证了lnc-SNHG5、miR-155与PE的相关性以及它们有成为疾病标志物的潜力。但是PE时,lnc-SNHG5、miR-155如何从胎盘作用于母体全身、以及这两者间如何完成调控作用尚未知。
结合exo具有细胞间基因交流的功能,本研究中,我们尝试分离PE及正常晚孕孕妇血清中的exo并鉴定这些exo是否具有胎盘源性。结果发现:PE组及对照组exo均可表达exo表面特征性蛋白CD9、CD63以及胎盘源性特异性蛋白PLAP。进一步检测exo中lnc-SNHG5、miR-155表达,结果提示:与对照组相比,PE组lnc-SNHG5表达水平降低、miR-155表达水平升高;这与我们前期在胎盘组织及血清中的检测结果均一致。与其他exo不同,胎盘来源exo可特异性表达PLAP[13],通过上述研究我们验证了携带差异性表达lnc-SNHG5、miR-155的exo源自胎盘细胞,提示胎盘组织中差异表达的lnc-SNHG5、miR-155可能通过exo携带转运的方式实现了两者间调控,以及参与了PE发病过程。lncRNA虽不能直接调节蛋白质翻译过程,但是其可以通过miRNA实现其调节力,这一过程可能通过exo作为介导,在多种组织环境中实现;已有相关研究发现,exo源性miRNA能够通过参与调控多种细胞的生物学功能,影响螺旋动脉重铸、炎症反应、免疫调节、细胞代谢、自噬等过程[14-15];并且相较于血清中,exo源性lncRNA、miRNA具有更好的稳定性并不易被降解[16-17],从而完好无损地从其“发源地”前往“目的地”发挥相关作用。在后续的研究中,我们还将进一步通过细胞摄取实验验证携带差异表达lncRNA、miRNA的胎盘源性exo能否被滋养细胞、血管内皮细胞等直接摄取,流式细胞术联合侵袭小室、管样形成实验等并观察细胞功能是否发生变化,以及qRT-PCR、western-blot检测涉及的相关因子表达情况,以期从功能调节角度验证胎盘源性exo所发挥的具体作用。
综上,lnc-SNHG5、miR-155在PE患者胎盘组织、血清以及血清exo中具有一致的差异性表达趋势,并且血清中exo lnc-SNHG5、miR-155具有胎盘源性。上述发现有助于进一步明确lnc-SNHG5、miR-155与PE的相关性,并且为探索PE发病机制和PE的临床诊治提供新的思路以及潜在靶点。
