葡萄球菌对发酵肉制品中生物胺降解机制研究进展
2022-02-27段雨帆钟媛媛朱霄陈伟刘冬明王远亮
段雨帆 钟媛媛 朱霄 陈伟 刘冬明 王远亮
摘 要:近年来,发酵肉制品因具有营养、美味等优点而深受消费者追捧,但发酵肉中常会存在生物胺,引发人们对其安全性的关注。生物胺是一类具有生物活性的低分子含氮有机化合物,适量剂量范围的生物胺有助于人体生长、增强代谢,过量则可能导致产生过敏、腹泻、致畸甚至死亡等不良反应。本文综述葡萄球菌降低发酵肉中生物胺含量的3 种机制:生物胺氧化酶氧化、菌株产生葡萄球菌素以及与其他菌株协同作用来控制发酵肉制品中生物胺含量。通过利用葡萄球菌降胺作用,为食品中生物胺的防控与消除提供思路。
关键词:发酵肉制品;生物胺;葡萄球菌;生物胺氧化酶;降胺
Progress in Understanding the Degradation Mechanism of Biogenic Amines in Fermented Meat Products by Staphylococcus
DUAN Yufan1, ZHONG Yuanyuan1, ZHU Xiao1, CHEN Wei1, LIU Dongming1,2, WANG Yuanliang1,*
(1.College of Food Science and Technology, Hunan Agricultural University, Changsha 410125, China;
2.Weihong Food Co. Ltd., Xiangtan 411131, China)
Abstract: In recent years, fermented meat products have become very popular among consumers due to their nutritional benefits and good taste, but biogenic amines often present in fermented meat products have also triggered concerns about their safety. Biogenic amines are a class of bioactive, low-molecular nitrogen-containing organic compounds, which in the right dose range can help human growth and enhance metabolism, but excess biogenic amines can lead to adverse effects such as allergy, diarrhoea, teratogenicity and even death. This paper reviews three mechanisms by which Staphylococcus reduces biogenic amines in fermented meat: oxidative amine reduction by biogenic amine oxidase, production of staphylococcin by the strain, and synergistic effects with other strains. The amine-lowering effect of Staphylococcus will be useful for the prevention, control and elimination of biogenic amines in food products.
Keywords: fermented meat products; biogenic amines; Staphylococcus; amine oxidases; amine reduction
DOI:10.7506/rlyj1001-8123-20210803-196
中圖分类号:TS251.5 文献标志码:A 文章编号:1001-8123(2022)01-0049-07
引文格式:
段雨帆, 钟媛媛, 朱霄, 等. 葡萄球菌对发酵肉制品中生物胺降解机制研究进展[J]. 肉类研究, 2022, 36(1): 49-55. DOI:10.7506/rlyj1001-8123-20210803-196. http://www.rlyj.net.cn
DUAN Yufan, ZHONG Yuanyuan, ZHU Xiao, et al. Progress in understanding the degradation mechanism of biogenic amines in fermented meat products by Staphylococcus[J]. Meat Research, 2022, 36(1): 49-55. DOI:10.7506/rlyj1001-8123-20210803-196. http://www.rlyj.net.cn
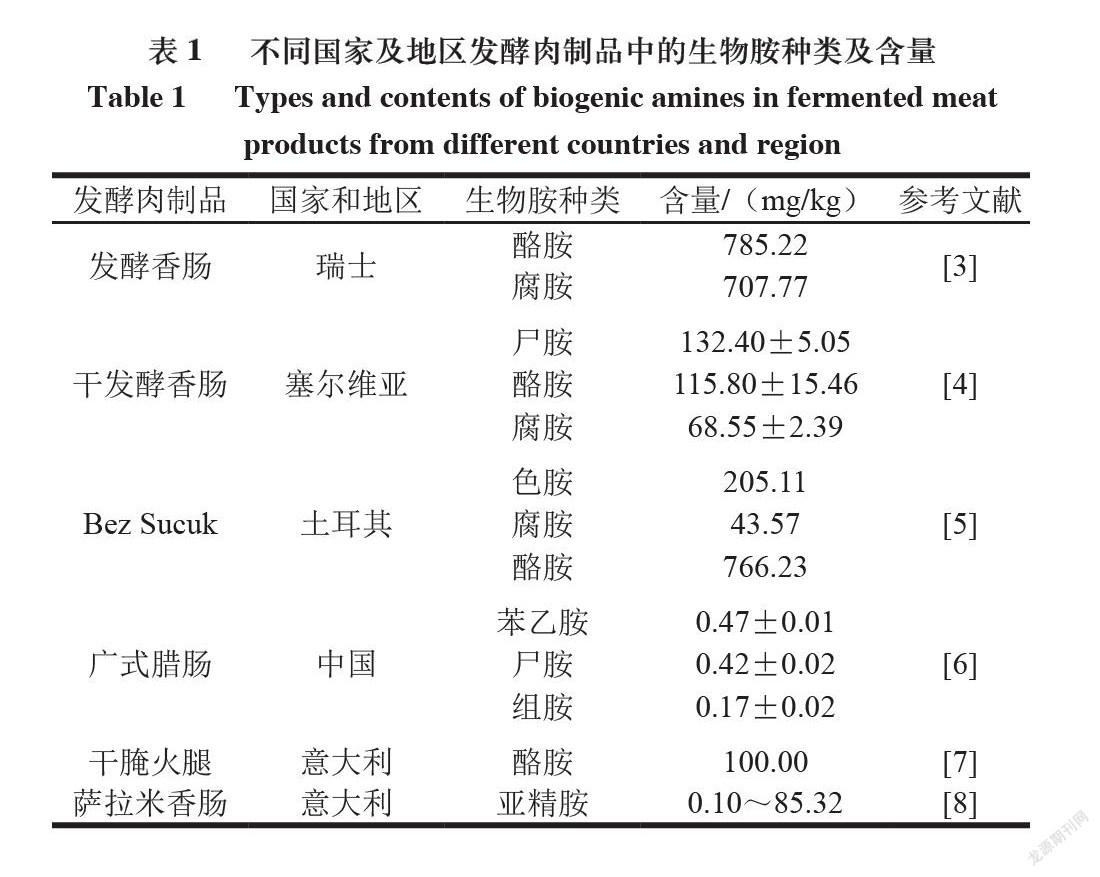
发酵肉制品深受消费者欢迎,但在发酵肉生产过程中,常会产生一定量的生物胺。目前,通过相关技术对世界各国发酵肉制品中生物胺的含量进行测定,发现产品中腐胺、酪胺、组胺和尸胺含量较高。由于不同原料、加工方式、发酵条件以及制作过程中使用的添加剂和防腐剂等因素对生物胺形成都有影响,导致不同发酵肉中生物胺含量会有显著性差异;同时,不同种类生物胺毒性差异较大,不同种族、地域和国家的人群对各种生物胺的敏感性也有所不同。目前国际上缺乏较为完善的生物胺膳食评估数据,只有少数国家对食品中的组胺作了严格限量规定。美国食品药品监督管理局规定,水产品中生物胺总量≤1 000 mg/kg、组胺含
量≤50 mg/kg、酪胺含量≤100 mg/kg;欧盟规定,食品中组胺含量≤200 mg/kg;我国GB 2733—2015《食品安全国家标准 鲜、冻动物性水产品》仅对鱼类产品中的组胺作了详细规定,其中高组胺鱼类组胺含
量≤40 mg/kg,其他海水鱼类组胺含量≤20 mg/kg。因此,国际上还缺乏一个统一的标准来规范食品中生物胺含量。已有研究发现,发酵肉中生物胺来源主要有两大途径:首先,原料肉中的蛋白质在醛或酮的转氨作用下生成脂肪族生物胺;其次,氨基酸脱羧酶阳性菌能够利用发酵肉制品中的游离氨基酸,在脱羧作用下形成与游离氨基酸相对应的胺[1]。后者是发酵肉制品中产生物胺的主要方式。研究发现,适量的生物胺有助于人体新陈代谢和免疫活性,但过量的生物胺不仅会导致食物风味劣变,而且其在人体内达到一定程度就会产生毒害作用,对机体神经系统和心脑血管系统等造成无法预计的
损伤[2]。因此,明确生物胺的形成途径,并选择恰当的方法降低发酵肉中生物胺含量尤为重要。世界不同国家及地区发酵肉制品中的生物胺种类及含量如表1所示。本文结合国内外研究报道,介绍具有降解生物胺特性的葡萄球菌菌株对发酵肉中生物胺的降解机理。
1 生物胺和葡萄球菌
1.1 生物胺
生物胺是一类含氮的脂肪族、芳香族或杂环类低分子质量有机碱,是细胞的重要组成部分,对人体有促进生长、增强代谢、提高免疫力、清除自由基等作用。最新报道发现,多胺,如胍胺在调节膜连接中发挥重要作用,此外,Galgano等[9]发现,生物胺具有调节细胞生长、组织修复、协助基因表达、调控细胞内信号传导途径和离子通道等功能。同时生物胺是多发性硬化症(multiple sclerosis,MS)发病机制中涉及的免疫系统和神经系统之间相互作用的直接介体,Melnikov等[10]发现其既可以增强也可以抑制Th17细胞功能,而Th17细胞在MS炎症性病变的发展中起核心作用,基于这一发现,靶向生物胺及其受体可作为一种新型的MS疾病改良疗法。最近,Yue Fei等[11]通过小鼠实验发现,亚精胺可激活Map 1介导的自噬,延长寿命并预防肝纤维化和肝细胞癌,就此認定亚精胺可能是一种潜在的寿命延长剂。但当生物胺出现在食品中往往会带来不利影响,如尸胺、腐胺等二胺类物质一方面能通过抑制生物胺分解酶活性,增加组胺的含量与毒性,另一方面通过结合样品中的亚硝酸盐产生具有致癌作用的亚硝胺,对机体造成一定影响[12]。
目前,主要有4 种控制生物胺的方法[13]:1)降低游离氨基酸含量;2)抑制产氨基酸脱羧酶菌株的生长;3)抑制氨基酸脱羧酶活性;4)提高生物胺的降解率。控制生物胺的形成主要可以通过改变外界环境条件实现,而利用具有胺氧化酶活性的微生物菌株是降解已生成生物胺的有效途径[14]。
生物胺通常是由蛋白质或游离氨基酸在微生物脱羧酶或脱亚胺酶的作用下通过一系列生化反应产生,如氨基酸脱羧作用或醛和酮的氨基化作用、转氨作用[15]。脱羧酶主要通过去除羧基来形成相应的胺类和二氧化碳,再选择性作用于特定氨基酸;脱亚胺酶也是参与生物胺生物合成的酶之一,主要与腐胺的形成有关。食品中生物胺的形成主要是通过脱羧酶途径[16]。组氨酸(His)、酪氨酸(Tyr)、苯丙氨酸(Phe)和赖氨酸(Lys)在脱羧酶的作用下分别形成组胺、酪胺、苯乙胺和尸胺等生物胺;而腐胺、胍丁胺、亚精胺等多胺可以通过多种途径合成,如鸟氨酸和胍丁胺可作为腐胺的直接前体物质,精氨酸则可作为间接前体物质,在精氨酸脱亚胺酶和精氨酸酶的作用下,通过水解作用转化为鸟氨酸或经脱羧反应生成胍丁胺后合成腐胺[17]。精胺则是由腐胺、亚精胺等前体物质在亚精胺合成酶、精胺合成酶的作用下产生。生物胺合成除需要有相对应的氨基酸作为前体物质和具有氨基酸脱羧酶的微生物外,还需要适宜的外部环境条件来满足含氨基酸脱羧酶的微生物生长以及氨基酸脱羧酶合成[18]。
1.2 葡萄球菌
葡萄球菌是一种在显微镜下呈不规则葡萄串状的革兰氏阳性菌,极少数致病型耐药菌株呈革兰氏阴性;葡萄球菌是一种无鞭毛、不活动、不具有芽孢的兼性厌氧细菌,具有高度的耐盐性(大多数葡萄球菌可在质量浓度0.1 g/mL的氯化钠环境中存活)。截至2018年,已鉴定的葡萄球菌属包括54 个种和27 个亚种[19]。食品中通常存在3 种葡萄球菌:肉葡萄球菌、木糖葡萄球菌和马葡萄球菌,根据它们的遗传特征与产生物胺含量研究,认定可以单独或与其他微生物结合用作工业发酵过程中的发酵剂,特别是用于生产奶酪和发酵肉[20]。在目前已知的诸多降胺方法中,添加发酵剂也被认为是最有效的方法之一。添加到发酵香肠中以减少生物胺含量的发酵剂菌株,通常是不含有氨基酸脱羧酶的安全菌株。这些菌株能够很好地适应香肠中的环境,并抑制产胺菌的生长。作为发酵肉制品中的优势菌种,葡萄球菌在减少样品中生物胺含量的同时,还具有硝酸盐还原酶活性以及较强的脂肪和蛋白质分解能力,给发酵肉带来良好色泽的同时还赋予产品温润的口感,在满足消费者对发酵肉制品食用安全性要求的同时,也有助于提高产品的感官品质。
葡萄球菌作为降胺发酵剂添加到发酵肉中,除需要保障产品安全性及符合发酵条件外,还应不产胺或产胺能力极弱。已有大量实验证明,肉葡萄球菌不具备产生某些生物胺,如尸胺、腐胺、色胺、酪胺和组胺等的能力,虽然有极少数肉葡萄球菌菌株会通过脱羧作用由苯丙氨酸产生苯乙胺,苯乙胺是胺类的前体氨基酸,但产生苯乙胺的含量低于欧盟法典中规定的除水产品以外其他食品(包括肉制品)的允许含量(<30 mg/kg)。Kanjan等[21]通过薄层色谱及基于聚合酶链式反应的方法从相应的氨基酸中检测拟葡萄球菌PMRS35形成生物胺的可能性,发现拟葡萄球菌PMRS35既不会产生组胺、酪胺等,也不含有这几种胺合成的相关基因。Jeong等[22]研究发现:琥珀葡萄球菌分离株在实验室环境中培养一段时间,其分离物不产生组胺;此外,琥珀葡萄球菌分离株的基因组测序结果表明,所有分离株都缺少产生组胺、腐胺和酪胺所需的基因。尽管一些菌株中鉴定出了产生尸胺所需的赖氨酸脱羧酶编码基因,但在添加过量前体的培养基中,分离株的尸胺产量平均值为75.1 mg/kg,表明前体受到限制,尸胺产量非常低,所造成的危害性很小[23]。Ansorena等[24]在使用木糖葡萄球菌作为发酵剂生产的香肠中没有检测到2-苯乙胺、腐胺、组胺和色胺。因此,利用葡萄球菌作为肉制品发酵剂来降低产品中生物胺含量是一种可行、有效的方法。
2 葡萄球菌降胺机制
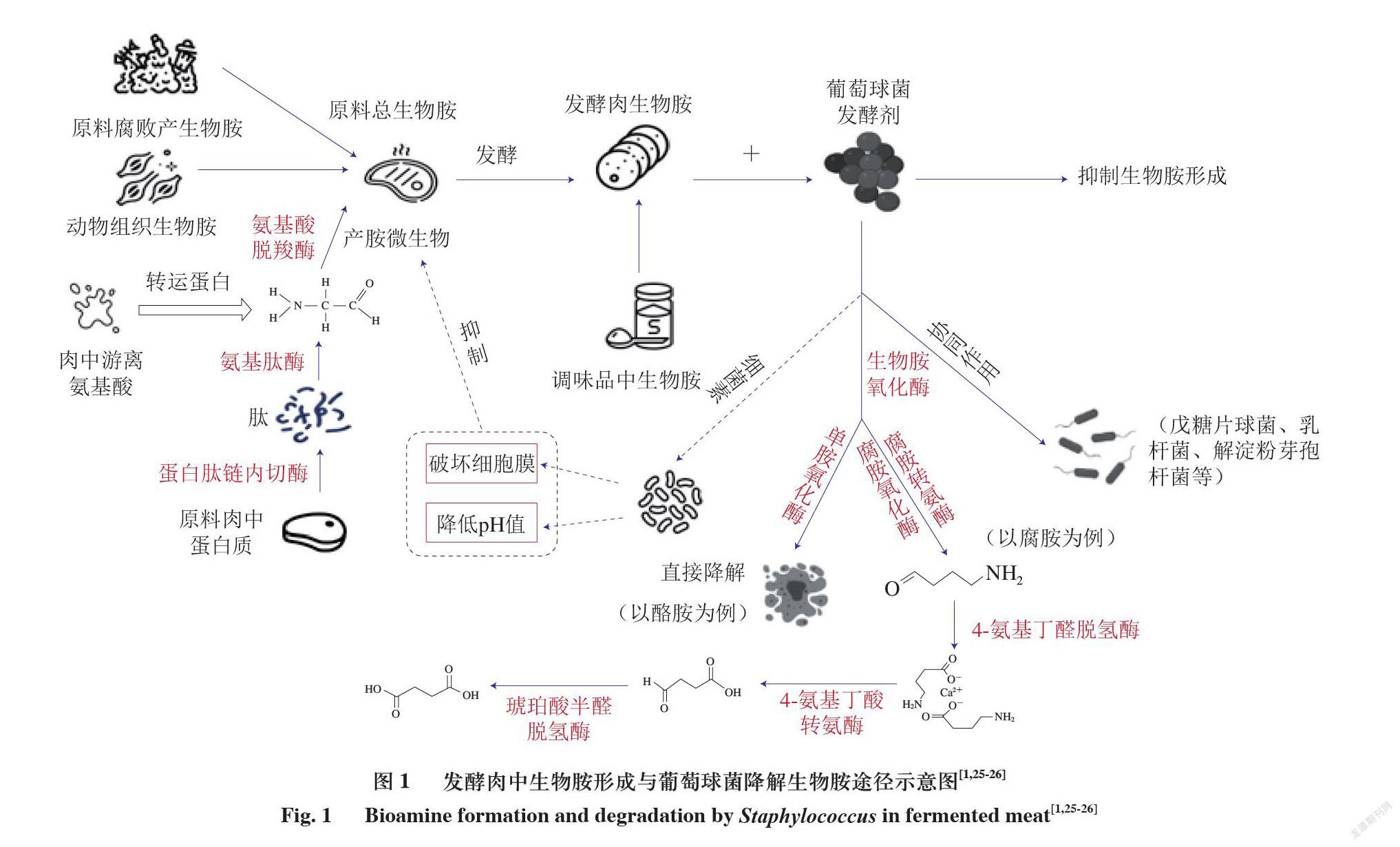
随着研究的深入,大量研究表明,肉制品中的葡萄球菌具有降低发酵肉制品中生物胺含量的作用,其途径主要有3 种:1)葡萄球菌具有生物胺氧化酶,可以将生物胺氧化成醛、氨和H2O2等物质,从而达到降胺的效果;
2)葡萄球菌可以产生葡萄球菌素,葡萄球菌素作为一种细菌素具有抑制或杀灭产胺菌的能力,可以从根本上抑制生物胺的产生;3)葡萄球菌可以与其他菌株产生协同作用,更好地发挥降胺效果。因此可以考虑将通过安全性评价且符合发酵剂条件的葡萄球菌作为肉品发酵剂使用。在诸多降胺方法中,添加发酵剂也被认为是最有效的方法之一。图1为发酵肉生物胺来源与形成以及利用葡萄球菌作为发酵剂降解生物胺的途径示意图[1,25-26]。
2.1 生物胺氧化酶氧化降胺
已有研究报道,根据辅基类型不同,具有生物胺降解作用的主要有3 种酶:胺氧化酶、胺脱氢酶及多铜氧化酶。胺氧化酶具有较强的底物特异性,可以针对性地降低发酵肉中生物胺含量。胺氧化酶最早由Yamada等[27]在黑曲霉中发现,该研究报道,当菌株在以单胺或二胺作为单一氮源的培养基上生长时,在真菌菌丝体中可以形成一种铜胺氧化酶,该酶在磷酸盐缓冲液中可保持其活性,在pH 6.0~7.0、温度35 ℃时稳定存在,但温度一旦超过40 ℃其结构就被迅速破坏。之后,Sekiguchi等[28]从成晶节杆菌KAIT-B-007中分离纯化出具有热稳定性的组胺氧化酶,通过研究其酶学特性,根据原子吸收光谱结果显示,每摩尔该酶含有1 个Cu2+,并证明Cu2+对组胺氧化酶的活性有重要影响。
生物胺氧化酶属于氧化还原酶类,是一种能够氧化生物胺的特殊蛋白质。微生物学中根据辅助因子的不同将生物胺氧化酶分为2 类:一种是含铜的胺氧化酶,另一种是含黄素的胺氧化酶[29]。根据氧化生物胺氨基数目不同又可以分为单胺氧化酶(monoamine oxidase,MAO)、二胺氧化酶(diamine oxidase,DAO)和多胺氧化酶(polyamine oxidase,PAO)等。MAO多属于含铜的氧化酶,由于最先发现的MAO以酪胺为底物,因此又叫酪胺氧化酶;DAO主要可对组胺和腐胺产生氧化作用,可用调节它们在组织中的水平;PAO是指所有能氧化多胺类物质的酶,是催化多胺氧化降解的主要酶[30]。PAO不同于MAO与DAO,可以降解多种生物胺,如精胺、亚精胺与腐胺,因此利用PAO来降解发酵肉制品中生物胺的应用前景十分可观。菌株降解1 种以上生物胺的能力可能是由于菌株中同时含有几种胺氧化酶[31],目前已发现葡萄球菌属中的木糖葡萄球菌可产生组胺氧化酶和酪胺氧化酶,肉葡萄球菌可产生组胺氧化酶及MAO等,也证实了这一说法。胺氧化酶主要通过2 种方式降解发酵肉中的生物胺:一种是利用MAO直接将生物胺降解成小分子物质,如酪胺等;另一种是肉制品中各种生物胺都有与之相对应的胺氧化酶,生物胺在胺氧化酶与其他酶共同作用下,通过一系列的生化反应转化为相应的盐类,如在腐胺氧化酶与腐胺转氨酶的共同作用下可将腐胺转化为4-氨基丁醛,4-氨基丁醛再在4-氨基丁醛脱氢酶作用下转化为4-氨基丁酸,4-氨基丁酸通过氨转移酶和脱氢酶的作用形成琥珀酸盐,从而达到代谢腐胺的目的[32]。
已有研究发现,发酵食品中含有生物胺氧化酶的微生物通常是乳酸菌属与葡萄球菌属中的某些菌种,如植物乳杆菌、木糖葡萄球菌、肉葡萄球菌等。Leuschner等[33]
报道,葡萄球菌属中的鼠尾草葡萄球菌菌株不具有胺降解酶活性,该结果也表明菌的胺降解活性不是物种特异性的,而是菌株基因水平特异性的。Martuscelli等[26]从意大利香肠中分离出50 株具有降解生物胺性状的木糖葡萄球菌,菌株中的S79、S81、S90、S206组胺氧化酶活性尤为显著,可以降低组胺含量,降幅达100%。马宇霞等[34]
对不同熏马肠样品中的44 株产生物胺氧化酶菌株进行分离与筛选,筛选出具有氧化酶特性和对金黄色葡萄球菌、李斯特菌及大肠杆菌3 种致病菌有良好抑制活性的菌株,且耐盐性和耐亚硝酸盐性强,在使用变性梯度凝胶电泳排除重复菌株后,通过高效液相色谱(high performance liquid chromatography,HPLC)法测定其减少生物胺的能力,最终,利用16S rDNA的V6~V8序列进行聚合酶链式反应扩增和测序后,发现菌株中腐生葡萄球菌和木糖葡萄球菌满足要求,可产生物胺氧化酶。邓红梅等[35]
通过培养基显色法和氧化酶实验相结合,从发酵香肠中分离产生物胺氧化酶的优势菌,并利用HPLC检测产生物胺氧化酶菌株对生物胺的氧化降解能力,最终获得4 株符合发酵菌株标准并产生物胺氧化酶的葡萄球菌;通过16S rDNA分子鉴定,确定上述4 株发酵菌株中有3 株模仿葡萄球菌和1 株表皮葡萄球菌,其中模仿葡萄球菌可显著降低多种生物胺含量。利用含生物胺氧化酶的微生物来防止食品中生物胺的合成和累积并对食品中已存在的生物胺进行降解,对发酵食品的加工工艺以及营养和风味影响甚微,是控制发酵食品中生物胺含量最有效的方法之一。但目前针对生物胺氧化酶的应用主要在于其作为活性物质对动植物生理、病理学方面的治疗功效,很少直接将其运用于食品发酵工艺中,也缺乏对生物胺氧化酶的酶学性质与应用特性的深入研究。
2.2 葡萄球菌产生细菌素抑制其他产胺菌
细菌素是一种由细菌产生的抗生代谢产物,多是蛋白或多肽类化合物,主要由某些细菌的核糖体合成。细菌素的抑菌机制主要是为细菌素产生菌提供相对于其他菌株的生存优势[36]。1885年,某些葡萄球菌菌株在固体培养基上能抑制其他葡萄球菌生长这一现象被Babes发现,但由于当时研究条件有限,并未对此作出科学的解释;直到1946年,由葡萄球菌产生的细菌素才正式被定义为葡萄球菌素[37]。并非所有的葡萄球菌菌株都具有产细菌素能力,但有的葡萄球菌又可以产生一种或多种葡萄球菌素。葡萄球菌产细菌素的能力取决于菌株基因组中细菌素基因簇是否完整表达。迄今为止,主要的葡萄球菌素产生菌包括表皮葡萄球菌及金黄色葡萄球菌。大部分葡萄球菌素在抵抗细菌,包括一些病原菌方面具有广谱性。由于葡萄球菌素具有殺死竞争菌并与免疫系统相互作用的能力,认为产葡萄球菌素是葡萄球菌作为益生菌的特性。
發酵肉制品中最常见的生物胺主要是腐胺和尸胺,组胺是最重要且毒性最大的生物胺之一,发酵肉制品中的生物胺氧化酶主要由脱羧酶阳性菌产生,主要有假单胞菌属、肠杆菌属、酵母菌、乳酸菌和肠球菌属等。组胺含量取决于弧菌属、发光杆菌属、克雷伯氏菌属和莫尔甘内拉氏菌属微生物[38],酪胺主要与肉毒杆菌、肠球菌和弯曲乳杆菌有关,而腐胺和尸胺主要与肠球菌有关[39]。
这些微生物可能存在于原料和环境中,对生物胺的产生起着关键作用[40]。李宗军[41]研究不同碳源对传统酸肉菌群结构与生物胺含量的影响,发现腐胺和尸胺主要由肠杆菌中的阴沟肠杆菌、沙雷氏菌产生,酪胺的生成主要与肠球菌有关。Mah等[42]从314 株菌株中筛选出不具有产生物胺能力的木糖葡萄球菌0538,发现其不仅具有降解组胺的能力,而且在体外具有细菌素抑菌活性,可以抑制地衣芽孢杆菌(一种产胺菌)的活性,且其在含有0.5 mmol/L组胺和0.5 mmol/L酪胺的磷酸盐缓冲液中,24 h可以降解38.0%组胺和4.4%酪胺。Sandiford等[43]
发现,表皮葡萄球菌素NI01在一定浓度范围内对金黄色葡萄球菌、肠球菌等具有强大的抗菌活性,通过抑制产胺菌的生理活性起降胺作用。Fagundes等[44]从葡萄球菌3682中发现的细菌素Hyicin 3682不仅具有广谱抗菌特性,而且在食品中具有潜在的防腐作用,可以延缓食品腐败、减少食源性疾病的发生。目前已有研究表明,产细菌素的乳酸菌可用于防止香肠中病原菌生长[45],为之后利用葡萄球菌素抑制产胺菌的生长、降低发酵肉中的生物胺含量提供了参考。但目前利用葡萄球菌产生的细菌素来抑制其他产胺菌生长的具体研究还十分有限,需要进一步的探究。
2.3 葡萄球菌协助其他菌株降胺
Zaman等[46]测定鱼露中组胺、腐胺和尸胺含量,并对从样品中分离的细菌胺降解活性进行评价。结果表明,33 株细菌分离株中,8 株具有降胺能力的菌株被进一步鉴定和评估,其中解淀粉芽孢杆菌FS-05和肉葡萄球菌FS-19对组胺的降解率分别为59.9%和29.1%,中间葡萄球菌FS-20和枯草芽孢杆菌FS-12对腐胺和尸胺的降解率分别可达30.4%和28.9%以上。高文霞等[47]发现,添加木糖葡萄球菌有助于戊糖片球菌进一步降低萨拉米香肠中生物胺的含量,较以单一戊糖片球菌作为发酵剂,组胺含量多降低14.55%,与不添加发酵剂组相比组胺含量降低32.20%。谭李红等[48]通过测定发酵香肠中酪胺和色胺含量,进一步证实复合发酵剂降解生物胺效果更佳,通过结合微生物菌落计数结果发现,木糖葡萄球菌主要通过抑制乳酸菌及其他杂菌的繁殖,从而为戊糖片球菌提供了适宜的生存环境,更加有利于其降解生物胺作用。Lu Shiling等[49]发现,在发酵香肠中使用费氏乳杆菌与腐生葡萄球菌组成的复配发酵剂,对组胺、腐胺、尸胺和酪胺的产生均有明显抑制作用。孙钦秀等[50]将植物乳杆菌、木糖葡萄球菌作为发酵剂接种至香肠中,发现部分产生物胺的微生物,如肠杆菌丰度显著降低,直接减少了香肠中生物胺(酪胺、腐胺、尸胺、组胺、
2-苯乙胺和色胺)的含量,对硫代巴比妥酸反应物值等指标也有影响,进一步证明木糖葡萄球菌在保证样品安全性的同时,还能促进风味物质的形成,得到高品质的风干香肠。朱志远等[51]将香肠乳杆菌、肉葡萄球菌和肠膜明串珠菌3 种发酵剂以不同的组合方式接种到香肠中,发现香肠乳杆菌和肉葡萄球菌共同发酵香肠后,可以有效抑制色胺、腐胺、尸胺、组胺的生成;添加肠膜明串珠菌和肉葡萄球菌可以降低香肠中苯乙胺和酪胺含量,且这2 种组合方式的复合发酵剂降胺效果均优于单独使用肉葡萄球菌作为发酵剂。Xie Chong等[52]将木糖葡萄球菌与植物乳杆菌作为发酵剂添加入香肠中,发现单独添加木糖葡萄球菌能降低酪胺、组胺和尸胺含量,降幅分别为21%、25%、22%,而接种混合发酵剂可以彻底降解苯乙胺和色胺以及86%腐胺、82%组胺、63%尸胺和43%酪胺。
3 结 语
生物胺已经成为肉制品中无法避免的一类风险物质,严格控制肉制品中生物胺的含量对于保障人体健康具有重要意义。控制发酵过程中相关的各种因素是降低生物胺含量的有力保障,利用微生物作为发酵剂来抑制发酵肉中的生物胺是近年来最有效的方法之一。葡萄球菌属中的木糖葡萄球菌、肉葡萄球菌等作为发酵肉制品中的优势菌种,不仅有利于发酵肉的风味、色泽,而且对人体安全无害,因此成为降解发酵肉中生物胺的首要选择,但是降解过程中胺氧化酶的催化机理以及与生物胺的结合位点仍有待进一步研究。为扩大发酵剂菌株在食品产业的应用前景和技术优势,开发各种新型优良发酵剂以及各种混合发酵剂来全面、高效地降低发酵肉生物胺含量将成为今后的研究热点。目前的研究主要集中于降胺菌株的最佳作用条件及降解效率,忽视了与发酵产品总体环境的协调性;此外,从实验室研发到真正将这些降胺菌株应用于发酵食品生产这一过程的实现也仍需要考虑和探索。同时,目前我国乃至世界各国都缺乏对发酵肉制品中生物胺的详细限量标准,急需科研人员在此方面开展系统研究,制定不同生物胺的限量。同时依据风险评定结果,建立合理的监测限量体系,规范生产管理,降低生物胺含量,提高产品质量和安全性,保障消费者身体健康。
参考文献:
[1] GARDIN F, OZOGUL Y, SUZZI G, et al. Technological factors affecting biogenic amine content in foods: a review[J]. Frontiers in Microbiology, 2016, 7: 14-27. DOI:10.3389/fmicb.2016.01218.
[2] SHALABY A R. Significance of biogenic amines to food safety and human health[J]. Meat Research, 2005, 29(7): 675-690. DOI:10.1016/S0963-9969(96)00066-X.
[3] ANDEREGG J, FISCHER M, DURIG J, et al. Detection of biogenic amines and tyramine-producing bacteria in fermented sausages from Switzerland[J]. Journal of Food Protection, 2020, 83(9): 342-365. DOI:10.4315/JFP-19-468.
[4] SUVAJDZIC B, TASI T, TEODOROVI V, et al. Biogenic amine content during the production and ripening of Sremski kulen, Serbian traditional dry fermented sausage[J]. Animal Science Journal, 2020, 91(1): 227-236. DOI:10.1111/asj.13466.
[5] CIEK T K. Biogenic amine formation in “Bez Sucuk”, a type of Turkish traditional fermented sausage produced with different meat: fat ratios[J]. Korean Journal for Food Science of Animal Resources, 2018, 38(1): 152-161. DOI:10.5851/kosfa.2018.38.1.152.
[6] 劉兰, 韩静, 杜宝, 等. 市售肉制品理化指标、生物胺及风味物质的测定[J]. 食品工业, 2018, 39(6): 283-287.
[7] VIRGILI L, SACCANI G, GABBA L, et al. Changes of free amino acids and biogenic amines during extended ageing of Italian dry-cured ham[J]. LWT-Food Science and Technology, 2006, 40(5): 871-878. DOI:10.1016/j.lwt.2006.03.024.
[8] ROSELINO M N, MACIEL L F, SIROCCHI V, et al. Analysis of biogenic amines in probiotic and commercial salamis[J]. Journal of Food Composition and Analysis, 2020, 94: 103649. DOI:10.1016/j.jfca.2020.103649.
[9] GALGANO F, CARUSO M, CONDELLI N, et al. Focused review: agmatine in fermented foods[J]. Frontiers in Microbiology, 2012, 3(13): 199-211. DOI:10.3389/fmicb.2012.00199.
[10] MELNIKOV M, ROGOVSKII V, BOYKO A, et al. The influence of biogenic amines on Th17-mediated immune response in multiple sclerosis[J]. Multiple Sclerosis and Related Disorders, 2018, 21: 19-23.
DOI:10.1016/j.msard.2018.02.012.
[11] YUE Fei, LI Wenjiao, ZOU Jing, et al. Spermidine prolongs lifespan and prevents liver fibrosis and hepatocellular carcinoma by activating MAP1S-mediated autophagy[J]. Cancer Research, 2017, 77(11): 1-14. DOI:10.1158/0008-5472.CAN-16-3462.
[12] PRADENAS J, GALARCE-BUSTOS O, HENRÍQUEZ-AEDO K,
et al. Occurrence of biogenic amines in beers from Chilean market[J]. Food Control, 2016, 70: 138-144. DOI:10.1016/j.foodcont.2016.05.043.
[13] PAPAGEORIGIO M, LAMBROPOLOU D, MORRISON C, et al.
Literature update of analytical methods for biogenic amines determination in food and beverages[J]. Trends in Analytical Chemistry, 2018, 98: 128-142. DOI:10.1016/j.trac.2017.11.001.
[14] ARENA M E, LANFETE J M, MANCA M C, et al. Factors affecting the production of putrescine from agmatine by Lactobacillus hilgardii XB isolated from wine[J]. Journal of Applied Microbiology, 2008, 105(1): 158-165. DOI:10.1111/j.1365-2672.2008.
[15] BENKERROUM N. Biogenic amines in dairy products: origin, incidence, and control means[J]. Comprehensive Reviews in Food Science and Food Safety, 2016, 15(4): 72-85. DOI:10.7506/spkx1002-6630-20210221-229.
[16] 刘亚楠, 李欢, 陈剑, 等. 水产品生物胺检测技术研究进展[J].
食品科学, 2021, 42(15): 269-277. DOI:10.7506/spkx1002-6630-20210221-229.
[17] STAVROPOULOU D, DE V L, LEROY F. Nonconventional starter cultures of coagulase-negative staphylococci to produce animal-derived fermented foods, a SWOT analysis[J]. Journal of Applied Microbiology, 2018, 125: 1570-1586. DOI:10.1111/jam.14054.
[18] 陈亚杰, 张香美, 卢涵, 等. 有益葡萄球菌对发酵肉制品品质影响[J]. 肉类工业, 2019(2): 40-43.
[19] 卢延. 葡萄球菌在家蚕肠道中的种群分布、系统发育及相关病理和生理作用的研究[D]. 重庆: 西南大学, 2020: 23-24. DOI:10.27684/d.cnki.gxndx.2020.003352.
[20] MULLER A, REICHARDT R, FOGARASSY G, et al. Safety assessment of selected Staphylococcus carnosus strains with regard to their application as meatstarter culture[J]. Food Control, 2016, 66:
93-99. DOI:10.1016/j.foodcont.2016.01.042.
[21] KANJAN P, SAKPETCH P. Functional and safety assessment of Staphylococcus simulans PMRS35 with high lipase activity isolated from high salt-fermented fish (Budu) for starter development[J]. LWT-Food Science and Technology, 2020, 124: 324-341. DOI:10.1016/j.lwt.2020.109183.
[22] JEONG D W, LEE B, HER J Y, et al. Safety and technological characterization of coagulase-negative staphylococci isolates from traditional Korean fermented soybean foods for starter development[J]. International Journal of Food Microbiology, 2016, 236: 9-16. DOI:10.1016/j.ijfoodmicro.2016.07.011.
[23] MEGAW J, GILMORE B F. Draft genome sequence of Staphylococcus succinus strain CSM-77, a moderately halophilic bacterium isolated from a triassic salt mine[J]. Genome Announcements, 2016, 4(3):
412-423. DOI:10.1128/genomeA.00532-16.
[24] ANSORENA D, MONTEL M C, ROKKA M, et al. Analysis of biogenic amines in northern and southern European sausages and role of flora in amine production[J]. Meat Science, 2002, 61(2): 141-147. DOI:10.1016/S0309-1740(01)00174-7.
[25] 曲映紅. 发酵食品中生物胺的研究进展[J]. 食品工业, 2012, 33(3): 115-119.
[26] MARTUSCELLI M, CRUDELE M A, GARDINI F, et al. Biogenic amine formation and oxidation by Staphylococcus xylosus strains from artisanal fermented sausages[J]. Letters in Applied Microbiology, 2000, 31(3): 228-232. DOI:10.1046/j.1365-2672.2000.00796.x.
[27] YAMADA H, ADACHI O, OGATA K. Amine oxidases of microorganisms: part I. Formation of amine oxidase by fungi[J]. Agricultural and Biological Chemistry, 1965, 29(2): 117-123. DOI:10.1080/00021369.1965.10858487.
[28] SEKIGUCHI Y, MAKITA H, YAMAMURA A, et al. A thermostable histamine oxidase from Arthrobacter crystallopoietes KAIT-B-007[J]. Journal of Bioscience and Bioengineering, 2004, 97(2): 104-110. DOI:10.1016/S1389-1723(04)70176-0.
[29] 徐洁. 降生物胺多铜氧化酶的异源表达及性质研究[D]. 无锡: 江南大学, 2019: 11-13.
[30] 李彬彬, 徐晔, 牛淑慧, 等. 食品中生物胺含量及生物胺氧化酶的研究进展[J]. 食品科学, 2019, 40(1): 341-347. DOI:10.7506/spkx1002-6630-20171205-054.
[31] CALLEJON S, SENDRY R, FERRER S, et al. Recombinant laccase from Pediococcus acidilactici CECT 5930 with ability to degrade tyramine[J]. PLoS ONE, 2017, 12(10): 145-158. DOI:10.1371/journal.pone.0186019.
[32] FOSTER A, BARNES N, SPEIGHT R, et al. Genomic organisation, activity and distribution analysis of the microbial putrescine oxidase degradation pathway[J]. Systematic and Applied Microbiology, 2013, 36(7): 457-466. DOI:10.1016/j.syapm.2013.06.008.
[33] LEUSCHNER R G, HAMMES W P. Tyramine deg-radation by micrococci during ripening of fermented sausages[J]. Meat Science, 1998, 49(3): 289-296. DOI:10.1016/s0309-1740(97)00124-1.
[34] 马宇霞, 卢士玲, 李开雄, 等. 熏马肠中生物胺氧化酶菌株的筛选与鉴定[J]. 现代食品科技, 2014(5): 49-55.
[35] 邓红梅, 卢士玲, 李开雄. 传统中式香肠中产生物胺氧化酶菌的分离鉴定[J]. 食品与发酵工业, 2012(2): 57-60.
[36] BASTOS M C F, CEOTTO H, COELHO M L V, et al. Staphylococcal anti-microbial peptides: relevant properties and potential biotechnological applications[J]. Current Pharmaceutical Biotechnology, 2009, 10: 38-61. DOI:10.2174/138920109787048580.
[37] WANG D, YAMAKI S, KAWAI Y, et al. Histamine production behaviors of a psychrotolerant histamine-producer,morganella psychrotolerans in various environmental conditions[J]. Current Microbiology, 2020, 77(3): 460-467. DOI:10.1007/s00284-019-01853-y.
[38] VAN DER VEKEN D, BENHACHEMI R, CHARMPI C, et al. Exploring the ambiguous status of coagulase-negative staphylococci in the biosafety of fermented meats: the case of antibacterial activity versus biogenic amine formation[J]. Microorganisms, 2020, 8(2): 167. DOI:10.3390/microorganisms8020167.
[39] 李新福. 培根加工及貯藏过程中腐败菌变化、鉴定及控制[D].
无锡: 江南大学, 2019: 21-22. DOI:10.27169/d.cnki.gwqgu.2019.000042.
[40] LI Binbin, LU Shiling. The importance of amine-degrading enzymes on the biogenic amine degradation in fermented foods: a review[J]. Process Biochemistry, 2020, 99: 331-339. DOI:10.1016/j.procbio.2020.09.012.
[41] 李宗军. 不同碳源对传统酸肉中微生物菌群和生物胺的影响[J].
食品工业科技, 2006, 31(5): 78-81; 84. DOI:10.3969/j.issn.1002-0306.2006.05.024.
[42] MAH J, HWANG H. Inhibition of biogenic amine formation in a salted and fermented anchovy by Staphylococcus xylosus as a protective culture[J]. Food Control, 2009(20): 796-801. DOI:10.1016/j.foodcont.2008.10.005.
[43] SANDIFORD S, UPTON M. Identification, characterization, and recombi-nant expression of epidermicin NI01, a novel unmodified bacteriocin produced by Staphylococcus epidermidis that displays potent activity against staphylococci[J]. Antimicrobial Agents and Chemotherapy, 2012, 56(3): 1539-1547. DOI:10.1128/AAC.05397-11.
[44] FAGUNDES P C, CEOTTO H, POTTER A, et al. Hyicin 3682, a bioactive peptide produced by Staphylococcus hyicus 3682 with potential applications for food preservation[J]. Research in Microbiology, 2011, 162(10): 374-397. DOI:10.1016/j.resmic.2011.10.002.
[45] LARANJO M, POTES M E, ELIAS M. Role of starter cultures on the safety of fermented meat products[J]. Frontiers in Microbiology, 2019, 10: 167-178. DOI:10.3389/fmicb.2019.00853.
[46] ZAMAN M Z, BAKAR F A, SELAMT J. Occurrence of biogenic amines and amines degrading bacteria in fish sauce[J]. Czech Journal of Food Sciences, 2010, 28: 440-449. DOI:10.1080/19476330903450282.
[47] 高文霞, 孫宝忠, 杨军. 发酵剂菌种对干发酵香肠组胺形成及其含量的影响[J]. 肉类研究, 2007, 21(2): 33-35.
[48] 谭李红, 夏文水, 张春晖. 一种混合发酵剂对干发酵香肠中生物胺含量的影响[J]. 食品工业科技, 2005(6): 90-91; 95. DOI:10.3969/j.issn.1002-0306.2005.06.023.
[49] LU Shiling, XU Xinglian, ZHOU Guanghong, et al. Effect of starter cultures on microbial ecosystem and biogenic amines in fermented sausage[J]. Food Control, 2010, 21: 444-449. DOI:10.1016/j.foodcont.2009.07.008.
[50] 孙钦秀, 张潮, 赵欣欣, 等. 接种发酵剂对哈尔滨风干肠中生物胺形成的抑制作用[J]. 中国食品学报, 2019, 19(2): 199-205. DOI:10.16429/j.1009-7848.2019.02.025.
[51] 朱志远, 徐幸莲, 李虹敏, 等. 不同发酵剂对发酵香肠生物胺含量的影响[J]. 食品与发酵工业, 2009, 35(8): 133-137.
[52] XIE Chong, WANG Huhu, NIE Xiaokai, et al. Reduction of biogenic amine concentration in fermented sausage by selected starter cultures[J]. CyTA-Journal of Food, 2015, 13(4): 491-497. DOI:10.1080/19476337.2015.1005027.
