miR-3175/SIX5轴调节神经胶质瘤细胞的增殖和迁移
2022-02-25吕旭阳孙江川董玥胡林峰钱颖范春雷田男
吕旭阳 孙江川 董玥 胡林峰 钱颖 范春雷 田男
浙江中医药大学生命科学学院分子医学研究所 杭州 310053
神经胶质瘤(以下简称胶质瘤)是中枢神经系统最常见和最具破坏性的原发性肿瘤,其发病率约占恶性脑肿瘤的80%[1]。目前治疗以手术切除为主,术后配合放化疗,但患者预后仍不理想,5年生存率仅为10%[2]。基因治疗、免疫治疗等虽然表现出良好前景[3-4],但是分子标志物和干预靶点的筛选是其影响临床应用的关键前提。
微小RNA(microRNA,miRNA)是一类由21~23个核苷酸组成的小分子非编码单链RNA,通常经由下游靶基因参与肿瘤的发生发展[5-6]。miR-3175定位于人类15染色体长臂的26.1区,研究显示其表达异常与多种肿瘤的发生发展密切相关,包括前列腺癌[7]、胃癌[8]和肺癌[9]等。前期研究发现,miR-3175在胶质瘤细胞内表达异常。生物信息学分析进一步发现,miR-3175可能通过调控sineoculis同源异型盒同源物5(sineoculis homeobox homologue 5,SIX5)的表达来干预胶质瘤的恶性生物学行为。SIX5是SIX家族蛋白的一个成员,该家族是一组进化保守的转录因子[10],在肿瘤的发生发展中具有重要作用。Liu等[11]研究发现,SIX5在非小细胞肺癌组织中表达水平明显高于正常肺组织。然而,目前胶质瘤中miR-3175与SIX5的靶向调控机制尚未明确。因此,本研究旨在进一步研究miR-3175调控SIX5表达,从而影响胶质瘤细胞恶性生物学行为的可能机制,为诊断及治疗胶质瘤提供新的研究方向。
1 材料和方法
1.1 细胞 人胶质瘤细胞系A172、U251和人正常胶质细胞系HA-1800购于中国科学院上海生命科学研究所细胞资源中心。
1.2 主要试剂和仪器 胎牛血清(fetal bovine serum,FBS)购于北京四季青生物科技有限责任公司(批号:19030603);青-链霉素溶液购于吉诺生物医药技术有限公司(批号:70091000);杜尔伯克改良伊格尔培养基(Dulbecco modified Eagle medium,DMEM)和0.25%胰酶+0.02%乙二胺四乙酸(ethylene diamine tetra acetic acid,EDTA)溶液均购于天津灏洋生物制品科技有限责任公司(批号:2021060102、20210428);β-actin抗体购于杭州华安生物技术有限公司(批号:HM1127);SIX5抗体购于武汉三鹰生物技术有限公司(批号:00017408);脂质体(Lipofetamine)2000转染试剂和总RNA提取试剂(total RNA extraction reagent,TRIzol) 均购于美国Invitrogen公司(批号:2067406、135404);噻唑蓝(3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)粉末购于北京索莱宝科技有限公司(批号:715F05029);RNaseA、逆转录试剂盒和Ultra SYBR均购于北京康为世纪生物科技有限公司(批号:50423、30251、30237);Transwell小室购于美国Corning Costar公司(批号:01020023);细胞凋亡与坏死检测试剂盒购自上海碧云天生物技术有限公司(批号:C1062L)。
TE2000型荧光倒置显微镜购于日本Nikon公司;Fresco 21高速冷冻离心机和3111型二氧化碳培养箱均购于美国Thermo Fisher公司;Guava easyCyte 8型流式细胞仪为美国EMD Millipore公司产品;qTOWER3G IVD型荧光定量PCR仪购于德国耶拿分析仪器股份有限公司。
1.3 方法
1.3.1 细胞培养与转染 细胞培养选用含10%FBS、100 U·mL-1青霉素和100 μg·mL-1链霉素的DMEM培养基,所有细胞均置于5% CO2、37℃培养箱中培养。细胞转染miR-3175 mimics和inhibitors均由百奥迈科生物技术有限公司合成。序列如下:miR-3175 mimics:5'-ACGUCACUGCGUUCUCUCUCCCCG-3',inhibitors:5'-CGGGGAGAGAACGCAGUGACGU-3'。 将 细胞在6孔板中培养至40%~50%密度,并根据说明书使用Lipofectamine 2000进行转染。A172与U251细胞均分别设置对照组(control)、miR-3175 mimics组(转染miR-3175 mimics)、miR-3175 inhibitors组 (转 染miR-3175 inhibitors)、pCDNA3.4-SIX5 组 (转 染pCDNA3.4-SIX5),pCDNA3.4-SIX5+miR-3175 mimics组(转染pCDNA3.4-SIX5和miR-3175 mimics)。
1.3.2 RNA提取和实时荧光定量聚合酶链式反应(Real-time quantitative polymerase chain reaction,Real-time qPCR)检测 使用TRIzol试剂提取总RNA,并按照RNA逆转录试剂盒说明书,将其逆转录为cDNA。使用Ultra SYBR混合物进行Real-time qPCR,反应条件:95 ℃ 10 min;95 ℃ 30 s,60 ℃ 1 min,共40个循环;熔解曲线:95℃ 15 s,60℃ 1 min,95℃15 s,60 ℃ 15 s,1个循环。 最后通过2-ΔΔCt法分析靶基因的相对表达量。实验重复3次。
1.3.3 免疫印迹法检测 裂解细胞并提取总蛋白,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白样品,并转膜。室温下封闭2 h,4℃下一抗(稀释比例:1:2 000)孵育过夜,以含有Tween的Tris缓冲盐溶液(Tris buffered saline and Tween,TBST)洗涤3次。 添加二抗(稀释比例:1:2 000),室温下孵育2 h,以TBST洗涤3次后,采用电化学发光(electrochemiluminescence,ECL)检测试剂盒检测。 实验重复3次。
1.3.4 MTT法检测 细胞增殖能力转染48 h后,将各组细胞以每孔5×103个的密度接种到96孔板中,每组包含6个平行孔。37℃下孵育24~72 h后,各孔中加入5 mg·mL-1的MTT溶液10 μL,继续孵育4 h后,加入150 μL二甲基亚砜(dimethyl sulfoxide,DMSO),以酶标仪检测490 nm处的吸光度。实验重复3次。
1.3.5 Transwell检测细胞迁移能力 将孔径为8 μm的小室放入24孔板中。每组以1×104个细胞的密度接种在含有无血清DMEM培养基的上室中,下室中填充有含20%FBS的DMEM培养基。培养36 h后,以4%多聚甲醛固定细胞,0.1%结晶紫染色,磷酸盐缓冲液(phosphate buffer saline,PBS) 清洗3次,光镜下观察,随机挑选4个视野,20倍光镜下拍照计数。实验重复3次。
1.3.6 流式细胞术检测细胞周期 转染48 h后,分别收集细胞,70%乙醇中固定过夜,离心后弃去上清液,加入PBS洗涤2次,37℃下以含RNase A的碘化丙啶(propidium iodide,PI)染色30 min。200 μm筛网过滤后,以流式细胞仪检测。实验重复3次。
1.3.7 流式细胞术检测细胞凋亡 转染48 h后,分别收集细胞,PBS洗涤2次,以300 μL结合缓冲液重悬,分别进行Annexin-Ⅴ和PI染色。200 μm筛网过滤后,以流式细胞仪检测。实验重复3次。
1.3.8 双荧光素酶检测报告基因 使用生物信息学分析软件miRTarBase(http://mirtarbase.mbc.nctu.edu.tw/index.html) 和TargetScan(http://www.targetscan.org/vert_71/),预测得出miR-3175的下游靶基因可能为SIX5。构建SIX5野生型 (SIX5WT-Luc)与突变型(SIX5MUT-Luc)荧光素酶报告基因质粒,分别以脂质体转染SIX5WT-Luc和共转染SIX5MUT-Luc与miR-3175 mimics到A172和U251细胞中,转染48h后,检测荧光素酶相对活性,以二者的比值作为相对表达量。实验重复3次。
1.3.9 基因表达谱动态分析(gene expression profiling interactive analysis,GEPIA) 从基因表达综合(Gene Expression Omnibus,GEO)数据库(https://www.ncbi.nlm.nih.gov/geo/)下载胶质瘤组织和癌旁组织的基因表达数据,选择临床信息完善的数据进行基因表达差异分析。在癌症基因组图谱(The cancer genome atlas,TCGA)数据库(https://portal.gdc.cancer.gov/)中下载基因系列(gene series,GSE)4290 和GSE16011胶质瘤数据集。通过GEPIA(http://gepia.cancer-pku.cn/)分析以上数据,并对SIX5在胶质瘤组织和癌旁组织中的表达情况进行分析并比较。
1.4 统计学分析 采用GraphPad Prism 9.0统计软件进行统计学分析。多组均数比较使用单因素方差分析,两组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 miR-3175在胶质瘤细胞的表达及对胶质瘤细胞增殖及迁移的影响 Real-time qPCR检测结果显示,miR-3175在胶质瘤细胞A172和U251中的表达水平明显低于人正常胶质细胞HA-1800(P<0.01)。见图1A。
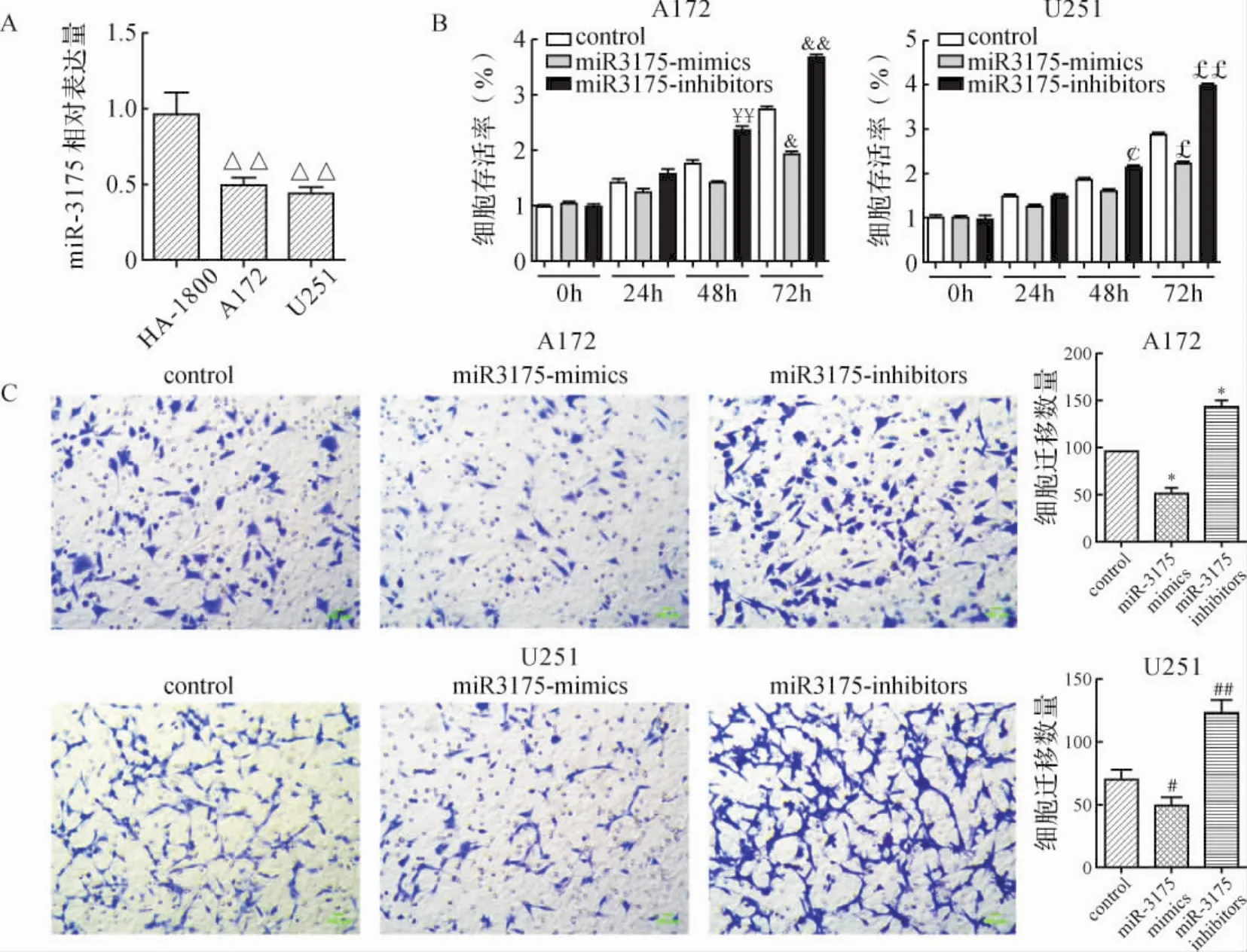
图1 miR-3175在胶质瘤细胞中的表达和对胶质瘤细胞增殖及迁移的影响Fig.1 Expression of miR-3175 in glioma cells and effect of the proliferation and migration of glioma cells
为了探索miR-3175在胶质瘤细胞增殖中的作用,分别在A172和U251细胞中转染miR-3175 mimics和miR-3175 inhibitors。MTT结果表明,转染miR-3175 mimics 72 h后,A172和U251细胞存活率分别较各自对照组明显下降(P<0.05),而miR-3175 inhibitors组细胞存活率明显上升(P<0.01,P<0.05)。 见图1B。以上结果提示,miR-3175的表达能够调控胶质瘤细胞的增殖。
Transwell实验结果显示,与对照组比较,转染miR-3175 mimics的胶质瘤细胞穿过小室的数量较少,而miR-3175 inhibitors组胶质瘤细胞穿过小室的数量明显增加(P<0.05,P<0.01)。见图1C。上述结果表明,miR-3175的表达能够调节胶质瘤细胞的迁移。
2.2 miR-3175对胶质瘤细胞的周期分布及细胞凋亡的影响 与对照组比较,经miR-3175 mimics转染后,处于G0/G1期的细胞数量明显增加,G2/M期的细胞数量明显减少;而miR-3175 inhibitors显著降低了G0/G1期细胞比例,并增加了G2/M期细胞比例(P<0.05)。见图2A。以上结果提示,过表达miR-3175可诱导胶质瘤细胞发生G0/G1期阻滞。

图2 miR-3175对胶质瘤细胞的周期分布及细胞凋亡的影响Fig.2 Effect of miR-3175 on cycle distribution and apoptosis of glioma cells
为了研究miR-3175对胶质瘤细胞凋亡的影响,检测了各组胶质瘤细胞的凋亡率。转染miR-3175 mimics的胶质瘤细胞凋亡率显著高于各自的对照组,A172细胞凋亡率为(11.85±1.85)%,高于同一细胞对照组(7.53±1.63)%,差异有统计学意义(P<0.05);U251细胞为(18.53±3.46)%,高于同一细胞对照组(7.80±1.13)%,差异有统计学意义(P<0.01)。 而转染miR-3175 inhibitors的细胞凋亡率显著低于同一细胞对照组,A172细胞为(4.91±0.82)%,低于对照组的(7.53±1.63)%,差异有统计学意义(P<0.05);U251为(4.58±1.60)%,低于同一细胞对照组(7.80±1.13)%,差异有统计学意义(P<0.05)。见图2B。
2.3 SIX5是miR-3175的潜在靶基因 生物信息学软件预测结果显示,SIX5的3'-非翻译区(untranslated area,UTR)区域存在与miR-3175成熟序列互补配对的结合区,提示SIX5可能是miR-3175的潜在靶基因。见图3A。

图3 SIX5是miR-3175的潜在靶基因Fig.3 SIX5 is a potential target gene of miR-3175
为进一步验证两者之间的靶向关系,首先检测了miR-3175对SIX5蛋白表达水平的影响。免疫印迹法结果显示,与各自对照组比较,miR-3175 mimics转染后胶质瘤细胞中SIX5表达量明显下调(P<0.01,P<0.05),miR-3175 inhibitors转染后的SIX5表达量明显上调(P<0.05,P<0.01)。 见图3B。
其次,分别在A172与U251细胞中转染过表达SIX5,以检测SIX5对miR-3175表达水平的影响。见图3C。胶质瘤细胞在过表达SIX5后miR-3175的表达水平明显降低(P<0.01)。 见图3D。
最后,将pmirGLO SIX5-WT或pmirGLO SIX5-MUT载体与miR-3175mimics共转染入U251细胞中,通过荧光素酶报告基因检测发现,与pmirGLO SIX5-MUT比较,pmirGLO SIX5-WT报告分子的相对荧光素酶活性被抑制了53%(P<0.01)。见图3E。上述结果表明SIX5与miR-3175的表达负相关,它是miR-3175的下游靶基因。
2.4 SIX5在胶质瘤组织中高表达且与患者预后相关为了研究SIX5在胶质瘤组织中的表达模式,对TCGALGG及TCGAGBM数据集的分析结果显示,SIX5在胶质母细胞瘤(glioblastoma,GBM)中的表达量显著高于癌旁正常组织(P<0.05)。见图4A。与TCGA数据分析结果一致,GSE4290数据集的胶质瘤组织中SIX5的表达水平显著增高,且与世界卫生组织(World Health Organization,WHO)分级有关(P<0.05)。 见图4B。 此外,对GSE16011数据集的分析结果表明,表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变型的肿瘤组织中SIX5基因表达明显高于野生型(P<0.05)。见图4C。采用免疫印迹法检测人正常胶质细胞以及胶质瘤细胞中SIX5的表达,结果显示A172与U251细胞中SIX5的表达量均明显高于HA-1800(P<0.01)。 见图4D。 以上结果提示,SIX5基因表达上调可能与胶质瘤的发生有关。

图4 SIX5在胶质瘤组织中高表达且与患者预后相关Fig.4 SIX5 is highly expressed in glioma tissues and is related to patient prognosis
以SIX5相对表达量中位数为界,将TCGA数据库中胶质瘤患者分为高表达和低表达组,生存分析结果显示,SIX5高表达的患者总生存期(overall survival,OS)和无进展生存期(progress free survival,PFS)均显著低于低表达组患者(P<0.01)。见图4E。GSE16011数据集分析结果同样表明,SIX5高表达的患者OS显著低于SIX5低表达的患者(P<0.01)。见图4F。以上结果提示SIX5高表达可能与胶质瘤的不良预后有关。
2.5 SIX5上调降低了miR-3175 mimics抑制胶质瘤细胞增殖和迁移的作用 为了进一步验证miR-3175是否通过靶向抑制SIX5的表达抑制胶质瘤细胞的各项恶性生物学行为,将pCDNA3.4-SIX5、pCDNA3.4-SIX5+miR-3175 mimics和miR-3175 mimics分别转染到胶质瘤细胞。MTT结果显示,转染后 pCDNA3.4-SIX5组的胶质瘤细胞存活率明显高于pCDNA3.4-SIX5+miR-3175 mimics组 (P<0.05),miR-3175 mimics组的胶质瘤细胞存活率远低于pCDNA3.4-SIX5+miR-3175 mimics组(P<0.05,P<0.01)。 见图5A。 以上结果表明,SIX5的过表达削弱了miR-3175 mimics对胶质瘤细胞增殖的抑制能力。

图5 SIX5上调降低了miR-3175 mimics对胶质瘤细胞增殖和迁移的抑制作用Fig.5 Up-regulation of SIX5 reduced the inhibitory effect of miR-3175 mimics on the proliferation and migration of glioma cells
Transwell结果显示,pCDNA3.4-SIX5组通过滤膜的细胞数明显高于其他组(P<0.01),而miR-3175 mimics组通过滤膜的细胞数量明显低于pCDNA3.4-SIX5+miR-3175 mimics组(P<0.05,P<0.01)。见图5B。以上结果说明,SIX5过表达削弱了miR-3175对胶质瘤迁移能力的抑制作用,提示SIX5参与了miR-3175抗胶质瘤细胞迁移的过程。
2.6 SIX5上调逆转了miR-3175 mimics对胶质瘤细胞凋亡的促进作用 细胞周期分析结果显示,与各自对照组和pCDNA3.4-SIX5+miR-3175mimics组比较,pCDNA3.4-SIX5组处于G0/G1期的细胞比例明显减少,处于G2/M期的细胞比例明显增加(P<0.01);而miR-3175 mimics组处于G0/G1期的细胞数比例明显增加,处于G2/M期的细胞比例明显减少(P<0.01)。见图6A。结果表明,SIX5的过表达可以缓解miR-3175 mimics对细胞周期的阻滞作用。
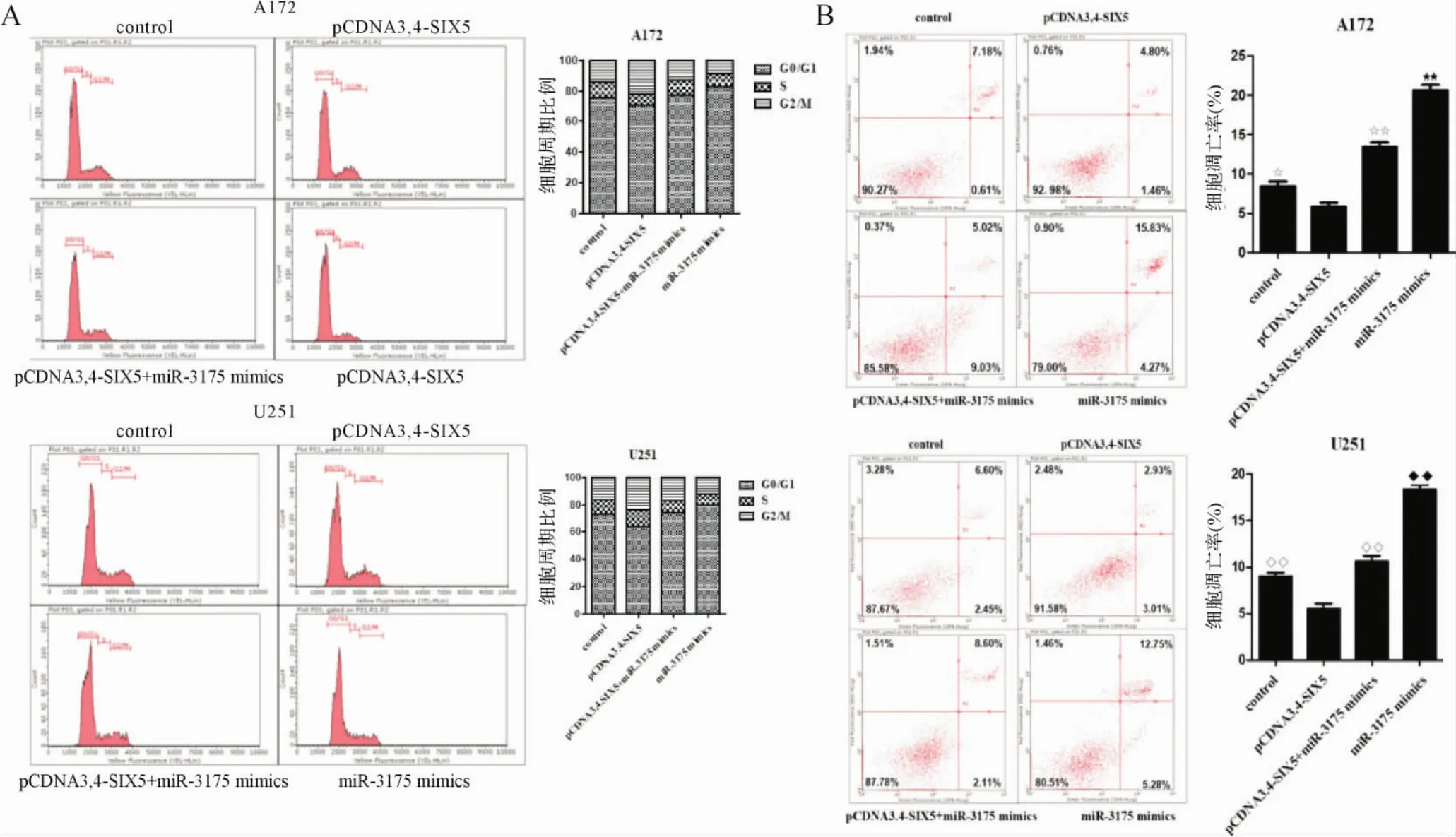
图6 SIX5上调逆转了miR-3175 mimics对胶质瘤细胞凋亡的促进作用Fig.6 Up-regulation of SIX5 reversed the effect of miR-3175 mimics on glioma cell apoptosis
pCDNA3.4-SIX5组胶质瘤细胞凋亡率明显低于各自对照组(P<0.05,P<0.01);pCDNA3.4-SIX5+miR-3175 mimics组胶质瘤细胞凋亡率明显高于pCDNA3.4-SIX5组(P<0.01),但明显低于miR-3175 mimics组(P<0.01)。 见图6B。 说明SIX5的过表达削弱了miR-3175 mimics对胶质瘤细胞凋亡的促进作用。
3 讨论
胶质瘤恶性程度高、浸润性强,往往肿瘤边界不清,手术难以完整切除,所以常伴有不良预后。虽然随着显微外科的进展,以及术中磁共振及神经导航等方法的应用,胶质瘤手术治疗的效果得到了一定程度的改善,并延长了患者的生存期,但术后复发率仍然较高[12-13]。因此,寻找胶质瘤预后标志物和有效的靶标分子对指导和优化治疗尤其重要。
目前研究发现,miRNA通过调控其对应靶基因及下游信号通路,参与了癌症的发生发展中的许多重要进程,包括调控肿瘤细胞迁移和生长以及诱导细胞凋亡等[14-16]。Ke等[17]发现,miR-326的过表达可以抑制成纤维细胞生长因子1(fibroblast growth factor 1,FGF1)的表达,并进一步阻断磷脂酰肌醇 3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/PKB)和丝裂原活化蛋白激酶激酶1/2(mitogen activated protein kinase kinase1/2,MEK1/2)通路的活性,从而抑制神经胶质瘤细胞的恶性行为。Nan等[18]研究证明,miR-451通过靶向结合钙结合蛋白39(calcium binding protein 39,CAB39),调控哺乳动物雷帕霉素靶蛋白/缺氧诱导因子-1α/血管内皮生长因子(mammalian target of rapamycin/hypoxia inducible factor-1α/vascular endothelial growth factor,mTOR/HIF-1α/VEGF)信号通路,从而能够抑制胶质瘤细胞的增殖和侵袭。
miR-3175定位于人类15号染色体长臂的26.1区,研究证实其在多种肿瘤中异常表达,与肿瘤细胞的增殖迁移密切相关。前期研究发现,与人正常胶质细胞比较,miR-3175在胶质瘤细胞中表达下调。为验证miR-3175是否对胶质瘤细胞恶性生物学行为有影响,本研究对胶质瘤细胞进行miR-3175过表达以及敲除,结果发现miR-3175过表达后胶质瘤细胞的增殖、迁移能力显著降低、凋亡率显著升高;而miR-3175敲除后细胞的增殖、迁移能力明显升高、凋亡率明显下降,表明miR-3175在胶质瘤中扮演着抑癌基因的作用,可以作为治疗胶质瘤的潜在靶标分子。然而有报道称,miR-3175在胃癌组织和细胞中高表达,在肺癌组织中低表达,说明miR-3175在不同肿瘤中的表达存在异质性[8-9]。
为了进一步探索miR-3175在胶质瘤中的抑癌机制,本研究采用生物信息学软件预测发现SIX5可能是miR-3175的潜在靶基因之一。SIX5隶属于SIX家族,该家族有6个成员,包括SIX1、SIX2、SIX3、SIX4、SIX5和SIX6,在细胞增殖、分化、凋亡、黏附和迁移过程中具有重要作用[10]。目前研究发现,SIX1参与了人类多种癌症的发生,包括胃癌[19]、乳腺癌[20]和结肠直肠癌[21]等。SIX2通过下调E-钙黏蛋白水平,促进乳腺癌转移[22]。SIX3的高表达则有助于改善肺腺癌患者的临床结局,增加肺癌细胞中SIX3的表达,可以抑制细胞增殖和迁移[23]。Wei等[24]证实,SIX4蛋白丰度增高与食管鳞状细胞癌的不良分化和浸润深度增加密切相关。有研究表明,SIX5的表达异常可能参与1型肌强直性营养不良的发病机制[25]。降低 SIX5的表达可改善mdx小鼠的营养不良,并能够延长其寿命[26]。Klesert等[27]还发现,缺乏SIX5会引发小鼠白内障。目前SIX5在肿瘤中研究较少,Liu等[11]的研究表明SIX5在非小细胞肺癌中表达水平明显高于正常肺组织,但其在胶质瘤中的作用至今未有报道。本研究免疫印迹法结果发现,miR-3175可以抑制SIX5的表达。双荧光素酶报告基因分析进一步证实,miR-3175通过结合SIX5 mRNA的3'-UTR来抑制SIX5的表达,与本研究发现在胶质瘤组织和胶质瘤细胞系中miR-3175低表达,而SIX5高表达的结果相符。此外,在胶质瘤细胞中过表达SIX5可以逆转miR-3175对胶质瘤细胞增殖和迁移能力的抑制作用,提示miR-3175可能靶向负调控SIX5,从而抑制胶质瘤细胞的增殖和迁移。
综上所述,本研究证实miR-3175在胶质瘤中低表达,并能够抑制胶质瘤的恶性生物学行为,进一步证明了miR-3175靶向负调控促癌基因SIX5在调节胶质瘤增殖和迁移中的作用。本研究结果为胶质瘤发生机制提供了新的见解,miR-3175/SIX5途径也可能成为胶质瘤靶向治疗的新途径。
