益气健脾消瘀泄浊方对慢性肾衰竭大鼠骨骼肌自噬的影响
2022-02-25程天阳马书云杨丹夏虹张冰冰鲁科达
程天阳 马书云 杨丹 夏虹 张冰冰 鲁科达
1.浙江中医药大学第一临床医学院 杭州 310053 2.浙江中医药大学附属第一医院3.浙江中医药大学 4.浙江中医药大学附属第三医院
慢性肾功能衰竭(chronic renal failure,CRF)是慢性肾脏病(chronic kidney disease,CKD)发展成终末期肾病(end stage renal disease,ESRD)的共通途径,在此过程中28%~54%的透析患者会伴随不同程度的代谢紊乱和营养不良[1],被称作蛋白质-能量营养不良(protein-energy wasting,PEW)。作为CKD的常见并发症之一,PEW以体质量减低、血清白蛋白水平下降、肌肉萎缩(muscular atrophy,MA)等为主要表现,其中MA被认为是判断PEW严重程度的最佳指标[2]。另有研究表明,MA可使透析患者4~6年死亡风险上升3倍[3],因此改善CRF患者整体营养状态、防止肌肉萎缩,对提高其生存率及生活质量具有重要意义。
CRF患者出现PEW的主要原因是蛋白质合成与分解的代谢失衡。近年来研究发现,自噬溶酶体系统(autophagy lysosome system,ALS)作为一种新的蛋白质降解途径,在维持骨骼肌细胞稳态的过程中发挥了重要作用[4]。而CKD相关的临床研究和动物实验中均证实研究对象骨骼肌存在自噬活化现象[5-6],这提示自噬极有可能参与了CRF患者MA的发生发展。
益气健脾消瘀泄浊方是鲁科达教授基于“脾主肌肉”理论提出的治疗CRF营养不良的专方,以补气药为主、化瘀药为辅、健脾药固本、虫类药为使,有益气健脾、消瘀泄浊之功。前期研究已证实,其基础方消瘀泄浊饮对CKD气虚夹瘀证具有较好疗效[7-9]。
本研究以CRF-PEW大鼠为研究对象,观察益气健脾消瘀泄浊方对其骨骼肌自噬相关基因表达的影响,探讨益气健脾消瘀泄浊方改善CRF-PEW的作用和机制,为该方的临床推广提供理论依据。
1 材料和方法
1.1 实验动物 无特定病原体(specified pathogen free,SPF)级健康雄性SD大鼠30只,6周龄,体质量160~180 g,购于上海西普尔-必凯实验动物有限公司[实验动物生产许可证号码:SCXK(沪)2018-0006],饲养于浙江中医药大学动物实验中心[实验动物使用许可证号码:SYXK(浙)2018-0012]。实验期间予SPF级低蛋白饲料(酪蛋白60 g·kg-1、淀粉539 g·kg-1、糊化淀粉130.5 g·kg-1、蔗糖100 g·kg-1、豆油70 g·kg-1、微晶纤维素50 g·kg-1、矿物盐混合物35 g·kg-1、维生素混合物10 g·kg-1、L-胱氨酸3.0 g·kg-1、 氯化胆碱2.5 g·kg-1)饲养,饲料购于江苏协同医药生物工程有限责任公司(批号:XTLPR001),自由饮水,保持昼夜节律,室温(22±1)℃。本研究已获得浙江中医药大学实验动物管理与伦理委员会批准(批准编号:IACUC-20180507-06)。
1.2 药品和试剂 益气健脾消瘀泄浊方由生黄芪30 g、车前草20 g、地龙12 g、制军10 g、桃仁12 g、川牛膝12 g、党参15 g、白术15 g、茯苓15 g组成,以上中药由浙江省中医院中药房提供,以单蒸水600 mL煎煮1 h,重复2次,混匀后以旋转蒸发器浓缩至1.47 g·mL-1,4℃冰箱保存待用。复方α-酮酸片购于北京费森尤斯卡比医药有限公司(规格:0.63 g/片,国药准字:H20041442),以0.9%氯化钠注射液8 mL溶解,配制成78.75 mg·mL-1的混悬液,4℃保存待用。SYBR Green实时荧光定量聚合酶链式反应(Real-time quantitative polymerase chain reaction,Real-time qPCR)试剂盒购于北京康为世纪生物科技有限公司(批号:CW2601);二喹啉甲酸 (bicinchoninic acid,BCA)蛋白定量试剂盒购于Solarbio Cat公司 (批号:pc0020);兔抗p62多克隆抗体、兔抗微管相关蛋白轻链3A/3B (microtubule-associated protein light chain 3A/3B,LC3A/B)多克隆抗体、兔抗Beclin-1多克隆抗体、兔抗叉头框转录因子O3a(forkhead-box transcription factor O3a,Foxo3a)多克隆抗体均购于CST公司(批号:39749、4108S、3495S、12829S)。
1.3 主要仪器 TE2000-S型荧光显微镜购于日本Nikon公司;SorvallTMST 8型低温高速离心机和Qubit4型核酸蛋白定量仪均为美国ThermoFisher Scientific公司产品;Mastercycler®nexus型普通PCR扩增仪购于德国Eppendorf公司;CMaxPlus型酶标仪为美国Molecular Devices公司产品。
1.4 方法
1.4.1 分组给药 大鼠予普通饲料适应性喂养1周后,随机挑选5只作为假手术组,仅剥离肾包膜;余下25只大鼠行二步法5/6肾切除,建立CRF大鼠模型,第2次术后改为低蛋白饮食喂养,制作CRF-PEW大鼠模型。以造模后大鼠体质量较假手术组下降20%以上为造模成功的主要标志,并将造模成功大鼠随机分为模型对照组8只、阳性对照组8只、中药治疗组9只,造模成功次日开始灌胃给药。根据人-大鼠体表面积的转换系数6.25进行换算,中药治疗组大鼠中药用量为1 mL·100g-1,阳性对照组大鼠复方α-酮酸片混悬液用量为0.7875 g·kg-1(根据60 kg成人用量7.56 g·d-1进行换算),模型对照组大鼠使用等体积0.9%氯化钠注射液,各组灌胃量均为1 mL·100g-1,1次/d,持续8周。
1.4.2 标本采集 治疗前后采用代谢笼收集大鼠24 h尿液;给药前颌下静脉采血,给药完成后心脏取血,血液静置离心后取上层血清,转移至1.5 mL离心管;心脏取血后,于冰上剥离双侧胫骨前肌和腓肠肌,置于冻存管。所有标本均-80℃冻存,用于后续检测。
1.4.3 指标检测
1.4.3.1 肾功能检测 采用全自动生化分析仪检测大鼠给药前后血肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN)、血清白蛋白(albumin,ALB)以及24 h尿蛋白(24 hours urine protein,24 h Upr)水平。
1.4.3.2 骨骼肌形态改变观察 大鼠骨骼肌放入10%中性甲醛中固定24 h后,取材包埋,切片后60℃烘片1 h,二甲苯脱蜡后行苏木精-伊红(hematoxylin-eosin,HE)染色,200倍光镜下观察各组骨骼肌形态差异。
1.4.3.3 Real-time qPCR检测骨骼肌p62、LC3A/B、Beclin-1、Foxo3a基因表达 严格按照总RNA提取试剂盒说明书提取组织RNA并进行逆转录及扩增,以甘油醛-3-磷酸脱氢酶 (glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参基因。引物由杭州鹰旸生物科技有限公司合成,序列见表1。设定标准曲线,将已提取的总RNA逆转录为cDNA进行扩增,反应条件:94℃变性30 s,60℃退火30 s,72℃延伸1 min,共40个循环,72℃终止延伸5 min。生成扩增曲线和熔解曲线,采用2-△△CT方法计算各基因的相对表达量。
1.4.3.4 免疫印迹检测骨骼肌p62、LC3A/B、Beclin-1、Foxo3a蛋白表达 取大鼠骨骼肌提取蛋白,蛋白定量后按照试验操作步骤进行电泳、转膜、封闭后,加入一抗,4℃孵育过夜。加入对应二抗,室温避光孵育1 h后荧光法扫描显像,并进行蛋白条带分析,以GAPDH为内参,计算蛋白相对表达量。
1.4.3.5 免疫组化检测骨骼肌Foxo3a表达 严格按照实验步骤对骨骼肌病理切片进行抗原修复、免疫杂交、复染、封胶,在200倍光镜下随机选取6个不重复视野观察染色区域,并采用Image Pro Plus 6.0软件测定阳性染色面积(Area)、累积光密度(integrated optical density,IOD)值,并计算平均光密度值(mean optical density,MOD)进行半定量分析。
1.5 统计学分析 采用SPSS 25.0统计软件进行统计学分析。符合正态分布的计量资料以±s表示,组间总体比较采用单因素方差分析,其中方差齐的资料采用最小显著性差异(least significant difference,LSD)法进行两两比较,方差不齐的资料采用Dunnett's T3法进行两两比较;非正态分布的资料组间比较采用非参数检验方法。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肾功能比较 与假手术组比较,治疗前与治疗后造模各组Scr、BUN均显著升高(P<0.01);与模型对照组比较,治疗后阳性对照组、中药治疗组Scr有所下降(P<0.05),BUN显著下降(P<0.01);与阳性对照组比较,中药治疗组治疗后Scr、BUN降低更明显(P<0.05)。 见表2。
表2 各组大鼠肾功能比较Tab.2 Comparison of kidney function in each group (±s)

表2 各组大鼠肾功能比较Tab.2 Comparison of kidney function in each group (±s)
注:与假手术组比较,**P<0.01;与模型对照组比较,△P<0.05,△△P<0.01;与阳性对照组比较,☆P<0.05。Note:Compared with sham operation group,**P<0.01;compared with model control group,△P<0.05,△△P<0.01;compared with positive drug control group,☆P<0.05.
BUN(mmol·L-1)治疗前 治疗后 治疗前 治疗后假手术组 28.53±2.07 38.98±3.74 2.64±0.18 3.47±0.50模型对照组 58.76±10.34** 55.15±9.46** 8.86±0.50** 10.77±2.29**阳性对照组 59.66±9.37** 45.95±4.77**△ 8.97±0.37** 7.37±0.47**△△中药治疗组 60.56±11.22** 42.94±5.22**△☆ 8.88±0.48** 6.15±0.54**△△☆Scr(μmol·L-1)组别
2.2 各组大鼠ALB与24 h Upr水平比较 与假手术组比较,治疗前造模各组ALB水平下降(P<0.05),24 h Upr升高(P<0.01);与模型对照组比较,治疗后阳性对照组ALB水平升高、24 h Upr下降(P<0.05),中药治疗组ALB、24 h Upr变化更显著(P<0.01);与阳性对照组比较,中药治疗组治疗后ALB水平升高更明显(P<0.05)、24 h Upr降低更明显(P<0.05)。 见表3。
表3 各组大鼠ALB与24 h Upr水平比较Tab.3 Comparison of ALB and 24 h Upr in each group (±s)

表3 各组大鼠ALB与24 h Upr水平比较Tab.3 Comparison of ALB and 24 h Upr in each group (±s)
注:与假手术组比较,*P<0.05,**P<0.01;与模型对照组比较,△P<0.05,△△P<0.01;与阳性对照组比较,☆P<0.05。Note:Compared with sham operation group,*P<0.05,**P<0.01;compared with model control group,△P<0.05,△△P<0.01;compared with positive drug control group,☆P<0.05.
24 h Upr(mg·24 h)治疗前 治疗后 治疗前 治疗后假手术组 32.06±0.68 32.82±2.04 22.56±1.77 23.96±2.55模型对照组 25.38±3.63* 24.50±2.06* 35.72±2.13** 36.10±3.07**阳性对照组 25.67±3.58* 27.51±1.18*△ 35.08±2.39** 30.05±1.44**△中药治疗组 25.80±3.59* 28.22±0.70*△△☆ 35.16±2.07** 27.51±0.75**△△☆ALB(g·L-1)组别
2.3 各组大鼠骨骼肌形态改变比较 与假手术组比较,模型对照组大鼠骨骼肌明显萎缩;与模型对照组比较,阳性治疗组与中药治疗组大鼠骨骼肌萎缩程度均有所改善。见图1。

图1 各组大鼠骨骼肌形态改变(HE染色,200×)Fig.1 Changes in skeletal muscle morphology of rats in each group(HE staining,200×)
2.4 各组大鼠骨骼肌组织p62、LC3A/B、Beclin-1、Foxo3a表达比较
2.4.1 各组大鼠骨骼肌组织p62、LC3A/B、Beclin-1、Foxo3a基因表达比较 与假手术组比较,模型对照组p62基因表达量降低(P<0.01),LC3A/B、Beclin-1和Foxo3a基因表达量升高(P<0.01);与模型对照组比较,治疗后阳性对照组、中药治疗组p62基因表达量升高(P<0.01),LC3A/B、Beclin-1和Foxo3a基因表达量均降低(P<0.05,P<0.01);与阳性对照组比较,中药治疗组p62基因表达量升高更明显(P<0.05)、Foxo3a基因表达量降低更明显(P<0.05)。 见表4。
表4 各组大鼠骨骼肌组织p62、LC3A/B、Beclin-1、Foxo3a基因表达比较Tab.4 Comparison of p62,LC3A/B,Beclin-1 and Foxo3a gene expressionin skeletal muscle in each group (±s)
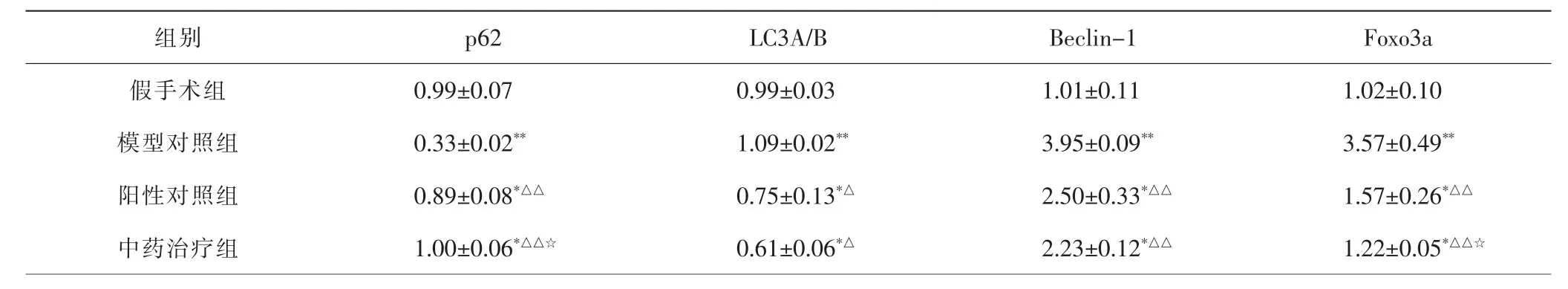
表4 各组大鼠骨骼肌组织p62、LC3A/B、Beclin-1、Foxo3a基因表达比较Tab.4 Comparison of p62,LC3A/B,Beclin-1 and Foxo3a gene expressionin skeletal muscle in each group (±s)
注:与假手术组比较,*P<0.05,**P<0.01;与模型对照组比较,△P<0.05,△△P<0.01;与阳性对照组比较,☆P<0.05。Note:Compared with sham operation group,*P<0.05,**P<0.01;compared with model control group,△P<0.05,△△P<0.01;compared with positive drug control group,☆P<0.05.
组别 p62 LC3A/B Beclin-1 Foxo3a假手术组 0.99±0.07 0.99±0.03 1.01±0.11 1.02±0.10模型对照组 0.33±0.02** 1.09±0.02** 3.95±0.09** 3.57±0.49**阳性对照组 0.89±0.08*△△ 0.75±0.13*△ 2.50±0.33*△△ 1.57±0.26*△△中药治疗组 1.00±0.06*△△☆ 0.61±0.06*△ 2.23±0.12*△△ 1.22±0.05*△△☆
2.4.2 各组大鼠骨骼肌组织p62、LC3A/B、Beclin-1、Foxo3a蛋白表达比较 与假手术组比较,模型对照组p62蛋白表达降低(P<0.01),LC3A/B、Beclin-1、Foxo3a蛋白表达升高(P<0.01);与模型对照组比较,阳性对照组、中药治疗组p62蛋白表达升高(P<0.01),LC3A/B、Beclin-1、Foxo3a蛋白表达降低(P<0.01);与阳性对照组比较,中药治疗组p62蛋白表达升高更明显(P<0.05)。 见图2。
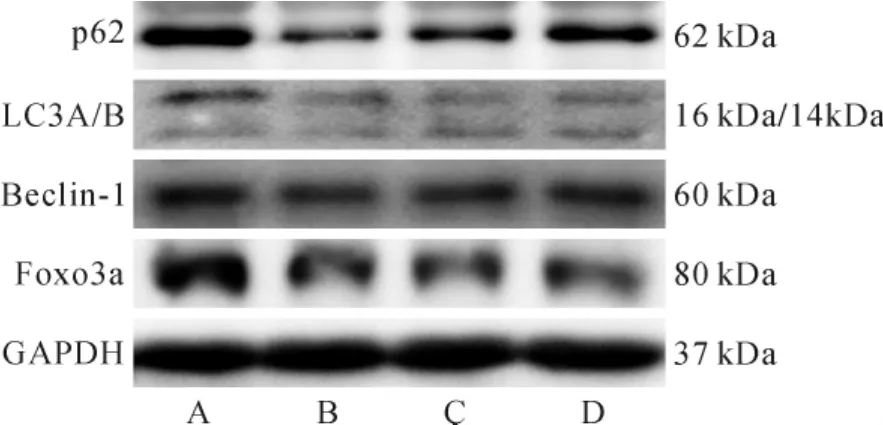
图2 免疫印迹检测骨骼肌目标基因蛋白表达情况Fig.2 Expression of target gene protein in skeletal muscle by Western blot
2.4.3 各组大鼠骨骼肌组织Foxo3a表达比较 与假手术组比较,模型对照组、阳性对照组、中药治疗组骨骼肌细胞胞质中均显示不同程度的棕褐染色,提示Foxo3a表达上调。见图3。与假手术组比较,模型对照组与阳性对照组Foxo3a表达均显著升高(P<0.01,P<0.05);与模型对照组比较,中药治疗组与阳性对照组Foxo3a表达显著降低(P<0.01,P<0.05)。 见表5。

图3 各组大鼠骨骼肌中Foxo3a蛋白的表达情况(200×)Fig.3 Expression of Foxo3a protein in skeletal muscle in each group(200×)
表5 各组大鼠骨骼肌中Foxo3a蛋白表达比较Tab.5 Comparison of Foxo3a protein expression in skeletal muscle in each group (±s)

表5 各组大鼠骨骼肌中Foxo3a蛋白表达比较Tab.5 Comparison of Foxo3a protein expression in skeletal muscle in each group (±s)
注:与假手术组比较,*P<0.05,**P<0.01;与模型对照组比较,△P<0.05,△△P<0.01。Note:Compared with sham operation group,*P<0.05,**P<0.01;compared with model control group,△P<0.05,△△P<0.01.
组别 Area IOD MOD假手术组 106 293.858±9 930.774 4 223.246±440.466 0.040±0.007模型对照组 2 903 643.125±245 918.724** 164 787.390±10 908.831** 0.057±0.006**阳性对照组 2 618 414.623±208 672.230*△ 130 005.233±15 777.401*△ 0.050±0.007*△中药治疗组 620 986.378±34 813.336△△ 27 275.249±2 028.691△△ 0.044±0.005△△
3 讨论
PEW是CRF患者的常见并发症,在加速疾病进展的同时更易诱发心血管事件,增加感染风险,是ESRD患者住院率和死亡率增加的主要原因[10]。蛋白质合成与分解失衡是发生PEW的根本原因,包括膳食中蛋白质和能量摄入不足,以及由于代谢性酸中毒、内分泌紊乱以及微炎症状态等造成的蛋白质代谢失调,透析患者在治疗过程中更容易伴随额外的营养丢失。现有的临床营养支持疗法对经济条件要求较高,患者依从性较差,且尚无足够循证医学证据支持其降低了患者死亡率。
祖国医学认为CRF属于“水肿”“关格”范畴,以脾肾亏虚为本,浊毒壅滞为标,病程日久,脏腑衰退,气血两虚,故面色无华,肢体痿废。针对PEW导致的骨骼肌萎缩,鲁科达教授依据“脾主肌肉”理论,强调健脾在CKD治疗中的作用,其一“诸湿肿满,皆属于脾”,脾为太阴湿土,虚则水寒相侮,阳虚运化不利,饮停发为浮肿;其二“气血生化,脾为之源”,脾为后天之本,受纳运化水谷,消化吸收不佳,脏腑气血失养;其三“脾气散精,充养四肢”,脾为升降枢纽,协调五脏阴阳,水精四布不畅,肌骨筋脉失荣。由此,鲁科达教授在“祛瘀生新”治法基础上结合“脾主肌肉”理论,创立益气健脾消瘀泄浊方,作为治疗CRF-PEW患者的专方。该方为消瘀泄浊饮与四君子汤合方化裁所得,由生黄芪30 g、川牛膝12 g、桃仁12 g、地龙12 g、制军10 g、车前草20 g、党参15 g、茯苓15 g、白术15 g组成。方中重用黄芪补气行血,鼓动诸药;制军荡涤肠胃,消积破滞;桃仁、牛膝协同活血,逐瘀通经;地龙性喜走窜,功擅通络;车前草利水通淋,导浊下行;参术茯苓助阳补气,化湿健脾。气足则推动,血行则瘀去,水行则浊泄,诸药合用,消补兼施,共奏益气健脾、消瘀泄浊之功。
自噬在PEW骨骼肌萎缩过程中发挥重要作用,其调控机制较为复杂,自噬相关基因(autophagy related genes,Atg)表达可受多种信号分子影响。p62是自噬特异性底物,可通过与Atg8的同源蛋白LC3结合,介导自噬-溶酶体系统降解[11];Atg6同源蛋白Beclin-1,在自噬体的形成中必不可少,可促进自噬小泡的成核及胞质蛋白的招募,是自噬体形成的标志[12];Foxo转录因子在CKD诱导的MA过程中起着关键作用,活性Foxo3a可通过自噬刺激肌肉中的溶酶体蛋白水解[6]。
本研究中阳性对照组使用复方α-酮酸片预防和治疗因CRF导致的PEW,结果发现益气健脾消瘀泄浊方的疗效优于复方α-酮酸片。首先,益气健脾消瘀泄浊方与复方α-酮酸片均可降低CRF-PEW大鼠Scr、BUN和24 h Upr水平,升高ALB水平;而益气健脾消瘀泄浊方的调节作用相较复方α-酮酸片更为显著,证实了该方对CRF肾功能的保护作用。其次,与假手术组比较,模型对照组大鼠骨骼肌明显萎缩,p62基因及蛋白表达水平显著下降,LC3A/B、Beclin-1、Foxo3a基因及蛋白表达水平显著升高,提示肌肉蛋白质分解可能与自噬激活有关;而中药治疗组大鼠骨骼肌p62基因及蛋白表达水平有所上升,而LC3A/B、Beclin-1、Foxo3a基因及蛋白表达水平有所下降,比阳性对照组更显著,表明益气健脾消瘀泄浊方可抑制骨骼肌自噬从而改善MA,在该方面的作用亦优于复方α-酮酸片。
综上所述,益气健脾消瘀泄浊方对肾功能具有保护作用,且能够在一定程度上改善CRF-PEW,减轻骨骼肌萎缩,其作用机制可能与抑制骨骼肌自噬有关。未来的研究将进一步探索益气健脾消瘀泄浊方调控的具体信号通路,以加深对其作用机制的了解,为中医药多靶点治疗与现代化推广提供实验依据。
