变异链球菌对人唾液腺细胞系免疫球蛋白受体影响的初步研究
2022-02-24龚吴仪李永明
龚吴仪 李永明
变异链球菌(Streptococcusmutans,S.mutans)是人类口腔内的主要病原菌之一[1],人体主要通过唾液中的免疫球蛋白来抵御其侵害[2]。唾液中的免疫球蛋白是由广泛分布于唾液腺间质的浆细胞合成,通过唾液腺导管上皮的免疫球蛋白受体(polymeric immunoglobulin receptor,Pigr)转运至唾液中发挥效应[3]。Pigr由于其运输免疫球蛋白的关键作用,在口腔黏膜免疫中发挥着重要的功能。
病原菌为逃避黏膜免疫的清除作用可影响Pigr的表达,有研究表明产肠毒素大肠杆菌可抑制小鼠肠道上皮细胞的Pigr表达[4],而口腔病原菌对唾液腺导管上皮细胞Pigr的作用尚未有报导。本研究旨在观察S.mutans对人唾液腺细胞系(human salivary gland cell line,HSG)中Pigr的影响,将有助于更深入了解S.mutans的致病过程,为龋病等口腔感染性疾病的防治提供新思路。
1 材料与方法
1.1 细胞培养
人下颌下腺闰管来源的HSG为本实验室冻存。使用含有1%青霉素、链霉素(Hyclone公司, 美国); 10%胎牛血清(Gibco公司)的DMEM培养液(Hyclone公司)在37 ℃、 5% CO2的培养箱中培养HSG。每天更换培养液,观察细胞密度达到70%~80%时以1∶2的比例进行传代。
1.2 免疫荧光染色
24 孔板放置细胞爬片后,每孔接入5×103个HSG细胞,细胞于37 ℃、 5% CO2的培养箱中培养24 h待其贴壁。细胞用PBS冲洗及4%多聚甲醛固定。用Triton X-100穿孔后5%牛血清白蛋白室温封闭0.5 h。Pigr抗体(1∶200,武汉爱博泰克公司)与细胞角蛋白14(cytokeratin 14, K14)抗体(1∶1 000, Invitrogen公司, 美国)4 ℃孵育过夜。去除一抗后荧光二抗(1∶1000,Invitrogen公司)室温孵育1 h。DAPI(Sigma-Aldrich公司, 美国)孵育10 min后将爬片取出,于载玻片上封片,共聚焦显微镜(Nikon公司, 日本)下观察。
1.3 细菌培养
Streptococcusmutans(ATCC 25175)(ATCC公司,美国)。使用脑心浸出培养液(brain heart infusion,BHI)(青岛海博公司)于37 ℃恒温培养箱中培养S.mutans至对数生长中期,于BHI培养液中60 ℃、 30 min水热灭活后,以一定数量比例与HSG进行共培养。
1.4 CCK-8实验
96 孔板每孔接入3×103个HSG细胞,对照组不加任何处理因素,共培养组分别加入使细菌细胞比例为10∶1, 100∶1的灭活S.mutans菌液,每组设5 个复孔。共培养12、 24、 36、 48 h后加入CCK-8试剂(江苏凯基公司),按照说明书用酶标仪在450 nm波长处检测吸光度值。
1.5 RNA提取及qPCR
6 孔板每孔接入2×105个HSG细胞,对照组不加任何处理因素;BHI对照组加入与菌液等量的BHI培养液;共培养组分别加入使细菌细胞比例为10∶1, 100∶1的灭活S.mutans菌液。细菌与细胞于37 ℃、 5% CO2的培养箱中共培养12 h或24 h。细胞用磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗后使用TRIzol(Takara公司, 日本)提取细胞总RNA,然后使用PrimeScript RT(Takara公司, 日本)进行逆转录。配制SYBR Green(上海翊圣公司)qPCR反应体系后,于LightCyclerqPCR仪(Roche公司, 瑞士)中进行检测。磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase, GAPDH)为内参,结果根据对照组水平进行标准化。引物序列见表 1。

表 1 qPCR引物序列表
1.6 蛋白提取及Western印迹法
6 cm细胞培养皿每皿接入5×105个HSG细胞,对照组不加任何处理因素;BHI对照组加入与菌液等量的BHI培养液;共培养组加入使细菌细胞比例为100∶1的灭活S.mutans菌液。细菌与细胞于37 ℃、 5% CO2的培养箱中共培养24 h。细胞用PBS冲洗后使用含蛋白酶及磷酸酶抑制剂的RIPA裂解液(上海碧云天公司)裂解细胞。 12 000 r离心10 min后取上清进行电泳。电泳完毕后于转膜液中115 V转膜1.5 h。应用3%牛血清白蛋白室温封闭2 h后一抗4 ℃孵育过夜。一抗信息如下: Pigr抗体(1∶1000,中国爱博泰克公司),GAPDH抗体(1∶1000,中国碧云天公司)。去除一抗TBST漂洗3次后室温避光孵育Western荧光二抗(1∶10 000,CST公司, 美国)1.5 h。去除二抗用TBST再次漂洗3 次后显影(LI-COR公司, 美国)。GAPDH为内参,结果根据对照组水平进行标准化。
1.7 数据统计分析

2 结 果
2.1 细胞系来源与Pigr在HSG中的表达情况
镜下观察HSG细胞呈上皮细胞典型的“铺路石样”生长(图 1),K14为导管上皮细胞的标志物[5],免疫荧光染色可观察到K14在HSG中的阳性信号,证明HSG的唾液腺导管上皮源性。同时也观察到Pigr稳定表达于HSG胞质中(图 1)。
2.2 S.mutans对HSG增殖的影响
共培养12、 24、 36、 48 h后,CCK-8结果显示细菌细胞比例为10∶1、 100∶1的两组与对照组相比吸光度值无统计学差异(图 2),说明在此共培养的细菌比例与共培养时间下S.mutans不影响HSG的增殖。
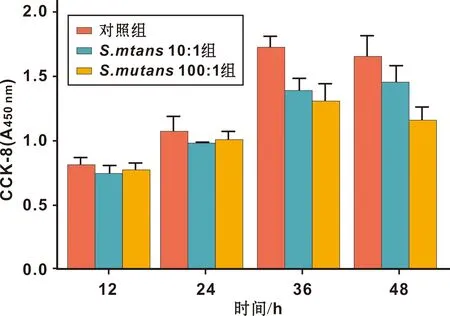
图 2 S.mutans对HSG细胞增殖的影响
2.3 S.mutans对HSG中Pigr表达的影响
qPCR结果显示共培养12 h后,细菌细胞比例为10∶1、 100∶1的2 组Pigr的mRNA水平与对照组相比均显著下降。共培养24 h后,细菌细胞比例为100∶1组与对照组相比Pigr的mRNA表达水平显著下降。随着共培养的时间增加与共培养的细菌比例上升, Pigr的mRNA表达水平呈下降的趋势(图 3A)。
Western印迹结果显示细菌细胞比例为100∶1共培养24 h后,Pigr的蛋白表达水平显著降低(图 3B)。以上实验结果说明S.mutans可在mRNA及蛋白水平抑制HSG中Pigr的表达。
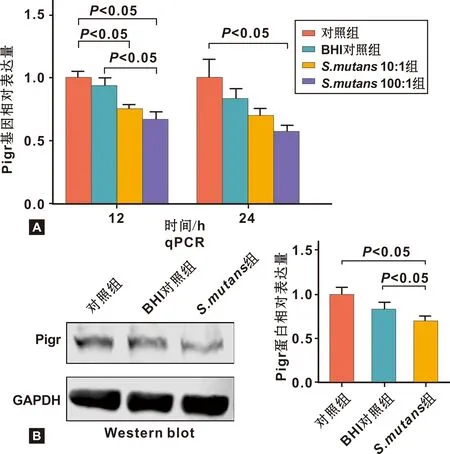
图 3 S.mutans对HSG中Pigr的mRNA与蛋白表达水平影响
3 讨 论
在唾液腺中Pigr主要表达于闰管及纹状管的上皮细胞中[3],该研究使用唾液腺导管上皮来源的细胞系HSG,并通过导管上皮细胞标志物K14的阳性信号证明了其导管上皮源性。该研究观察到HSG呈“铺路石样”生长,且Pigr在HSG细胞质中呈弥散性分布,这与前人的研究结果一致[3,6]。
Pigr负责转运浆细胞合成的免疫球蛋白,使其到达黏膜表面中发挥免疫效应,其中含量最多的是免疫球蛋白A(immunoglobulin A,IgA)。肠道IgA促进内源共生菌群的定植与外源病原菌的清除[7]。唾液IgA可抑制微生物在黏膜和牙齿表面的粘附,并辅助固有免疫系统清除病原菌如S.mutans[8-9]。基于此关系,微生物也演化出相应机制来作用于Pigr以利用或逃避IgA的作用[10-11]。
肠道共生菌群可通过调控上皮细胞的Pigr表达来帮助其肠道定植,如乳双歧杆菌与结肠上皮细胞共培养可上调细胞Pigr蛋白水平[12],小鼠灌喂多形拟杆菌后回肠组织Pigr基因表达量增加[13],肠杆菌属也可以促进结肠上皮细胞的Pigr基因表达[14]。与肠道共生菌相反,肠道病原菌如产肠毒素大肠杆菌,其感染的小鼠肠道组织Pigr基因表达下降[4]。在口腔中,有报道曾指出口腔感染链球菌属(如唾液链球菌,血链球菌)的患者舌下腺上皮细胞中,Pigr在mRNA水平及蛋白水平表达下降[15],该研究体外实验初步证明了S.mutans可下调HSG中Pigr的mRNA及蛋白表达水平,可能导致唾液IgA含量的降低,成为S.mutans躲避唾液IgA清除的机制之一。有研究报导细菌信号可通过上皮细胞Toll样受体(Toll like receptor,TLR)/核因子-κB(nuclear factor-κB,NF-kB)上调Pigr[14,16]。TLR可识别细菌成分如外毒素、内毒素、菌体蛋白等,将信号转移到胞内,激活NF-kB与丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路,介导下游的促炎反应,S.mutans作用于HSG中Pigr的具体机制可能与TLR/NF-kB/MAPK信号通路有关[17-18]。
S.mutans是公认的口腔致龋性病原菌,其牙面黏附、产酸、耐酸等特性会造成牙体组织的龋坏[19]。Pigr负责运输的唾液IgA作为口腔内保护性免疫球蛋白可抑制S.mutans[20]并预防龋齿的发生,唾液IgA含量降低是龋齿的易感因素之一[21]。此外,Pigr本身也可直接参与固有免疫[11],其水平下调加之其导致的唾液IgA含量减少将使得口腔黏膜免疫下降,可诱发多种口腔感染性疾病[22],包括龋病、牙髓根尖周病、牙周病等,甚至与口腔癌症发病有关,严重危害口腔健康[23]。
综上所述,S.mutans可抑制HSG中Pigr的表达,可能属于其逃避口腔黏膜免疫的机制之一,并且Pigr水平的下降会导致口腔感染性疾病的易感性增加。此过程涉及的细菌信号分子及具体信号通路还有待进一步深入研究,以利于口腔疾病防治与口腔健康维护。
