带蒂颊脂垫修复颊黏膜缺损的动物实验研究
2022-02-24史玮蒲娇郭治辰李晓文龚忠诚
史玮 蒲娇 郭治辰 李晓文 龚忠诚
自1977 年Egyedi[1]使用颊脂垫(buccal fat pad,BFP)修复软组织缺损后,被越来越广泛的应用于临床,如肿瘤术后缺损修复[2]、腭裂[3]、上颌窦瘘的修复[4]等。临床中我们发现带蒂颊脂垫修复颊黏膜缺损愈合效果较好,并发症少,且能上皮化,而对其中上皮化缺乏组织学水平的探讨及相关机制的阐述,口腔复杂的环境中,唾液对于创面愈合的促进作用也值得我们进一步去验证探究。因此本实验旨在通过动物模型从组织学水平来验证上皮化这一现象,观察创面愈合的组织学变化。
1 材料与方法
1.1 实验动物
实验动物:选取6 只3 月龄新西兰白兔雌雄不限,适应性喂养1 周,体重在2~3 kg之间(新疆医科大学动物实验中心)。
1.2 主要材料与仪器
实验试剂:速眠新(吉林圣达);舒泰®50(Virbac,French); 4%多聚甲醛(武汉博士德);苏木素-伊红染色试剂盒(北京中杉金桥);中性树胶、Masson染色试剂盒(北京索莱宝);实验仪器:光学显微镜及照相系统 (Olympus,日本);石蜡包埋机、石蜡切片机(Leica, 德国)。
1.3 实验方法
1.3.1 动物模型建立 将新西兰白兔用舒泰0.1 mL/kg+速眠新0.1 mL/kg混合肌注全身麻醉后固定于兔台,常规消毒,口内用黏膜碘消毒、铺无菌单。右侧为实验侧使用颊脂垫修复,左侧为对照侧创面将自然愈合。用尖刀在双侧颊黏膜制备一深至黏膜下层缺损约1 cm×1 cm,实验侧继续钝性分离可见一脂肪团,轻牵出将颊脂垫与创缘周边缝合,将颊脂垫与创缘周边缝合,止血,对照侧裸露创面自然愈合,彻底止血后结束手术。造模后常规进行3 d的流质饮食以及庆大霉素80 万单位肌注预防感染。
所有实验动物由新疆医科大学动物中心提供,且经新疆医科大学实验动物伦理委员会批准(批号:IACUC20190416-03)。 实验动物质量合格证号:SCXK(新)2018-0002,实验动物设施使用许可证号:SCXK(新)2018-0003。
1.3.2 检测指标 创面愈合面积观察:造模当天、术后1、 2、 4 周记录术区照片,观察伤口愈合情况,使用Image J 软件计算愈合面积。标本制备及染色观察: 1、 2、 4 周空气栓塞处死将造模区域组织扩大切除,经4%多聚甲醛固定、脱水包埋,切片机制备4 μm厚切片备用。 HE 染色及Masson染色:于HE染色观察上皮化与炎细胞浸润情况;Masson染色切片观察胶原纤维情况,采用Image Pro Plus 6.0软件测定胶原纤维沉积百分比。
1.4 统计学方法

2 结 果
2.1 伤口愈合观察结果
术后1 周可见实验组创面已基本闭合,表面质地软不平滑,对照组可见创面缩小变浅仍未完全闭合;术后2 周可见实验组及对照组创面均已完全闭合,实验组创面区域质地均匀,对照组创面区域质地稍硬且不够平滑。术后4 周实验组术区愈合较佳呈粉红色,与周围正常黏膜组织基本一致,对照组仍有轻度充血。颊黏膜缺损模型建立及愈合如图 1,术后第 1、 2、 4 周伤口面积变化如表 1, 各时间段实验组及对照组伤口面积减少的差异均具有统计学意义。

图 1 颊黏膜缺损模型及2 组愈合情况
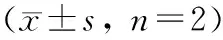
表 1 2 组伤口面积变化比较
2.2 HE结果
术后1 周:实验组上皮组织基本连续完整,基底膜不够清晰,有炎性细胞浸润;对照组上皮组织明显有缺损不连续,炎性细胞较对照组显著增多,组织疏松水肿。2 周:实验组上皮完整,组织结构清晰,基底层尚有炎性细胞浸润,基底膜清晰,与正常颊黏膜结构接近,对照组上皮连续但有炎性细胞较实验组多。4 周实验组及对照组均上皮结构完整,就炎细胞浸润情况,对照组较实验组更明显(图 2)。
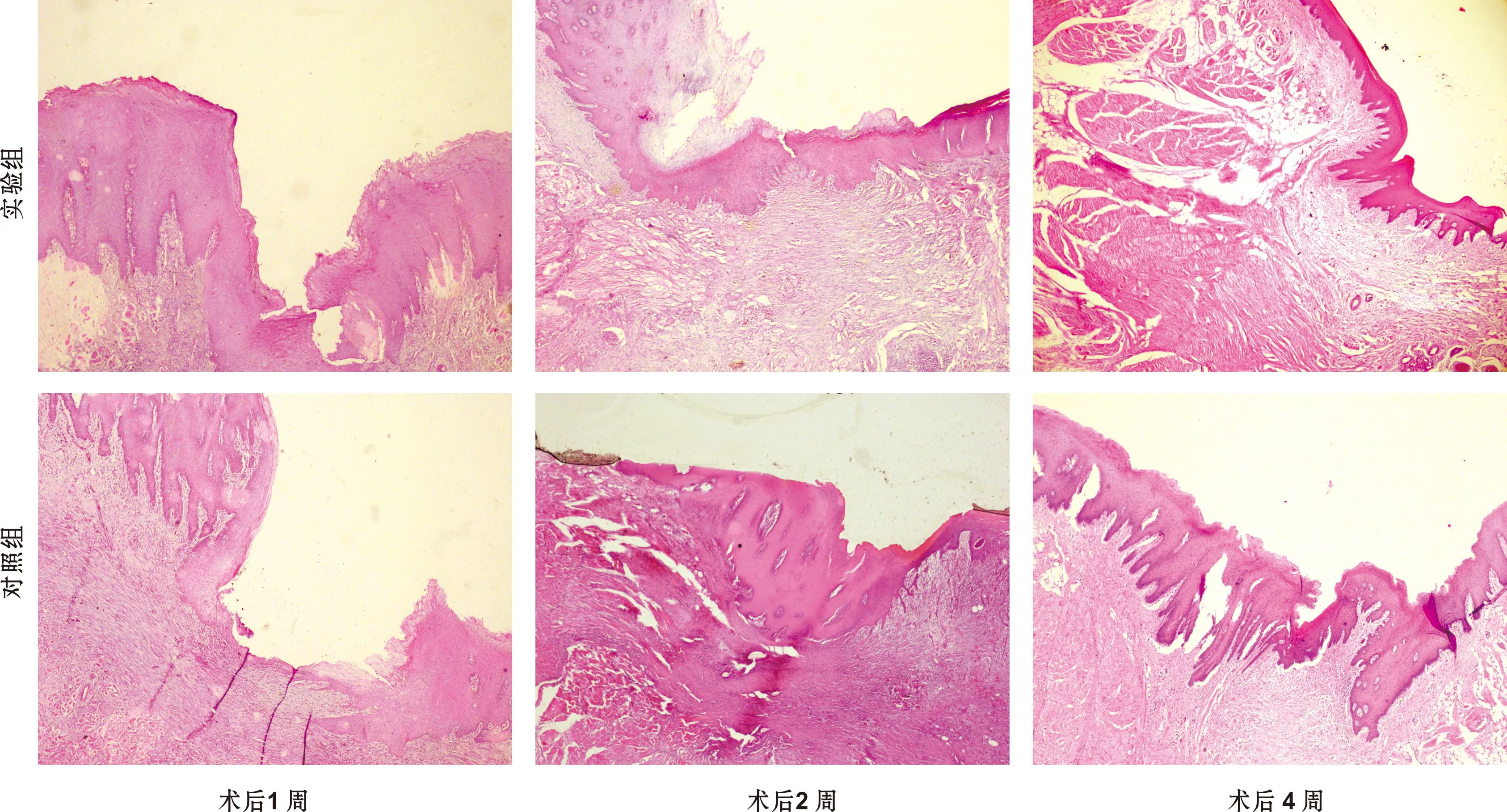
图 2 2 组伤口口愈合过程中颊黏膜的组织学观察(HE, ×40)
2.3 Masson染色结果
术后1 周,两组胶原纤维沉积量均较少,但实验组较对照组明显多,但对照组及实验组胶原纤维结合均不紧密,且排列较乱。术后2 周可见两组胶原纤维数量较1 周时均有增多,实验组胶原纤维结合紧密,较1 周时排列有序;对照组胶原纤维排列杂乱疏松。术后4 周可见,两组胶原纤维数量均有增多,结合十分紧密,实验组纤维粗大,排列方向有序;对照组纤维略欠佳,但较2 周组排列明显。胶原纤维形成能力分析:在术后1、 2 周时,实验组与对照组的胶原纤维平均光密度之间差异有显著性(P<0.01)。术后4 周时,实验组与对照组胶原纤维平均光密度差异无统计学意义(P>0.05)(图 3,表 2)。
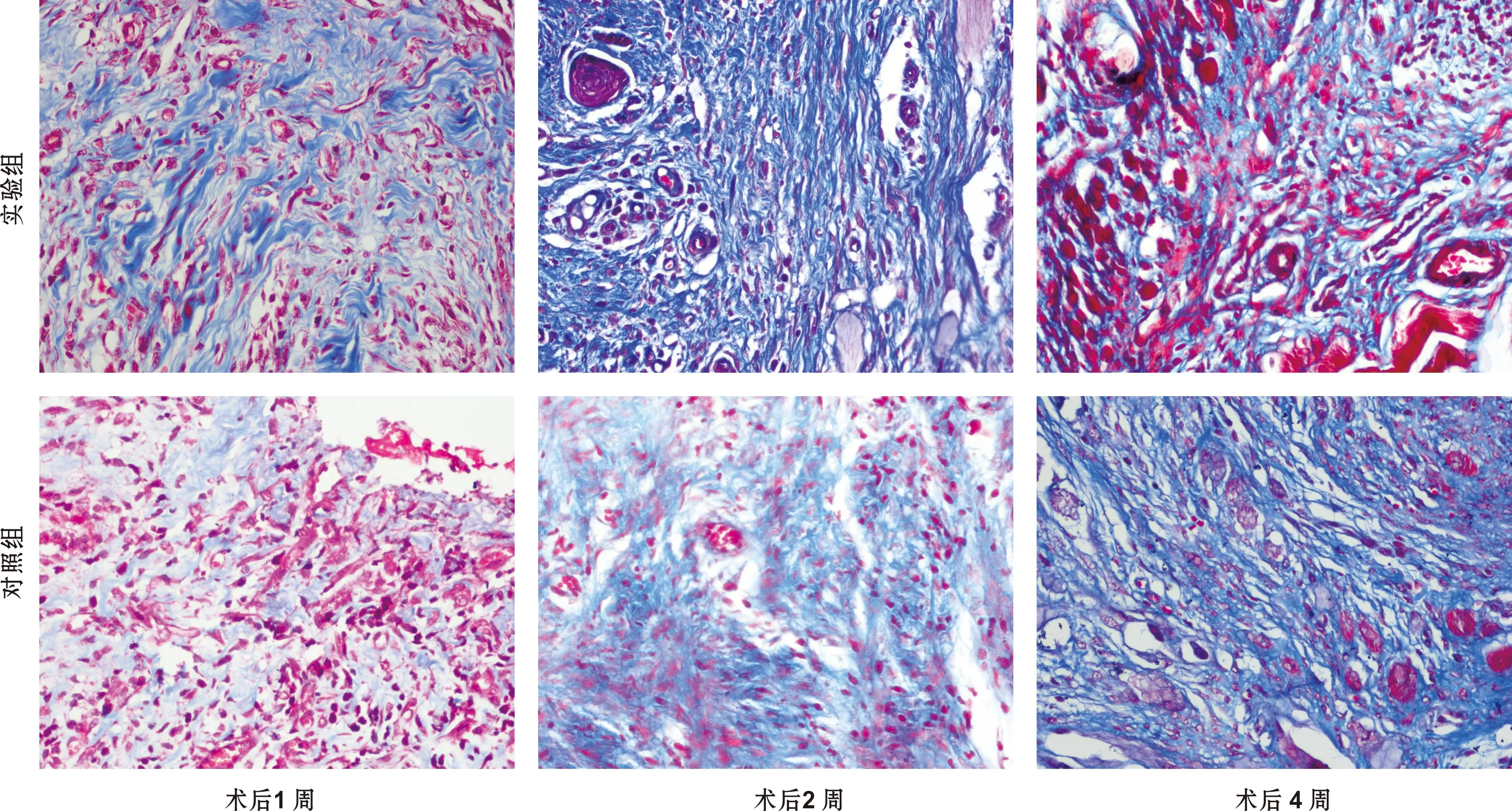
图 3 2 组样本Masson染色(×400)
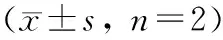
表 2 2 组样本胶原纤维平均吸光度比较
3 讨 论
在本实验中使用带蒂颊脂垫修复新西兰白兔颊黏膜缺损结果显示:实验组创面闭合时间更短,HE染色发现术后1 周对照组上皮仍有缺损,术后2 周两组均完全上皮化,但对照组较实验组炎症反应轻,Masson染色发现实验组在术后胶原纤维沉积较对照组多,促进创面的愈合。造模术中在新西兰白兔上颌后牙区下颌升支前缘处颊黏膜向后上方钝性分离,发现兔颊脂垫为一颜色偏白的脂肪团块,表面有包膜,周围血管丰富,体积约为人类颊脂垫的1/4~1/5。人类颊脂垫体积约为10.0 mL,平均厚度约6.0 mm,平均质量约9.3 g,可覆盖10 cm2的面积,遂适合中小型的缺损[5]。基于其良好的解剖位置,有良好的血供,且包膜丰富的血管网,因此具有较强的修复及抗感染能力,存活率较高,并发症少,并且位置相邻,避免二次伤害,术后较少见功能障碍、面部畸形等。
在本课题以往的研究及临床工作中已经发现使用带蒂颊脂垫修复口内缺损上皮化的现象[6-7],迄今为止,颊脂垫修复缺损后上皮细胞形成,这其中的相关机制和来源仍然没有定论,就新的上皮组织来源而言,目前有3 种可能[8-9]:来源于周围正常黏膜的爬行;来源于口腔黏膜上皮脱落种植;来源于颊脂垫瓣表面的被膜演变。实验过程中发现,颊脂垫修复缺损加速了上皮化进程,并且在愈合初期促进了胶原纤维的沉积。一方面,颊脂垫富含脂肪干细胞(adipose stem cell,ASCs),ASCs可以分化成包括骨、软骨、脂肪、上皮细胞和神经元细胞等[10]。有研究表明[11],颊脂垫脂肪干细胞能够表达典型的脂肪干细胞表面标志物,相比皮下脂肪组织,其密度更大,且具有更强的成软骨、成骨、成脂能力。脂肪干细胞可释放的各种生长因子包括血管内皮生长因子、碱性成纤维细胞生长因子(bFGF )、肝细胞生长因子(HGF)和胰岛素样生长因子1(IGF-1),通过旁分泌促进组织再生创面的愈合[12]。此外,ADSCs 可分泌HGF和VEGF 等血管生成因子,促进了创面生成血管,还有利于形成肉芽组织,加速皮肤创面愈合[13]。本研究发现使用颊脂垫修复后的创面炎性反应轻,可能与ADSCs 促进IL-4、IL-10 等抗炎因子表达有关,其抑制 IL-1、IL-8、TNF-α 等促炎因子分泌来减轻炎症反应[14]。Masson染色发现在愈合早期颊脂垫修复组胶原纤维沉积更快,且排列整齐,这与Hu等[15]研究结果相似。此外Chai等[16]研究也证明ADSCs 条件培养基可降低Ⅰ型、Ⅲ型胶原蛋白及α-SMA的表达,与ADSCs 条件培养基共培养的瘢痕组织中胶原排列更薄、更整齐。源自脂肪干细胞的外泌体可刺激创面内成纤维细胞增殖和迁移,优化胶原沉积,进一步促进创面愈合。在伤口愈合的早期,外泌体增加了胶原蛋白Ⅰ和Ⅲ的产生,而在后期,外泌体可能会抑制胶原蛋白的表达以减少疤痕的形成[15,17]。另一方面,在口腔这个复杂的环境中,唾液也是重要的一部分,回顾既往相关研究发现唾液对创面的愈合有促进作用[18],在本研究中也发现实验组及对照组在术后4 周均上皮化且未发生感染,其中唾液作为口腔中的重要成分在创面愈合过程中保持湿润,且除水分之外还含有多种成分,如酵素、尿素、维生素 B、蛋白质(黏蛋白、球蛋白)、有机物、氨基酸、硫氰酸盐、各种离子和酶等,多种蛋白质因子在抵抗感染过程中有重要作用[19]。此外,唾液中含有的EGF,它能够促进细胞增殖分化,加速皮肤和黏膜创面愈合[20]。与对照组相比颊脂垫修复后上皮化速度更快,而ADSCs 还可直接分化为血管内皮细胞和上皮细胞,增强血管结构并促进创伤皮肤上皮化形成,这一过程中唾液是否有一定的诱导作用值得进一步探究。
本研究仅初步探讨了带蒂颊脂垫修复颊黏膜缺损修复效果,脂肪组织最终转化为上皮,参与其中的脂肪干细胞以及唾液等重要成分的相关机制仍需进一步研究。经过目前分析我们发现带蒂颊脂垫良好的修复效果,这为临床应用提供更坚实的理论基础。在本实验中,有一定的缺陷,未来的研究则需进一步扩大样本量,使得研究结果更具代表性。
