低能量激光疗法联合Dycal用于大鼠磨牙直接盖髓术的体内研究
2022-02-24赵举红仵楠崔灵欣张超杰祖木热提古丽阿不来提徐江
赵举红 仵楠 崔灵欣 张超杰 祖木热提古丽·阿不来提 徐江
牙髓具有营养、防御和修复功能,当牙齿龋坏、外伤或医源性损伤露髓时,易引发炎症、疼痛,造成牙髓坏死,从而影响牙齿功能及寿命。因此活髓保存的研究倍受青睐。激光已被广泛应用于临床医学和口腔医学的辅助治疗中,它不仅增加细胞的三磷酸腺苷(ATP)的产生[1],还具有抗炎、缓解疼痛、止血、加速伤口愈合和促进损伤修复的功能[2-3]。低能量激光疗法(low lever laser therapy,LLLT)也称为光生物效应,具有生物调节作用。
瞬时受体电位通道A1(transient receptor potential A1,TRPA1)为非选择性阳离子通道,使细胞内Ca2+内流,参与细胞及个体的生理病理过程。氧化应激[4],炎症和神经损伤反应等[5]。TRPA1对促血管生成和局部微环境的变化都很敏感[6],在炎症或组织损伤部位被大量发现。
本研究将评价LLLT联合Dycal直接盖髓术后牙髓炎症反应、修复性牙本质形成及检测牙髓内TRPA1、IL-1β的表达情况,探讨二者联合应用对牙髓损伤修复过程中炎症反应的机制。
1 材料与方法
1.1 实验大鼠分组
64 只8 周龄清洁级雄性健康大鼠,体重(200±10) g, 恒牙列完整,无龋齿、畸形及牙体牙周疾病,经本院动物伦理审批(批号: A2019-160-01)后将大鼠随机分成正常对照组(NC)、低能量激光组(LLLT)、Dycal组(Dy组)和低能量激光+Dycal组(LLLT+Dy)4 组(n=16),以左侧上下颌第一磨牙为实验牙,术后第3、 7、 14、 28天每组各处死4 只取样(8 颗实验牙)。
1.2 主要试剂与材料
Denlase半导体激光机(大恒新纪元科技股份有限公司);Dycal(登士柏公司,美国);4%多聚甲醛、水合氯醛、EDTA、 复合消化液(武汉博士德生物工程有限公司);TRPA1(ab62053,1∶150 )、IL-1β(ab9787,1∶200)(Abcam公司,英国);二抗、山羊血清、DAB显色剂(北京中杉金桥生物技术有限公司)。
1.3 实验动物模型的建立
仰卧位固定大鼠,水合氯醛经腹腔注射麻醉,待起效后消毒冲洗口腔,用涡轮机钻于左侧上下第一磨牙中央制备窝洞,待透红后用直径0.5 mm探针轻穿髓,LLLT组用400 μm光纤的建立半导体激光(0.2 W, CW, 10 s)处理穿髓孔,Dy组用生理盐水冲洗,无菌棉球拭干,轻置Dycal于穿髓孔,而LLLT+Dy先用LLLT组相同条件照射穿髓孔,再轻置Dycal无,最后各组均用玻璃离子充填。实验牙调,此过程均有同一名口腔副主任医师在无菌下完成。于术后第3、 7、 14、 28 天各组取标本。
1.4 实验方法及结果分析
1.5 统计学分析
经SPSS 20.0软件统计,各实验组牙髓炎症反应和牙本质桥形成资料选择Kruskal-WallisH非参数秩和检验,按α=0.05检验水准,进一步采用Mann-WhitneyU检验两两间分析,P<0.016 7为差异有统计学意义。免疫组化资料服从正态分布且方差齐,运用单因素单变量的方差分析进行统计,P<0.05。
2 结 果
2.1 牙髓组织及修复性牙本质的形态学观察
2.1.1 正常对照牙HE染色 正常对照牙HE染色可见牙釉质、牙本质及正常牙髓组织,成牙本质细胞排列整齐呈栅栏状,牙髓组织内无明显扩张的毛细血管和炎症细胞(图 1)。
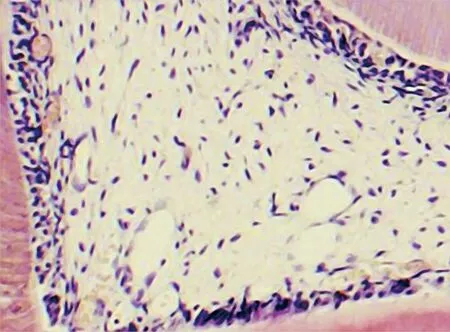
图 1 正常对照组牙髓组织学表现(HE, ×200)
2.1.2 牙髓炎症及修复性牙本质的情况 术后3 d:穿髓孔下方牙髓及成牙本质细胞排列紊乱,血管轻度扩张,以中性粒细胞、巨噬细胞为主急性炎症反应。术后7 d:穿髓孔处有部分牙本质团块,无完整的修复性牙本质形成,血管增生明显,以淋巴细胞为主的慢性炎症反应。术后14 d:穿髓孔下形成比较连续的修复性牙本质,其下方的成牙本质细胞排列较整齐,神经纤维增多,炎症反应减弱,扩张血管减少。术后28 d:几乎无炎症细胞浸润,牙本质形成增厚连续完整(图 2)。
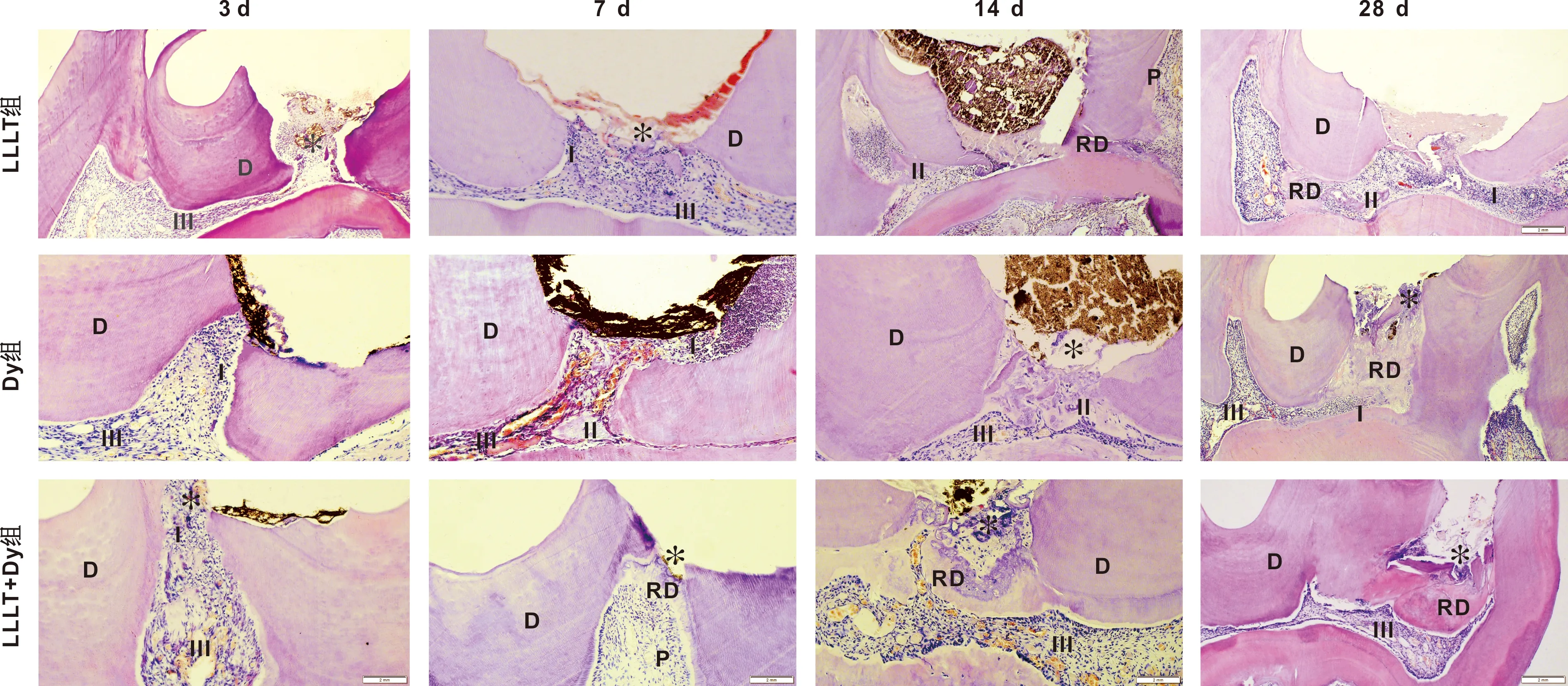
*: 开髓孔; D: 牙本质; P: 牙髓; RD: 修复性牙本质; Ⅰ: 炎症细胞浸润; Ⅱ: 骨样牙本质; Ⅲ: 扩张的毛细血管
2.1.3 牙髓炎症和修复性牙本质的评价表 对各实验组进行评分、统计如表 1。经多独立样本非参数秩和检验统计,各实验组的牙髓炎症及修复性牙本质形成在术后14、 28 d牙两者均统计学差异(P<0.05)。LLLT组的炎反应最重,LLLT+Dy组的炎症反应最轻,LLLT 组与LLLT+Dy组的炎症反应在术后14、28 d都存在统计学差异(P<0.016 7)(表 2)。术后14 d,LLLT+Dy 组修复性牙本质形成的质量及速度好于LLLT组及Dy组,LLLT+Dy组与LLLT组、Dy组均存在统计学差异(P<0.016 7)(表 2),术后28 d, LLLT+Dy组与LLLT组均存在统计学差异(P<0.016 7)(表 2)。
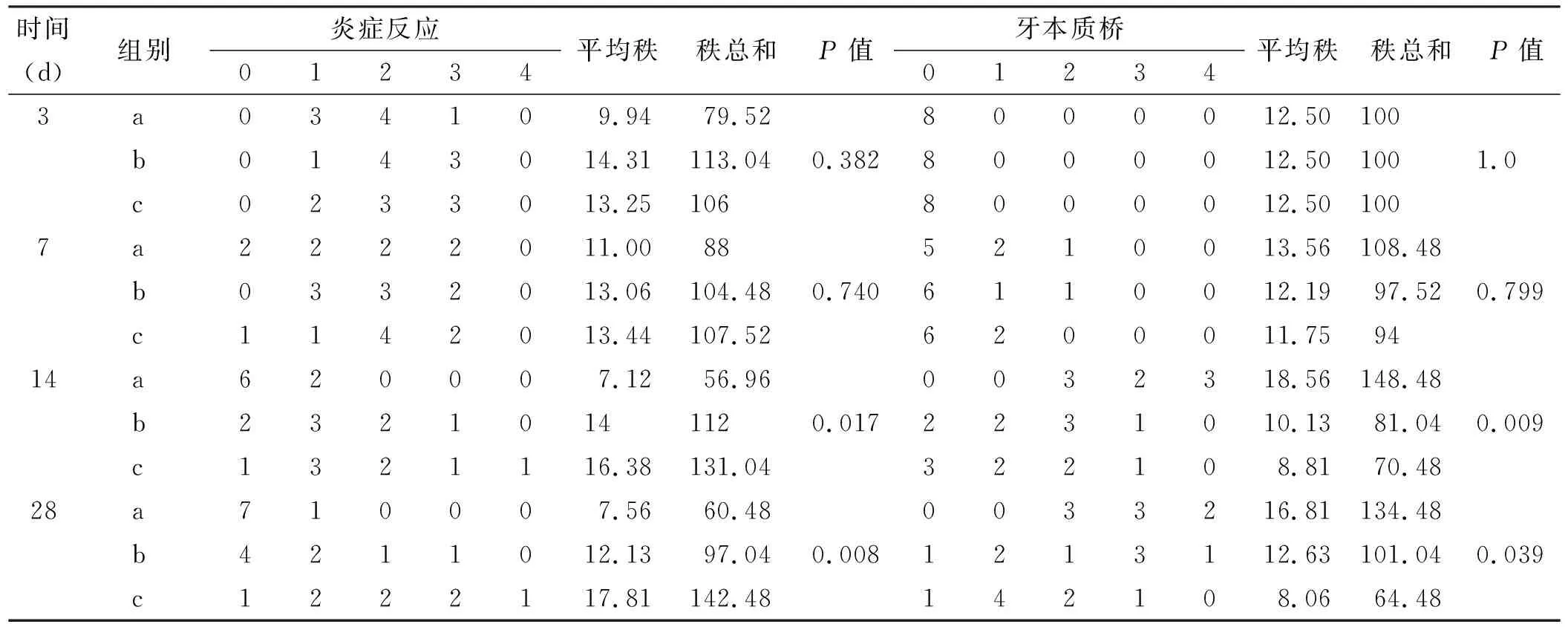
表 1 各实验组牙髓炎症及修复性牙本质形成情况分级统计表(n=8)
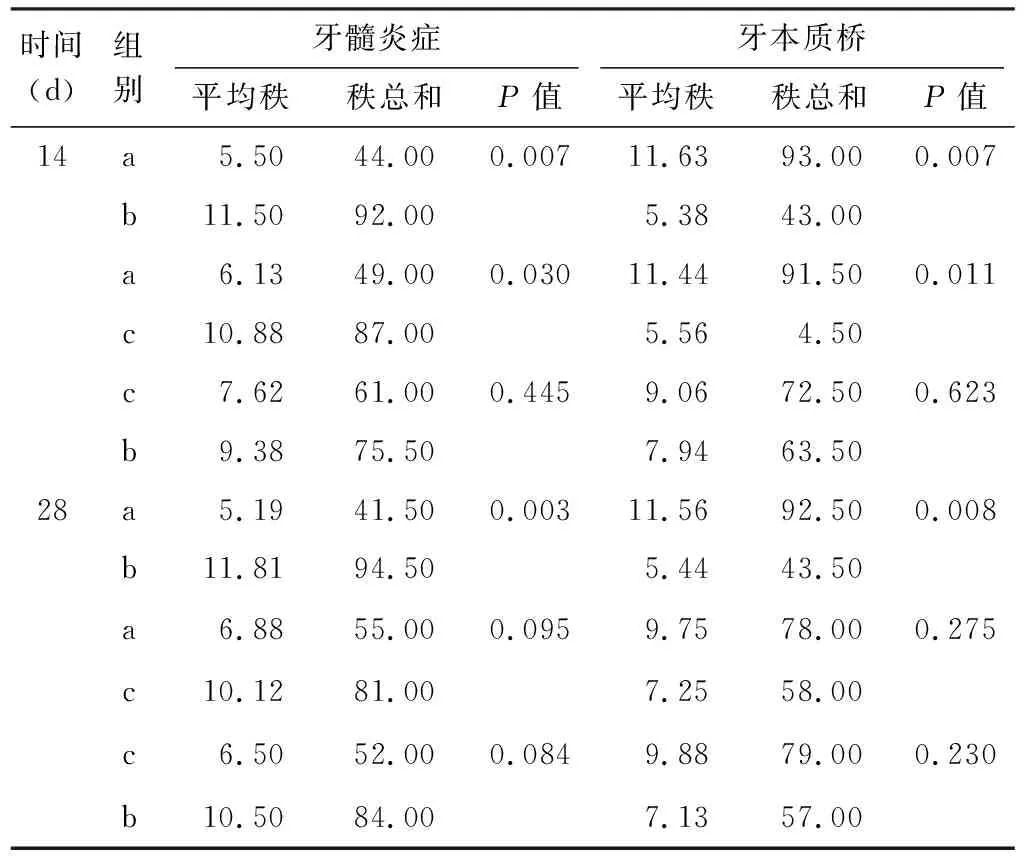
表 2 第14、 28 天组间两两比较牙髓炎症及修复性牙本质形成统计表(n=8)
2.2 IL-1β、TRPA1在盖髓术后牙髓中的表达
2.2.1 IL-1β及TRPA1在正常牙髓中的表达 IL-1β
主要表达在细胞质,部分成牙本质细胞、成纤维细胞表达呈弱阳性;TRPA1主要表达在细胞膜及细胞质,部分成牙本质细胞和少量神经纤维表达呈弱阳性,余细胞表达呈阴性(图 3)。
2.2.2 IL-1β在各实验组牙髓中的表达 术后3 d:部分成牙本质细胞、巨噬细胞、中性粒细胞表达呈强阳性,内皮细胞、成纤维表达呈阳性。术后7 d:部分成纤维细胞表达呈强阳性,成牙本质细胞样细胞、淋巴细胞、内皮细胞表达呈阳性,成牙本质细胞样细胞增殖明显。术后14 d:成牙本质细胞、成牙本质样细胞表达呈强阳性,成纤维细胞、内皮细胞和神经纤维表达呈弱阳性。术后28 d:各实验组表达减弱接近正常对照组,少量成牙本质细胞、内皮细胞表达呈阳性。少量成纤维细胞表达呈弱阳性(图 4)。
2.2.3 TRPA1在各实验组牙髓组织中的表达 术后3 d:成纤维细胞、内皮细胞及神经纤维表达呈阳性,部分成牙本质细胞、巨噬细胞、中性粒细胞、 肥大细胞表达呈弱阳性。术后7 d:成牙本质细胞、成纤维细胞和神经纤维表达呈强阳性,成牙本质样细胞、内皮细胞、淋巴细胞表达呈阳性。术后14 d:成牙本质细胞、成牙本质样细胞和成纤维细胞达呈强阳性。术后28 d:各实验组表达减弱接近正常对照组,少量成纤维细胞表达呈阳性,少量成牙本质细胞、内皮细胞以及神经纤维织表达呈弱阳性(图 4)。
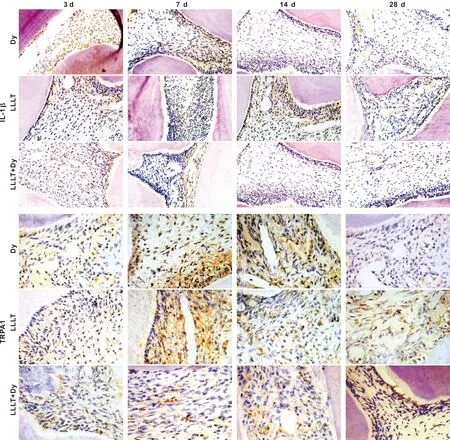
图 4 IL-1β、 TRPA1在不同实验组牙髓中的表达情况(IHC, ×400)
2.2.4 各组在盖髓术后不同时间点TRPA1表达阳性染色的MOD值 第3、7、14、28 d中除了28 dLLLT+Dy和Dy组其他各实验组中均与正常对照组比TRPA1阳性染色的MOD值存在显著性差异(P<0.05)。7 d:Dy组>LLLT组>LLLT+Dy组的TRPA1阳性MOD值; 14 d:LLLT组、Dy组>LLLT+Dy组的TRPA1阳性MOD值,存在显著性差异(P<0.05); 28 d:LLLT组>Dy组、LLLT+Dy组TRPA1阳性MOD值,存在显著性差异(P<0.05)(表 3)。
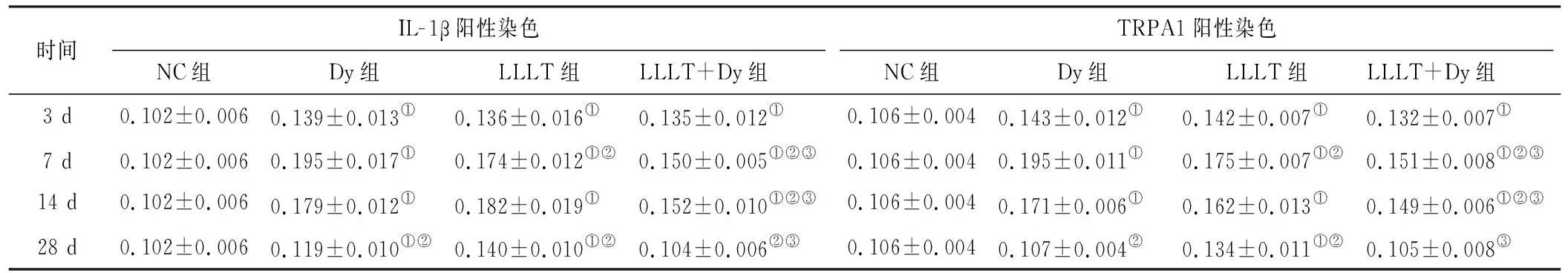
表 3 4 组盖髓术后IL-1β阳性染色、TRPA1阳性染色的平均吸光度A值
3 讨 论
牙髓是由成牙本质细胞、成纤维细胞、血管和神经等组成的疏松结缔组织,被包绕在矿化的牙齿中,对牙齿的感觉和功能起着重要的作用[8]。若牙髓暴露或受损需行直接盖髓术时,盖髓材料是为了隔绝牙髓与外界有害刺激,提供牙髓修复的微环境。氢氧化钙于1930 年被首次应用于直接盖髓术。Dycal相对氢氧化钙pH值较低,固化时间短, 密封性好, 是一种优良的盖髓剂。Er∶YAG激光提高了常规直接盖髓(Dycal)的疗效[9]。LLLT可降低IL-1β、ICAM-1等炎症因子的表达,减轻炎症渗出、充血和水肿。
牙髓炎症及修复性牙本质形成是盖髓后评价疗效的重要因素,在本研究LLLT组及LLLT+Dy组中LLLT照射穿髓孔,能量先被组织吸收,瞬间转移到细胞,可能会引起细胞增殖分化、细胞因子及相关蛋白质释放来减轻炎症,促进组织愈合。可见在盖髓术后第3、7天牙髓炎症LLLT组、Dy组比LLLT+Dy组反应重,LLLT组和Dy组无统计学意义,说明在牙髓损伤修复的前期, LLLT和Dycal具有类似的抗炎盖髓作用, 且二者联合效果更好。可能是因为LLLT可增强线粒体电子转移和ATP产生,并刺激人中性粒细胞(PMN)的氧化爆发,提高杀灭细菌的能力[10]。第14、 28 天可见牙髓炎症LLLT+Dy组比LLLT组反应轻,具有显著性差异。笔者推测在盖髓修复后期,LLLT组牙髓炎症反应重及修复性牙本质形成变慢均与LLLT组玻璃离子具有中重度细胞毒性,封闭性差,且与牙髓直接接触有关。术后14 d LLLT+Dy组均比单独盖髓组形成修复性牙本质效果好,这可能LLLT促进牙髓细胞、成牙本质细胞增殖、分化和血管生成密切相关[11]。并且LLLT可增强h-BMMSCs源性成牙细胞样细胞DMP1和ALP基因表达、细胞增殖和基质矿化[12]。GaAIAs 激光照射大鼠磨牙,诱导牙髓矿化促进修复性牙本质形成[13]。术后28 d时联合组与Dy组在修复性牙本质形成没有统计学意义,说明LLLT具有时限性,与研究低功率He∶Ne激光在种植术后早期促进种植体周围成骨细胞增殖提高成骨活性结果一致[14]。
牙髓修复程序中有TNF-α、TGF-β、Runx2、DMP1、IL-β等一系列因子参与,而IL-1β是一种促炎因子,参与牙髓炎症并发挥着关键因素。有研究发现有效降低hDPSCs分泌IL-1β、IL-6、IL-8等促炎因子起到良好的抗炎和促进hDPSCs分化作用[15]。TRPA1是c-纤维释放神经肽的炎症介质和守门人,在组织损伤或受到机械、温度、氧化应激等因素刺激时,相应部位释放出的炎症介质不仅能够激活 TRPA1 还可进入局部受损组织产生神经源性的炎症反应[16]。现研究TRPA1可诱导牙髓细胞分化,矿化形成修复性牙本质[17]。本研究在盖髓术后IL-1β、TRPA1表达一致,术后第3、7 天各实验组中成牙本质细胞、成纤维细胞、血管内皮细胞、炎症细胞中均有不同程度的IL-1β、TRPA1阳性表达。LLLT 可抑制TNF-α、IL-1β和MMP-13的分泌,达到减轻炎症疼痛的作用[18]。也有学者发现TRPA1在牙本质敏感大鼠牙髓中表达上调,随刺激强度而增加[19]。术后7 d时,两因子阳性表达的MOD值LLLT+Dy组、LLLT组、Dy组呈递增趋势,且有统计学意义,显示了LLLT在牙髓修复程序中可能通过减少IL-1β、TRPA1表达来减轻炎症。
本研究通过Dycal是否联合LLLT进行直接盖髓后发现联合组炎症反应轻,修复性牙本质形成快,可能与LLLT减少IL-1β、TRPA1表达相关,加速牙髓再生,促进骨矿化。具体机制有待进一步研究。
