温阳利湿化瘀方对乙肝相关慢加急性肝衰竭患者早期血清内毒素和炎症因子的影响*
2022-02-24张修举张引强宋烨闻中国中医科学院西苑医院北京100091
张修举 郭 瑞 张引强 陈 艳 宋烨闻(中国中医科学院西苑医院,北京 100091)
乙肝相关慢加急性肝衰竭(HBV-ACLF)是在慢性肝病基础上发生肝功能严重障碍或失代偿的肝衰竭常见类型之一,具有病情进展迅速、症状严重、治疗难度大、预后差等特点[1-2]。由于该病的发病机制尚未明确,临床多采用内科保守治疗,缺乏特异且有效的治疗药物[3]。国内关于肝衰竭诊治的指南中指出[4],可根据HBV-ACLF临床表现将其分为前期、早期、中期和晚期,而临床如果能有效阻止肝衰竭早期向中晚期进展,治疗效果则会明显提升,有助于降低患者病死率。既往研究发现[5],在西医治疗基础上应用中药治疗有助于提高HBV-ACLF的治疗效果,进一步改善患者临床症状。中医学中并无肝衰竭这一病名,根据其黄疸、乏力等临床表现,可纳入“急黄”“瘟黄”等范畴,多数现代中医学家认为热、毒、瘀和虚是本病的关键病机[6]。本研究主要探讨温阳利湿化瘀方对HBV-ACLF患者早期血清内毒素和炎症因子的影响。现报告如下。
1 资料与方法
1.1 病例选择 西医诊断符合《肝衰竭诊治指南(2018年版)》[7]中关于HBV-ACLF的诊断标准;中医诊断参照《慢加急性肝衰竭中医内科临床诊疗指南》[8]中阳虚瘀黄证的辨证标准。纳入标准:符合中、西医诊断标准中的HBV-ACLF阳虚瘀黄证患者,存在乙型肝炎病毒(HBV)感染史;年龄18~65岁;同意参与本次研究且签署知情同意书者。排除标准:合并艾滋病、肺结核等其他传染性疾病者;妊娠期或哺乳期妇女;丙型肝炎、丁型肝炎、戊型肝炎、酒精性肝损害或其他免疫疾病等因素引发的ACLF;肝硬化失代偿期;近期使用明确损肝药物者;合并原发性肝癌或其他恶性肿瘤者;精神障碍、认知功能障碍者;对中药成分过敏或严重过敏体质者。
1.2 样本量估算 参考相关文献[9],根据公式n1=n2=(Uα+Uβ)2×2P(1-P)(/P1-P0)2计算各组所需样本量,其中n1表示观察组样本数,n2表示对照组样本数,P=(P1+P0)/2,α=0.05,β=0.10,Uα=1.65,Uβ=1.28,得出n1=n2≈61,考虑20%的脱落率,最终得到观察组样本数=n1×120%≈73=对照组样本数。
1.3 临床资料 选取2019年4月至2021年4月本院收治的146例HBV-ACLF早期患者为研究对象,按照随机数字表法分为观察组与对照组各73例。观察组男性 62例,女性11例;年龄37~65岁,平均(49.26±5.23)岁;慢性肝衰竭病程0.5~2.5年,平均(1.18±0.41)年;急性病程平均(12.11±1.25)d;ACLF分型:A型15例,B型58例。对照组男性64例,女性9例;年龄35~64岁,平均(49.81±5.02)岁;慢性肝衰竭病程0.5~2年,平均(1.29±0.35)年;急性病程平均(12.39±1.13)d;ACLF分型:A型19例,B型54例。两组一般资料比较差异无统计学意义(P>0.05)。
1.4 治疗方法 对照组患者参照指南[10]予以西医常规治疗,具体为1)护肝降酶退黄。注射用还原型谷胱甘肽(上海复旦复华药业有限公司,国药准字H20031265)1.2 g加入0.9%氯化钠注射液100 mL静脉滴注,每日1次;异甘草酸镁注射液(江苏正大天晴药物股份有限公司,国药准字H20051942)200 mg加入10%葡萄糖注射液250 mL静脉滴注,每日1次;注射用丁二磺酸腺苷蛋氨酸(浙江海正药业股份有限公司,国药准字H20103110)1.0 g/d静脉注射,每日1次。2)改善微循环。前列地尔注射液(北京泰德制药有限公司,国药准字10980024,规格:2 mL∶10 μg)1支加入5%葡萄糖注射液100 mL静脉滴注,每日1次。3)促进肝细胞生长。注射用促肝细胞生长素(哈尔滨三联药业有限公司,国药准字H20066333)120 μg加入10%葡萄糖液250 mL静脉滴注,每日1次。4)抗病毒。马来酸恩替卡韦片(江苏正大天晴药物股份有限公司,国药准字H20100019)0.5 mg/d,口服使用。5)予以卧床休息,输注冰冻血浆、人工肝、抗菌药物等对症支持措施。观察组在对照组治疗基础上采用温阳利湿化瘀方:薏苡仁、茵陈、赤芍各30 g,丹参20 g,郁金15 g,白术12 g,虎杖、附片(先煎)、葛根各10 g。由中国中医科学院西苑医院煎药室统一配置,水煎取汁200 mL,每日1剂,分早晚2次服用。两组治疗3周后观察指标变化情况。
1.5 观察指标 1)实验室指标:分别采集两组患者治疗前后的外周静脉血样本,采用全自动血液分析仪检测中性粒细胞数和淋巴细胞数,并计算中性粒细胞/淋巴细胞比值(NLR);采用ELISA法检测血清白细胞介素-6(IL-6)水平,试剂盒购自美国R&D公司;采用动态浊度法检测内毒素(ET)水平。2)肝功能指标:采用全自动生化分析仪检测两组患者治疗前后的血清总胆红素(TBIL)、直接胆红素(DBIL)、天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、白蛋白(ALB)水平,试剂盒购自上海德赛诊断系统有限公司。3)中医证候评分:参照《中药新药临床研究指导原则》[11]中相关内容,对两组治疗前后的临床症状进行量化评分,分值范围为0~6分,各症状得分之和为中医证候评分,得分越高提示症状越严重。4)MELD评分:采用终末期肝病模型MELD评分评价两组病情严重程度[12],计算公式=3.8 ln[胆红素(mg/dL)]+11.2ln(INR)+9.6ln[肌酐(mg/dL)]+6.4(病因:胆汁性或酒精性0,其他1)。5)凝血功能:采用全自动凝血分析仪检测两组患者的凝血酶原时间(PT)、凝血酶原活动度(PTA)。6)安全性评价:记录两组治疗期间用药不良反应。
1.6 疗效标准 显效:中医证候评分改善率≥75%,患者身目黄染、色黄晦暗、乏力等临床症状和体征明显改善。有效:中医证候评分改善率≥30%,但<75%,患者身目黄染、色黄晦暗、乏力等临床症状和体征有所改善。无效:未达到以上标准者,或中医证候评分改善率<30%,患者临床症状体征较治疗前无改善甚至加重。总有效率=(显效+有效例数)/总例数×100%。
1.7 统计学处理 应用SPSS23.0统计软件。符合正态分布的计量资料以()表示,组间比较用t检验;计数资料采用“例”或“%”表示,两组比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组治疗前后实验室指标比较 见表1。两组治疗后NLR、IL-6、ET水平均较治疗前下降,观察组治疗后NLR、IL-6、ET水平显著低于对照组(P<0.05)。
表1 两组治疗前后实验室指标比较(±s)
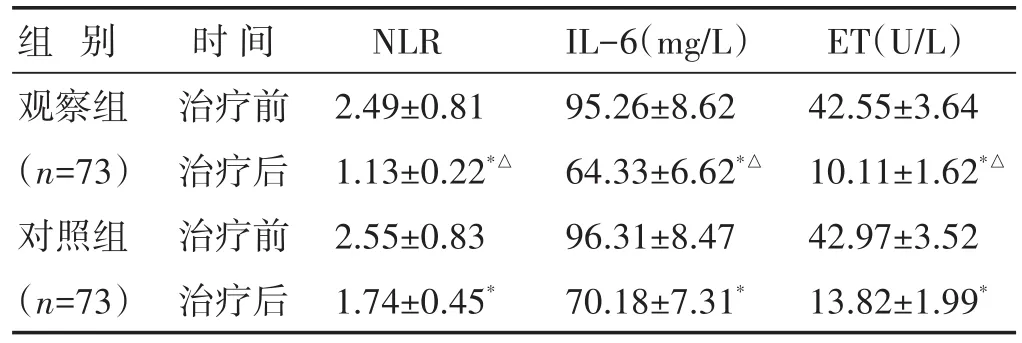
表1 两组治疗前后实验室指标比较(±s)
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,△P<0.05。下同。
组别观察组(n=73)对照组(n=73)时间治疗前治疗后治疗前治疗后NLR 2.49±0.81 1.13±0.22*△2.55±0.83 1.74±0.45*IL-6(mg/L)95.26±8.62 64.33±6.62*△96.31±8.47 70.18±7.31*ET(U/L)42.55±3.64 10.11±1.62*△42.97±3.52 13.82±1.99*
2.2 两组治疗前后肝功能指标比较 见表2。两组治疗前TBIL、DBIL、AST、ALT、ALB水平比较差异无统计学意义(P>0.05)。两组治疗后TBIL、DBIL、AST、ALT水平均较治疗前下降,ALB水平较治疗前上升;观察组治疗后TBIL、DBIL、AST、ALT水平显著低于对照组,ALB水平显著高于对照组(P<0.05)。
表2 两组治疗前后肝功能指标比较(±s)

表2 两组治疗前后肝功能指标比较(±s)
组别观察组(n=73)对照组(n=73)时间治疗前治疗后治疗前治疗后TBIL(μmol/L)459.88±52.36 172.51±25.67*△461.93±50.74 205.63±31.59*DBIL(μmol/L)289.69±36.57 112.39±8.33*△290.74±35.64 125.87±12.97*AST(IU/L)829.64±85.63 70.29±3.62*△831.91±82.48 79.82±8.51*ALT(IU/L)1 342.62±118.93 85.69±12.35*△1 339.68±120.88 92.34±19.37*ALB(g/L)31.59±6.54 37.91±9.31*△32.03±6.29 35.20±8.54*
2.3 两组治疗前后中医证候评分和MELD评分比较见表3。两组治疗后中医证候评分和MELD评分均较治疗前下降,观察组治疗后1周、2周、3周的中医证候评分和MELD评分显著低于对照组(P<0.05)。
表3 两组治疗前后中医证候评分和MELD评分比较(分,±s)
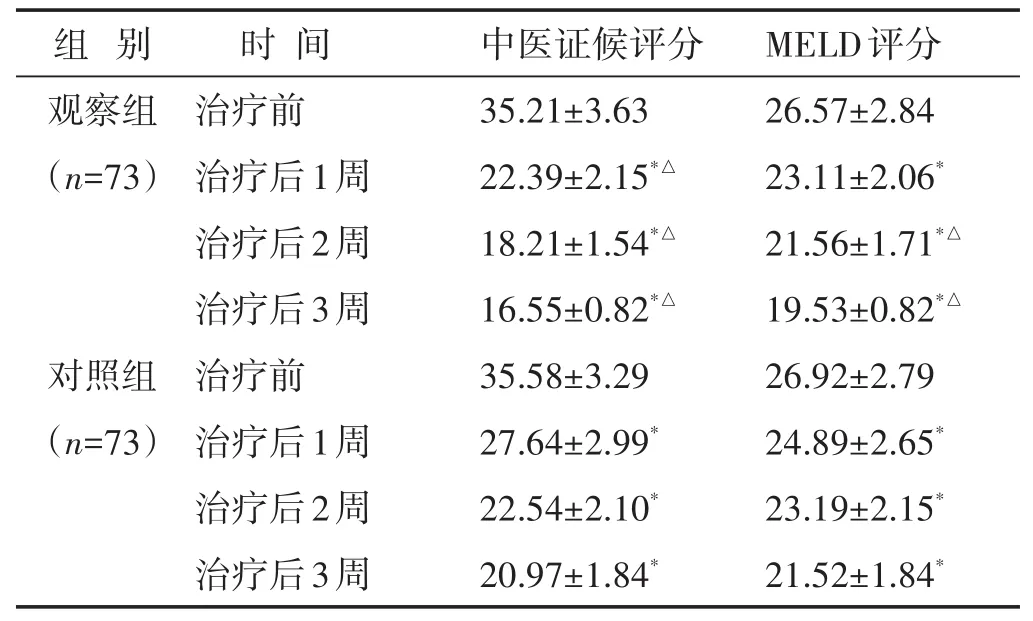
表3 两组治疗前后中医证候评分和MELD评分比较(分,±s)
组 别 时 间 中医证候评分MELD评分观察组(n=73)对照组(n=73)治疗前治疗后1周治疗后2周治疗后3周治疗前治疗后1周治疗后2周治疗后3周35.21±3.63 22.39±2.15*△18.21±1.54*△16.55±0.82*△35.58±3.29 27.64±2.99*22.54±2.10*20.97±1.84*26.57±2.84 23.11±2.06*21.56±1.71*△19.53±0.82*△26.92±2.79 24.89±2.65*23.19±2.15*21.52±1.84*
2.4 两组治疗前后凝血功能指标比较 见表4。两组治疗后PT水平均较治疗前下降,PTA水平较治疗前上升;观察组治疗后PT水平明显低于对照组,PTA水平显著高于对照组(P<0.05)。
表4 两组治疗前后凝血功能指标比较(±s)
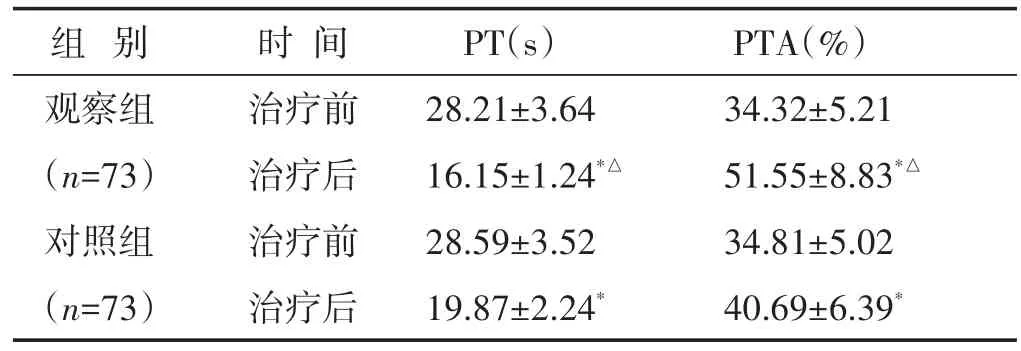
表4 两组治疗前后凝血功能指标比较(±s)
组别观察组(n=73)对照组(n=73)时间治疗前治疗后治疗前治疗后PT(s)28.21±3.64 16.15±1.24*△28.59±3.52 19.87±2.24*PTA(%)34.32±5.21 51.55±8.83*△34.81±5.02 40.69±6.39*
2.5 两组中医证候疗效比较 见表5。观察组中医证候总有效率明显高于对照组(P<0.05)。

表5 两组中医证候疗效比较(n)
2.6 安全性评价 两组治疗期间生命体征未见明显异常,观察组患者出现2例恶心呕吐等胃肠道反应,未予以特殊处理后自行缓解,未对观察指标产生严重影响。
3 讨论
HBV-ACLF是常见的肝衰竭类型之一,中医学根据其临床症状和体征纳入“急黄”“瘟黄”“肝瘟”等范畴。《金匮要略·黄疸病脉证并治第十五》中指出“黄家所得,从湿得之”。可见急黄的发生与“湿”存在密切关联。现代中医学家认为该病的基本病机在于正虚邪实,“肝、肾、脾”为本虚,“毒、热、湿、瘀”为标实,中医证型可分为湿热瘀黄、气虚瘀黄、阳虚瘀黄等,而阳虚瘀黄证为临床常见证型之一[13]。肝衰竭的发生多因外感湿热疫毒之邪,毒热炽盛内陷,湿浊蒙蔽清窍,《黄帝内经》云“正气存内,邪不可干;邪之所凑,其气必虚”。其外受之湿邪能侵犯人体,可见体内正气不足。同时肝病日久,患者多有长期服用药物史,容易对脾胃造成损伤,而湿热-血瘀-脾虚等情况相互影响,则会进一步加重肝衰竭患者的病情,因此在解毒凉血化瘀的基础上注意顾护脾胃,同时加以温法进行早期干预[14]。
本研究所用的温阳利湿化瘀方中茵陈、附片两药共为君药,附片温补脾肾,茵陈利湿退黄;丹参、虎杖、郁金、赤芍共为臣药,丹参活血凉血,赤芍化瘀止痛,虎杖利湿退黄、清热解毒;郁金活血止痛,4药合用可增强君药利湿退黄的功效,同时兼有清热凉血化瘀的功效;白术、葛根、薏苡仁为佐使药,具有健脾益气燥湿的功效,诸药合用,共起利湿退黄、解毒化瘀、温阳健脾之功效。现代药理研究发现,茵陈所含黄酮类、有机酸类等有效成分对维护肝细胞膜完整性、促进肝细胞再生等有良好效果,并具有良好的抗病毒作用[15-16]。附片所含有效成分对促进大鼠肝细胞内能量消耗具有重要价值[17]。杜珊等[18]研究指出,温阳解毒化瘀颗粒可通过下调肝衰竭肠源性内毒素血症大鼠的肝脏TLR4 mRNA表达水平进而改善其肝功能,减轻肝细胞损伤。本研究结果显示:观察组治疗后TBIL、DBIL、AST、ALT水平显著低于对照组,ALB水平显著高于对照组;观察组治疗后PT水平明显低于对照组,PTA水平显著高于对照组;且观察组中医证候总有效率为86.30%,明显高于对照组的65.75%,提示在西医治疗基础上,联合温阳利湿化瘀方治疗HBV-ACLF患者可显著改善其肝功能和凝血功能指标,中医证候疗效良好。
现代医学研究认为内毒素血症是肝衰竭的第三重致命性打击,主要指肝衰竭患者由于Kupffer细胞功能严重受损,进而导致门静脉的大量内毒素未经解毒而溢入体循环,加重肝损害程度,是造成患者病情进展的重要原因之一[19]。有研究指出[20-21],NLR 是预测HBV-ACLF患者预后的独立危险因素,其水平越高,患者病情越严重。IL-6是一种由T细胞、单核-巨噬细胞等多种细胞产生的促炎因子,为近年来监测HBVACLF患者预后的重要指标之一。本研究结果中,观察组治疗后NLR、IL-6、ET水平显著低于对照组,治疗后1周、2周、3周的中医证候评分和MELD评分显著低于对照组。MELD评分是评估HBV-ACLF患者病情严重程度的重要评分系统。提示温阳利湿化瘀方有助于缓解HBV-ACLF患者病情严重程度,推测可能与降低血清内毒素和炎症因子水平有关。
综上所述,在西医治疗基础上联合温阳利湿化瘀方治疗HBV-ACLF患者可显著改善其肝功能和凝血功能指标,疗效良好,有助于患者病情严重程度和中医证候评分,可能与降低血清内毒素和炎症因子水平有关。本研究存在一定的不足之处,如缺乏对患者的后期随访、属于单中心研究、未增设动物实验等,故研究结果有待进一步深入探讨。
