AFP联合ALT和T-Bil检测在肝细胞肝癌中的诊断价值
2022-02-24蒲癸宏徐玉娟龚睿李军李美析王强
蒲癸宏 徐玉娟 龚睿 李军 李美析 王强
(1. 乐山市中医医院检验科,四川 乐山 614000; 2. 川北医学院附属医院检验科,四川 南充 637000)
肝细胞肝癌(hepatocellular carcinoma,HCC)是世界上第五常见的恶性肿瘤,也是第三常见的癌症相关死亡原因[1-2],每年有超过50万的新发病例,并造成每年30~50万人的死亡[3-4]。HCC患者的5年生存率与诊断的时期密切相关,早期HCC患者的5年生存率超过75%,而中晚期HCC患者的5年生存率远低于10%[5-6]。由于诊断早期HCC非常困难,大多数患者诊断时已处于中晚期,这是造成HCC预后较差的主要原因[1,7]。
HCC的诊断主要依赖于影像学检测技术和肿瘤标志物的检测,而肿瘤标志物广泛被临床医生和受检者接受[8-9]。甲胎蛋白(Alpha-fetoprotein, AFP)是目前临床运用非常广泛的用于诊断HCC的肿瘤标志物[10-11],并被写入我国肝病学会发布的HCC诊断指南中。在临床使用过程中,约80%的肿瘤大小<3 cm的早期HCC病例不存在AFP的升高,因此,AFP诊断早期肝细胞肝癌的敏感性仅为20%~60%[12-13]。丙氨酸氨基转移酶(ALT)是常用于评价肝细胞急性损伤的生物标志物,在急慢性病毒性肝炎、酒精性肝炎以及肝硬化人群中,均升高;而在HCC人群中, ALT 不升高或仅存在轻度升高[14]。胆红素是一种内源性化合物,在某些情况下可能有毒,但另一方面,轻度非结合型高胆红素血症可能会预防心血管疾病和肿瘤的发展[15]。多个研究[16]表明,HCC患者血清总胆红素浓度远远低于良性肝病患者。因此,基于以上情况,尝试在HCC人群中,通过AFP、ALT和总胆红素(Total bilirubin, T-Bil)建立一种联合诊断模式,期望能够通过建立的联合诊断模式提高对HCC的诊断敏感性,同时提高与其它肝脏疾病之间的鉴别诊断价值。
1 材料与方法
1.1 研究对象 选取乐山市中医医院2017年1月~2019年12月确诊为肝细胞肝癌的初诊患者552例(HCC组),其中早期HCC患者196例(早期HCC组),血清AFP≥20 ng/mL的HCC患者351例,血清AFP≥20 ng/mL的早期HCC患者106例。另选取肝脏良性疾病1857例作为对照组。纳入标准:入选患者均为首诊患者,并且在血液样本采集前均未进行任何临床干预措施。HCC诊断按照中国临床肿瘤学会发布的原发性肝癌诊疗指南(2018.V1)标准进行[11]。肝脏仅有单个肿瘤且肿瘤直径≤5.0 cm,或存在2~3个肿瘤结节,单个肿瘤直径<3.0 cm,无血管侵犯和肝外转移的情况定义为早期HCC[17-18]。对照组中胆管疾病223例,胆囊疾病405例,肝炎疾病466例,肝硬化558例,肝囊肿99例,肝血管瘤106例,血清AFP ≥ 20 ng/mL的肝脏良性患者444例。
1.2 血清AFP、 ALT和T-Bil水平检测 血清AFP浓度采用Centaur XP化学发光检测系统及其配套试剂盒检测(西门子股份公司,德国),血清ALT和T-Bil浓度采用BS-2000M全自动生化检测系统及其配套试剂盒检测(迈瑞医疗国际股份有限公司,中国)。
1.3 统计学分析 数据分析采用 SPSS 19.0软件包完成。试验数据采用中位数(四分位间距)表示,AFP, ALT和T-Bil联合建立的诊断方式,其数据采用相应指标检测结果计算所得的指数值表示。两组人群性别比较采用Pearson Chi-square test,两组间数据比较采用Mann-Whitney U检验,两因素相关性分析采用Pearson 相关分析,ROC曲线确定诊断临界值、曲线下面积、诊断敏感度和特异性。曲线下面积比较采用Medcalc 12.3软件包完成。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较 HCC组患者和对照组年龄均集中于中老年人群,以男性为主,HCC组患者年龄高于对照组(P<0.001)。HCC患者和早期HCC患者血清AFP水平均明显高于对照组患者 (P<0.001),而血清ALT和T-Bil水平均明显低于对照组患者(P<0.001)。见表1、图1。
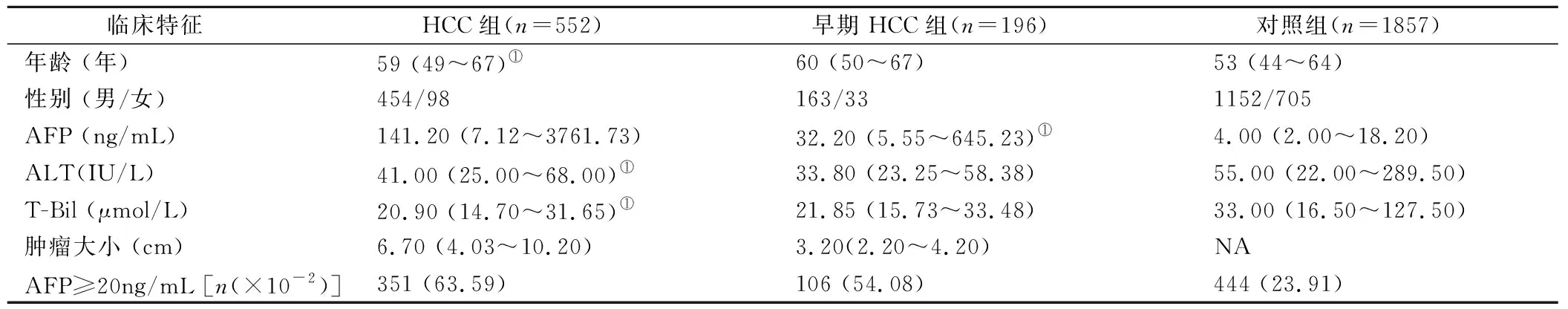
表1 一般资料比较

图1 3组患者血清AFP、ALT和T-Bil水平之间的比较
2.2 联合诊断方式在HCC和早期HCC中的诊断价值 HCC组患者血清AFP水平和联合诊断方式指数水平与肿瘤大小呈明显正相关 (P<0.001) (见图2)。HCC组和早期HCC组联合诊断方式指数水平明显高于对照组(P<0.001) (见图3A)。以肝脏良性疾病人群为对照,诊断阈值分别设定为12.75×10-3和7.44×10-3时,联合诊断方式诊断HCC和早期HCC的AUROC分别为0.869 (95%CI:0.852~0.886)和0.841 (95%CI:0.812~0.870),均明显高于AFP的0.782 (95%CI:0.758~0.806)和0.741 (95%CI:0.702~0.779) (P<0.001) ,见表2、图3B、图3C。
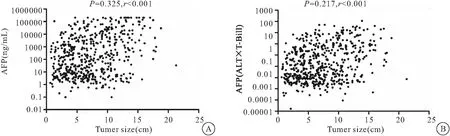
图2 AFP和联合诊断方式水平与肿瘤大小的相关性
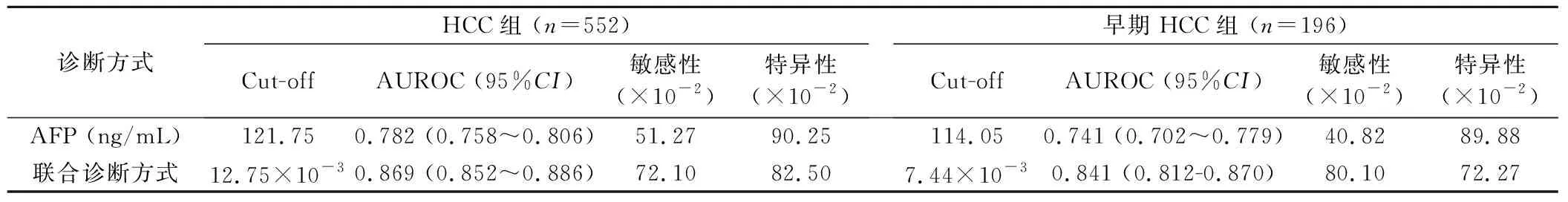
表2 AFP和联合诊断方式在HCC和早期HCC中的诊断价值

图3 A.3组联合诊断方式指数水平之间的比较
2.3 联合诊断方式在血清AFP≥20ng/mL的HCC和早期HCC中的诊断价值 以444例血清AFP ≥ 20 ng/mL的肝脏良性疾病人群作为对照人群,诊断阈值分别设定为51.31×10-3和55.51×10-3时,联合诊断方式诊断血清AFP≥20 ng/mL的HCC和早期HCC的AUROC,均明显高于AFP,见表3、图4。
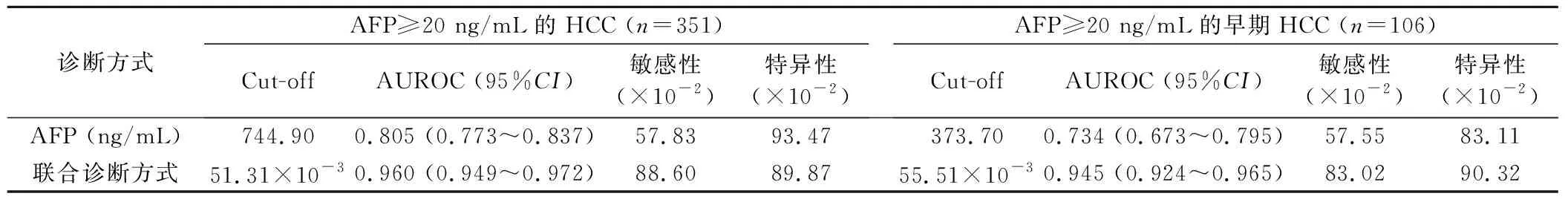
表3 AFP和联合诊断方式在血清AFP ≥ 20ng/mL的HCC和早期HCC中的诊断价值
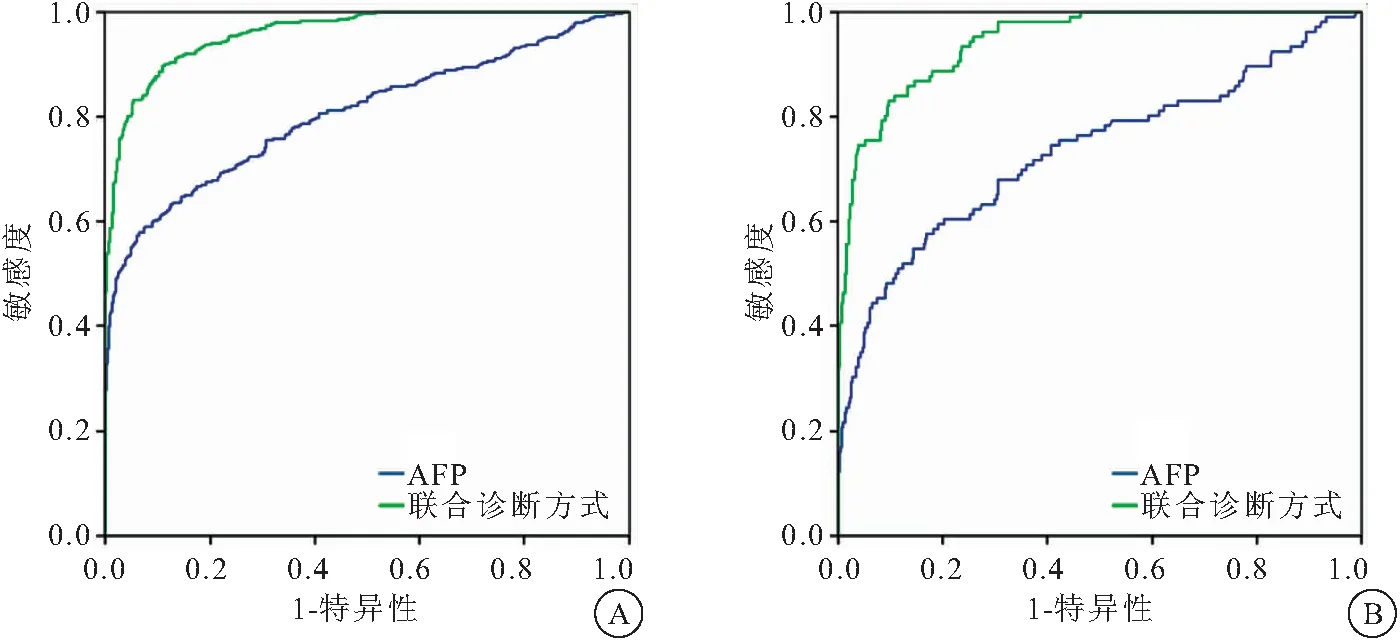
图4 AFP和联合诊断方式诊断血清AFP≥20 ng/mL的HCC和早期HCC的ROC曲线
3 讨论
本文通过比较HCC人群和肝脏良性疾病人群血清AFP,ALT和T-Bil水平,利用ROC曲线评价AFP单独和以AFP/(ALT×T-Bil)比值作为AFP联合ALT和T-Bil的诊断方式诊断早期HCC,HCC和血清AFP异常HCC的诊断价值。通过数据分析发现,临床常用的肿瘤标志物AFP联合肝脏代谢相关的指标ALT和T-Bil用于诊断不同分类HCC的诊断价值均优于AFP单独使用时的诊断价值;联合诊断方式诊断血清AFP异常的早期HCC和HCC病例时获得很高的诊断价值,诊断敏感性均超过80%,诊断特异性均超过90%,从而在很大程度上提高了血清AFP异常的HCC在早期被发现的概率,提高受检人群的生存率。因此,联合诊断方式可作为HCC,尤其是血清AFP异常的早期HCC和HCC的新诊断模式。
异常凝血酶原(Protein induced by vitamin K absence or antagonist-Ⅱ,PIVKA-Ⅱ)是一种在肝细胞合成过程中缺乏维生素K而导致合成缺陷的凝血酶原[19]。作为新近发现的诊断肝细胞肝癌的肿瘤标志物,PIVKA-Ⅱ具有比AFP更高的诊断价值,其在早期HCC的检测敏感性超过50%[20]。然而,由于PIVKA-Ⅱ价格昂贵,较多医院,尤其是基层医院均未开展,因此,本研究仅对临床常用的肝细胞肝癌相关的肿瘤标志物AFP进行了分析和研究。研究数据表明,AFP在部分HCC和肝脏良性疾病中均存在升高的情况,但在肝脏良性疾病中的升高程度或比例明显低于HCC,这是AFP能够作为诊断HCC的肿瘤标志物的重要原因。而AFP诊断HCC的敏感性约为50%,这与已有的报道结论一致[21-22]。结果表明,单独使用AFP用于HCC的诊断时,会存在较大部分病例的漏检,从而限制了AFP作为HCC肿瘤标志物的广泛运用。HCC病例中,血清ALT和T-Bil水平均明显低于肝脏良性疾病人群,因此,我们以在HCC中血清水平存在明显升高的AFP与存在明显降低的ALT和T-Bil之间的比值构建了HCC的新诊断方式。结果表明,联合诊断方式对于诊断不同类型的HCC的诊断价值均明显优于AFP单独使用时,表明联合诊断方式适用于HCC的诊断。
血清AFP≥20 ng/mL常作为诊断HCC的截断值[23-24]。通常情况下,在临床症状没有出现之前,AFP检测结果异常时才会引起临床医生和受检人群的足够重视,因此我们评估了在AFP出现异常时,联合诊断方式对血清AFP异常的早期HCC和HCC的诊断价值。血清AFP水平异常的HCC病例中,AFP的诊断效率未出现明显的变化。然而,联合诊断方式在诊断血清AFP水平异常的早期HCC和HCC病例中的诊断效率较诊断所有早期HCC和HCC病例时的诊断效率有明显的提高,数据结果一方面表明,联合诊断方式是一种非常值得推广的诊断模式。另一方面,也是令我们非常担忧的,少部分AFP检测结果正常的病例应给予更多的关注,由于血清AFP水平与肿瘤大小呈正相关,我们认为应加强高风险人群的血清AFP的随访,同时定期进行灵敏度较高的影像学检测技术,如CT或MRI,以便能够更加早期地对HCC进行诊断和治疗,提高HCC患者的生存率、预后以及患者生活质量。
4 小结与展望
联合诊断方式是一种适用于诊断HCC的诊断模式,诊断价值明显优于AFP单独运用时。而对于少部分的诊断阴性病例,可以采取随访及联合CT和MRI的方式来进一步提高诊断效率。另外,本研究进行了3种生物标志物的联合运用,达到了很好的效果,相信通过对更多肝脏代谢指标的数据分析或者肝脏代谢组学的研究,或许将能够更加早期和高效地诊断HCC。
