蛋白磷酸酶C1-TEN在急性髓系白血病细胞中的表达及抑制FLT3-ITD对其表达的影响
2022-02-23罗满生赖旭旺邓晓玲曾艳梅
罗满生,赖旭旺,邓晓玲,曾艳梅
(1.南昌大学 附属赣州医院 检验科,江西 赣州 341000;2.南昌大学 医学部 第二临床医学院,江西 南昌 330006;3.南昌大学 附属赣州医院 中心实验室,江西 赣州 341000)
急性髓系白血病(acute myeloid leukemia,AML)是一类因某些基因突变而导致的造血系统恶性增殖性疾病,严重威胁人类健康,其中FMS样酪氨酸激酶3(FMS like tyrosine kinase 3,FLT3)中间串联重复(internal tandem duplication,ITD)突变在临床初诊AML患者中约占30%[1]。现已知FLT3-ITD突变与AML耐药、复发、完全缓解率低等不良预后密切相关[2-3]。研究发现FLT3-ITD可通过激活下游系列信号通路如磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(Akt)、细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)、信号转导和转录激活因子 5(signal transducer and activator of transcription 5,STAT5)等,诱发造血祖细胞异常增殖和恶性转化,从而具有致白血病作用[4]。目前已有第一、二代酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)用于FLT3-ITD突变AML的治疗,但效果不理想[5-6]。因此,AML发病机制及其治疗仍然是当前AML研究领域的热点。
ITD突变导致FLT3非配体依赖性二聚化,并持续激活,而酪氨酸激酶活性的调节通常受控于一些蛋白酪氨酸磷酸酶(protein tyrosine phosphotase,PTPase)[7]。因此,在FLT3-ITD激活方面,PTPase可能具有一定调节功能。然而在诸多研究中,有关PTPase的确切作用观点尚不一致[8-9],而具有C1结构域且与TENsin同源的磷酸酶(C1 domaincontaining phosphatase and TENsin homologue,C1-TEN)就是其中代表。
C1-TEN,亦称作人张力蛋白2(tensin 2,TNS2),是tensin家族成员之一[10-11]。由于其C末端所特有的蛋白酪氨酸磷酸酶(protein tyrosine phosphotase,PTP)和Src同源结构域(Src homology domain,SH2),C1-TEN因而可能具有酪氨酸残基磷酸化活性[12-13]。虽然C1-TEN在一些肿瘤细胞中具有抗肿瘤功能[9],但有学者则提示该磷酸酶可能具有致瘤作用[8],而有关C1-TEN在AML细胞的表达及其功能目前尚无报道。本研究将首先揭示AML细胞中C1-TEN的表达情况,然后探讨AML细胞中FLT3-ITD与C1-TEN的调控关系。
1 材料与方法
1.1 材料
1.1.1 细胞系
AML细胞系HL-60细胞、MV4-11细胞均由中科院(上海)干细胞库馈赠。实验细胞正常培养于含10%热灭活胎牛血清(fetal bovine serum,FBS)的RPMI-1640培养基,铺板、药物干预时悬浮于2% FBSRPMI-1640。
1.1.2 试剂与仪器
米朵妥林(Midostaurin,货号:HY-10230)、索拉菲尼(Sorafenib,货号:HY-10201)购自上海MCE公司;FBS、RPMI-1640购自Gibco公司;MTT试剂(货号:298-93-1),购于上海生工生物科技有限公司;15,16-二氢丹参酮I(15,16-dihydrotanshinone I,DHTS,货号:SLBX2742)、二甲基亚砜购自默克Sigma公司;组织细胞裂解液(货号:R0010)购自索莱宝公司;0.45μm PVDF膜购自Millipore公司;蛋白酶/磷酸酶抑制剂混合物(货号:4906845001)购自Roche公司;Tris/甘氨酸/SDS电泳缓冲液(货号:PS105S)、转膜缓冲液(货号:PS109S)、TBST(货号:PS103S)、快速封闭液(货号:PS108P)、三色预染Mraker(货号:WJ103)、ECL超敏化学发光试剂均购自上海雅酶生物科技有限公司;兔源FLT3抗体(货号:3462S)、pFLT3抗体(货号:3464S)、半胱氨酸天冬氨酸蛋白酶-3(caspase-3)抗体(货号:9661)、多聚ADP核糖体聚合酶(poly ADP-ribose polymerase,PARP)抗体(货号:9532)、鼠源C1-TEN抗体(货号:11990S)等均购自CST公司;兔源β-actin抗体(货号:TA-09)、羊抗鼠IgG 抗体(货号:ZB-2305)、羊抗兔IgG抗体(货号:ZB-2301)等购自北京中杉金桥公司;兔源α-Tubulin抗体(货号:11224-1-AP)购自Proteintech公司;CCK-8细胞活性检测试剂盒(货号:N31213)购自北京Transgen公司;Annexin V-APC/7-AAD(E-CK-A218)购自武汉Elabscience生物科技有限公司。
KHB-ST-360酶标仪购自上海科华生物工程股份有限公司,FACSCantoTMⅡ流式细胞仪购自美国BD公司,FUSION FX凝胶成像仪购自法国Vilber公司。
1.2 实验方法
1.2.1 MTT检测AML细胞活性
基于前期预实验结果,本研究分别以不同浓度的索拉菲尼(0、10、20、40、80 nmol/L)、米朵妥林(0、250、1 000、4 000 nmol/L)干预MV4-11细胞;同样,以不同浓度的索拉菲尼(0、400、800、1 600、3 200 nmol/L)、米朵妥林(0、250、1 000、4 000 nmol/L)干预HL-60细胞。利用MTT法检测HL-60细胞、MV4-11细胞的活性,以分析两者对TKI的敏感性。具体步骤参照文献[14]。细胞经PBS两次洗涤后悬浮于2%FBS-RPMI-1640,于96孔板中每孔加入90μL细胞混悬液(含3.0×104个细胞),然后加入10μL RPMI-1640或不同浓度的米朵妥林或索拉菲尼,37℃、5% CO2孵育20 h。每孔加入20μL MTT试剂(5 mg/mL),4 h后加150μL二甲基亚砜,混匀后酶标仪读板,测定各孔吸光度D(490 nm),实验设三复孔,取均值。
1.2.2 Western blot检测蛋白表达
基于MTT实验结果,确定HL-60细胞、MV4-11细胞的米朵妥林干预浓度和索拉菲尼干预浓度,同时以RPMI-1640、10%FBSRPMI-1640为实验对照,于37℃、5%CO2条件下共育5 h。(1.5~2.0)×106个细胞经1 200 r/min离心6min,细胞沉淀用预冷PBS洗涤2次,加100μL RIPA细胞裂解液,其中含蛋白酶/磷酸酶抑制剂混合物(1 mmol/L),充分吹打、涡旋混匀,100℃金属浴10 min,12 000 r/m离心7 min,4℃保存备用。10% SDS-PAGE电泳后,转移至PVDF膜,快速封闭液室温封闭1 h,经TBST(含0.1%吐温-20,下同)洗涤1次后分别4℃孵育一抗过夜,包括兔源FLT3抗体(V抗体∶V抗体稀释液=1∶1 000)、pFLT3抗体(V抗体∶V抗体稀释液=1∶1 000)、caspase-3抗体(V抗体∶V抗体稀释液=1∶1 000)、PARP抗体(V抗体∶V抗体稀释液=1∶1 000),鼠源C1-TEN抗体(V抗体∶V抗体稀释液=1∶1 000)、α-Tubulin抗体(V抗体∶V抗体稀释液=1∶50 000)、β-actin抗体(V抗体∶V抗体稀释液=1∶1 000)。TBST洗涤5次,5 min/次,再室温孵育HRP标记的二抗1 h,包括羊抗鼠IgG抗体(V抗体∶V抗体稀释液=1∶10 000);羊抗兔IgG抗体(V抗体∶V抗体稀释液=1∶10 000)。TBST洗涤5次,5 min/次,ECL超敏化学发光试剂显影,FUSION FX凝胶成像仪曝光成像并分析灰度值。
1.2.3 CCK-8实验检测MV4-11细胞活性
MV4-11细胞铺96孔板(每孔90μL细胞混悬液,含3.0×104个细胞),分别用不同浓度的DHTS(0、2.5、5、10μmol/L)于37℃、5% CO2条件下干预15 h,加入10μL CCK-8试剂后孵育3 h,利用酶标仪读取各孔吸光度D(450 nm),每组设3复孔,取均值。
另外,基于预实验结果,本研究还将通过检测细胞活性探讨DHTS(3.0μmol/L)与米朵妥林(50 nmol/L)或索拉菲尼(10 nmol/L)对MV4-11细胞的协同抑制作用,方法同上。
1.2.4 FACS、Western blot检测MV4-11细胞凋亡
MV4-11细胞铺24孔板(每孔900μL细胞混悬液,含3.5×105个细胞),分为阴性对照组(Con)和实验组,分别加100μL RPMI-1640或DHTS(100μmol/L),37℃、5%CO2孵育5 h,依照试剂盒说明进行Annexin V-APC/7-AAD标记,上机行流式细胞检测(FACS)。caspase-3、PARP活化情况通过WB检测相关蛋白表达进行分析,方法同1.2.2。
1.3 统计学分析
所有数据运用GraphPad Prism 7.0进行统计学分析,以均数±标准差(¯x±s)表示。计量资料多组间比较运用单因素方差分析(one-way ANOVA)分析,Bonferroni post-hoc法检验方差齐性;两组间比较采用非配对t检验分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 TKI对MV4-11细胞活性的影响
与之前报道[15]一致,本研究中两种TKI(索拉菲尼、米朵妥林)均可有效抑制FLT3-ITD突变AML细胞系MV4-11细胞的增殖,而HL-60细胞则对其耐药。如图1A-B,两种TKI均能显著杀伤MV4-11细胞。与Con组(0 nmol/L)比较,TKI处理组细胞活性显著降低,组间差异具有统计学意义(F索拉菲尼=99.34,P<0.05;F米朵妥林=68.37,P<0.05),其中索拉菲尼处理组尤为明显。而TKI对HL-60细胞则无明显抑制、杀伤作用,与Con组(0 nmol/L)比较,TKI处理组细胞活性降低不明显,组间差异无统计学意义(F索拉菲尼=1.609,P=0.2465;F米朵妥林=2.959,P=0.0977)(图1C-D)。

图1 TKI处理对AML细胞系活性的影响Figure 1 The effects of TKI treatment on the activity of AML cell lines
2.2 TKI对MV4-11细胞FLT3活化和C1-TEN表达的影响
采用WB法进一步分析FLT3磷酸化水平,以评价TKI对MV4-11细胞FLT3活化的影响,探讨TKI抑制杀伤MV4-11细胞的可能机制。结果发现,经TKI作用5 h后MV4-11细胞FLT3活化显著下降(图2A-B),组间差异具有统计学意义(F=430.6,P<0.05);而HL-60细胞非但FLT3活化不明显,而且FLT3表达(0 FBS RPMI-1640组、10%FBSRPMI-1640组)明显低于同样条件下的MV4-11细胞(图2A)。
有研究报道,AML细胞FLT3-ITD突变可导致某些磷酸酶表达升高。本研究中,尽管未能分析FLT3-ITD的蛋白激酶活性,但通过WB法分析了AML细胞在TKI(50 nmol/L米朵妥林或10 nmol/L索拉菲尼)作用条件下C1-TEN的表达情况。如图2A,0 FBS RPMI-1640组、10% FBS RPMI-1640组MV4-11细胞C1-TEN表达水平明显高于HL-60细胞。而且,与0 FBS RPMI-1640组、10%FBS RPMI-1640组比较,TKI组C1-TEN表达显著降低(图2A、C),差异具有统计学意义(F=163.3,P<0.05),同等条件下HL-60细胞则变化不明显(图2A)。
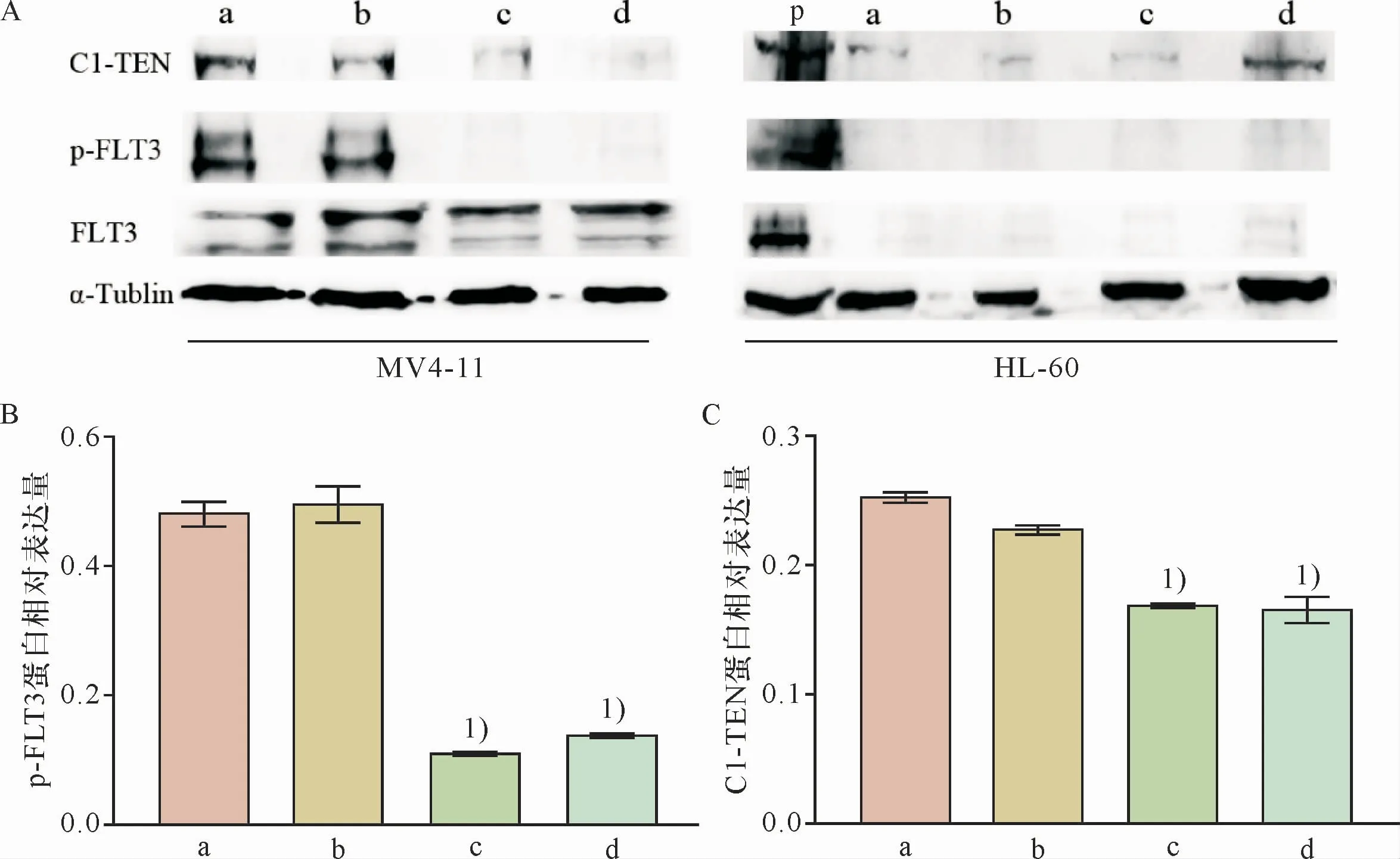
图2 TKI作用条件下AML细胞系FLT3磷酸化及C1-TEN表达情况Figure 2 FLT3 phosphorylation and C1-TEN expression in AML cell lines treated with TKI
2.3 C1-TEN抑制对MV4-11活性的影响及与TK I的协同作用
此外,本研究还探讨了C1-TEN抑制对FLT3-ITD突变AML细胞的影响。CCK-8结果显示,经C1-TEN抑制剂DHTS作用15 h后MV4-11活性显著降低(F=1613,P<0.05),效应呈明显剂量依赖性(图3A)。而且,DHTS能协同TKI抑制MV4-11细胞增殖(F米朵妥林=390,P<0.05;F索拉菲尼=211.7,P<0.05),但是DHTS单独作用时其抑制作用逊色于TKI单独处理组(P<0.05,图3B-C)。然而,上述现象在HL-60细胞中并未观察到(数据未列出)。
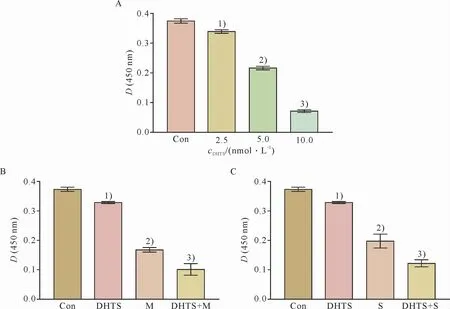
图3 DHTS单独处理或联合TKI对MV4-11细胞活性的影响Figure 3 The effects of DHTS treating alone or combined with TKIon the activity of MV4-11 cells
2.4 DHST对MV4-11细胞的凋亡诱导作用
为探讨DHTS对MV4-11细胞的作用机制,本研究还分析了各组细胞的凋亡情况。如图4A,DHTS组caspase-3活性片段的灰度值(0.614±0.027)显著高于阴性对照(0.027±0.003),经单因素方差分析,差异具有统计学意义(P<0.05)。与caspase-3活化情况类似,DHTS处理组另一凋亡标记分子PARP活化也显著高于阴性对照(图4B)。FACS结果显示,DHTS组细胞凋亡率(45.58±0.308)较Con组(20.53±1.8)显著升高,经非配对t检验分析,差异具有统计学意义(P<0.05,图4)。

图4 DHTS处理诱导MV4-11细胞凋亡的情况Figure 4 The apoptosis of MV4-11 cells treated by DHTS
3 讨论
AML细胞FLT3-ITD突变可引发其自身非配体依赖性、持续性活化,并与AML患者的一些不良预后密切相关[16]。一般诸如FLT3在内的一些受体酪氨酸激酶(receptor tyrosine kinase,RTK)的活化受PTPase调节,因为后者具有去酪氨酸残基磷酸化功能[7,17]。作为一种报道较少的蛋白磷酸酶,虽然研究显示C1-TEN在一些实体瘤中表达下降[8],但是它在AML细胞的表达目前尚不清楚。本研究显示AML细胞表达C1-TEN,尤其FLT3-ITD突变的AML细胞。本研究还揭示FLT3-ITD被抑制后,AML细胞C1-TEN分子表达下调,但机制有待进一步研究;而拮抗C1-TEN却能诱导细胞凋亡,杀伤FLT3-ITD突变的AML细胞。
前期预实验发现,在5份临床AML骨髓标本中,仅有1份FLT3-ITD突变AML细胞高表达C1-TEN,而其他4份FLT3-WT AML细胞C1-TEN表达不明显(数据未列出),是否提示C1-TEN在FLT3-ITD突变AML细胞高表达而在FLT3-WT AML细胞低表达?考虑到短时间内临床样本有限,本研究利用两种代表性AML细胞系用于研究AML细胞C1-TEN表达,并进一步探究FLT3-ITD与C1-TEN的调控关系。结果表明,两种TKI(米朵妥林、索拉菲尼)都具有明显抑制FLT3-ITD突变AML细胞的作用,而对FLT3-WT AML细胞的抑制效应一般,这一结果与以往报道一致[18]。同样,TKI处理组MV4-11细胞FLT3活化相比HL-60细胞也被显著抑制,再次证明FLT3-ITD活化对AML细胞成瘤性的促进作用。本研究还提示,与MV4-11细胞相比,HL-60细胞的FLT3表达明显较低,这一差异是否与这两种AML细胞系的来源背景不同有关目前还不清楚。研究已明确,FLT3-ITD能正向调节AML细胞一些下游信号通路如PI3K/Akt、janus激酶(janus kinase,JAK2)、ERK、STAT5等[19],促进AML细胞增殖、抗凋亡、抗分化等病理过程,其中STAT5尤为重要。作为一种转录因子,STAT5是AML细胞FLT3下游信号通路中的重要靶分子,而FLT3-ITD/STAT5抗凋亡信号通路又是该类细胞的重要特征[20]。因此,调控FLT3-ITD活化是目前有关FLT3-ITD突变AML治疗研究的热点。
鉴于PTPase对FLT3在内的一些RTK的重要调节作用,本研究还进一步探讨了FLT3-ITD被抑制条件下AML细胞中与PTEN同源的蛋白磷酸酶C1-TEN的表达情况。PTEN通常被称为肿瘤抑制因子,是一种蛋白质脂质双特异性磷酸酶,包括AML在内的很多肿瘤细胞中该因子表达下降[21]。本研究发现FLT3-ITD突变AML细胞系MV4-11非但相对高表达C1-TEN,而且在抑制FLT3-ITD条件下该磷酸酶分子的表达也被下调,而经C1-TEN抑制剂DHTS作用后FLT3变化不明显。考虑到这两种TKI以及DHTS作用的相对靶向性,因此推测FLT3-ITD可能通过某种机制调控下游C1-TEN分子。这一假设或许可从其他相关研究结果初见端倪,Arora等[14]报道在MV4-11细胞FLT3-ITD能上调另一种双特异性磷酸酶PTPase的表达但无磷酸酶活性。有研究证实可能机制是FLT3-ITD通过促进活性氧(reactive oxygen species,ROS)产生而抑制其磷酸酶活性[22],但这一机制能否解释本研究的相关发现有待证实。
为进一步证实在促进AML细胞生长、存活等方面与FLT3-ITD的同向性,本研究还分析了MV4-11细胞分别在C1-TEN抑制剂DHTS、TKI及两者联合作用条件下的存活、增殖情况。结果表明,DHTS能有效抑制MV4-11细胞,尽管其效果不如TKI。并且在对MV4-11细胞的抑制方面,DHTS与TKI具有协同性。抑制机制方面,DHTS可能通过诱导细胞凋亡抑制MV4-11细胞,提示DHTS可能逆转FLT3-ITD突变AML细胞特征性的“FLT3-ITD/STAT5”抗凋亡通路,具体机制还需深入探讨。据此推断,蛋白磷酸酶C1-TEN不但表达于AML细胞,而且还可能是FLT3-ITD的重要下游分子,与其他相关分子共同参与AML细胞致瘤作用。
综上,本研究首次报道了AML细胞蛋白磷酸酶C1-TEN的表达情况,并揭示该分子可能作为FLT3-ITD下游重要分子共同参与AML细胞的恶性转化等病理生理过程,因而有望成为AML治疗的新靶点。但是,由于本研究为体外细胞实验,相关结论尚需在接下来的临床AML细胞样本及动物实验研究中进一步证实,并对相关机制进行深入探讨。
作者贡献声明
罗满生:提出研究思路和框架,修改论文;罗满生、赖旭旺:设计实验、统计分析数据,撰写论文;赖旭旺、邓晓玲:实验操作、数据统计和分析。
利益冲突声明
本研究未受到企业、公司等第三方资助,不存在潜在利益冲突。
