支架内再狭窄非编码核糖核酸靶向治疗研究进展
2022-02-23丁婷婷畅智慧刘兆玉
丁婷婷, 畅智慧, 刘兆玉
下肢动脉硬化闭塞症(arteriosclerosisobliterans,ASO)是由动脉粥样硬化引起的动脉闭塞性疾病[1]。血管内支架植入术可明显改善下肢ASO患者缺血引发的间歇性跛行和静息痛等症状。然而支架作为外源性物质,植入体内会造成血管平滑肌细胞(vascular smooth muscle cell,VSMC)异常增殖和迁移、内皮细胞(endothelial cell,EC)损伤、炎性反应和新内膜形成等一系列并发症,导致支架内再狭窄(in-stent restenosis,ISR)形成[2]。研究显示,非编码核糖核酸(non-coding ribonucleic acid,ncRNA)在调节VSMC和EC生物学功能及炎性反应等方面具有巨大潜力。通过调节靶区域ncRNA分布进而调节VSMC和EC功能,可减少支架植入引起的损伤,降低ISR发生率[3]。
ncRNA共同特征是,可从基因组中转录,但不能翻译成蛋白质,并可在核糖核酸(ribonucleic acid,RNA)水平发挥生物学功能[4]。根据ncRNA大小,通常可分小分子ncRNA和大分子ncRNA两类。小分子ncRNA包括微RNA(miRNA)、Piwi蛋白相互作用RNA(Piwi-interacting RNA,piRNA)、环状RNA(circular RNA,circRNA)、小干扰RNA(small interfering RNA,siRNA)和小核RNA(small nuclear RNA,snRNA)等,大分子ncRNA包括核糖体RNA(ribosomal RNA,rRNA)、天然反义转录物(natural antisense transcript,NAT)和长链非编码RNA(long non-coding RNA,lncRNA)[5]。近年研究证明,ncRNA在ISR过程中对白细胞、巨噬细胞、中性粒细胞等炎性细胞有调节作用,可调控VSMC和EC等细胞增殖、迁移、凋亡及免疫反应等过程,对治疗ISR也具有潜在的临床干预靶点[6]。但目前ncRNA作为生物标志物用于ISR治疗仍有很多研究要做。
1 ISR病理生理
支架植入通过物理学方法对动脉内膜造成功能性和器质性损伤,动脉内膜损伤后通过血管内膜增生、血管重塑、凝血激活和血栓形成等病理生理过程引起ISR[7]。VSMC增殖、从中膜迁移到内膜、细胞外基质形成和外膜瘢痕形成等是ISR形成关键环节。支架植入术后数小时内细胞因子、中性粒细胞可聚集产生炎性反应,1周后巨噬细胞活化,7~14 d时在各种因子刺激下,热休克蛋白、抗凋亡Bcl-2蛋白、胶原特异性分子伴侣蛋白、肌球蛋白重链蛋白等表达增加[8-9]。Giacoppo等[10]临床研究显示,药物洗脱支架(drug eluting stent,DES)通过释放抗增殖药物明显降低ISR发生率。支架内新生动脉粥样硬化(in-stent neoatherosclerosis,ISNA)是导致ISR的另一个因素。ISNA是指在伴或不伴坏死核形成情况下,支架附近新生内膜富含脂质的泡沫细胞聚集。Zou等[11]研究显示,颈内动脉ISR患者病变血管支架剥除后支架内充满新生动脉粥样硬化和内膜组织。此外,研究发现金属裸支架植入术后ISNA主要发生在支架近端组织,在支架中段及远端发生率较低[12]。ISR发生机制还可能与支架植入术后持续慢性炎症及延迟愈合有关。支架植入术后内皮覆盖不全、EC缺陷导致血液中白细胞、中性粒细胞、巨噬细胞、血小板等黏附及渗透作用增强,炎性细胞因子和血管活性物质作用加剧了脂质浸润。其中炎性介质和细胞因子,如白细胞介素-8、基质细胞衍生因子、血管内皮细胞生长因子、肿瘤坏死因子、基质金属蛋白酶-2、基质金属蛋白酶-9等,可作为ISR独立预测指标[13]。
2 ncRNA与ISR
2.1 miRNA与ISR
miRNA长度为20~25个核苷酸,可通过碱基互补配对方式识别信使RNA(mRNA),不同程度地促使其衰变或抑制其翻译。支架植入术后,不同细胞类型miRNA有不同程度上调或下调,其在血流中浓度甚至也可反应其水平变化,因此了解miRNA对了解ISR机制及维持血管完整性至关重要。为发现更有效的治疗ISR策略,miRNA提供了一个先进知识框架[14]。
miR-21在VSMC和内皮细胞中高表达,可通过调节不同信号转导通路发挥作用[15]。Huang等[16]研究表明,熊去氧胆酸(UDCA)通过阻断miR-21/PTEN/AKT/mTOR信号通路抑制VSMC增殖。miR-21还可靶向多个分子,包括骨形态发生蛋白受体(BMPR)-2、含WW域E3泛素蛋白连接酶(WWP)1、特异AT序列结合蛋白(SATB)1,最终导致慢性缺氧,引起血管重塑[17]。miR-126参与ISR过程中炎性反应,靶向血管细胞黏附分子(VCAM)-1,降低白细胞和EC黏附性[18]。miR-221/222通过靶向E26-1间接调节EC中炎性因子表达。miR-221/222在EC中具有相反作用,可能归因于中间靶基因p27(Kip1)和p57(Kip2)差异表达谱[19]。
还有许多miRNA,如miR-125a[20]、miR-130a[21]、miR-146a[22]和miR-342-5p[23],通过靶向信号转导通路调控VSMC功能和表型。miR-21还明确与药物涂层支架ISR发生密切相关[10]。miRNA可作为生物标志物或治疗靶标,在ISR诊断和治疗中发挥重要作用。
2.2 lncRNA与ISR
lncRNA是一类长度超过200个核苷酸的RNA,作为重要的RNA转录物,在血管对机械损伤适应中起着重要作用。lncRNA作用机制大致分为两类,顺式作用的lncRNA对同一基因组位点内靶基因或染色质结构进行调控[4],其机制包括转录增强、组蛋白修饰、染色质折叠、剪接修饰和翻译调节;反式lncRNA离开转录位点,通过远端调控靶点改变细胞机制。
lnc-RNCR3和lncRNA-430945最近被确定为VSMC增殖和迁移调节因子,下肢ASO患者中这两种lncRNA水平均升高。lncRNA-430945主要通过促进受体酪氨酸激酶样孤儿受体(ROR)2表达激活RhoA信号通路[24]。lnc-RNCR3作为miR-185-5p竞争性内源RNA(competing endogenous RNA,ceRNA),促进EC增殖,进而导致Krüppel样转录因子(KLF)2水平升高。然而在VSMC中是否存在类似调控网络尚待观察[25]。
lncRNA-00113在下肢ASO患者血清中高表达,沉默lncRNA-00113可抑制VSMC增殖,但促进VSMC和EC迁移。lncRNA-00113被认为是通过激活PI3K/Akt/mTOR信号通路促进EC增殖。但这些发现尚未在VSMC中得到证实。血小板衍生生长因子(PDGF)刺激VSMC后,ceRNA、生长阻滞特异性转录因子(GAS)5下调。GAS5过度表达可通过充当miR-21“分子海绵”阻止PDGF-BB诱导的VSMC增殖和迁移[26]。GAS5过度表达的EC释放胞外体可减少VSMC增殖和迁移,反之亦然,突显GAS5在VSMC-EC串扰中的重要作用。此外,GAS5通过β-肌动蛋白(actin)在VSMC和EC中的核定位调节β-actin信号通路[27]。这项研究表明lncRNA并非仅具有细胞特异性。这既为多细胞靶向治疗ISR提供机会,也增加靶向效应的风险。
2.3 circRNA与ISR
circRNA分子呈封闭环状结构,不受RNA外切酶影响,表达更稳定,不易降解。circRNA分子富含miRNA结合位点,在细胞中可解除miRNA对其靶基因的抑制作用,升高靶基因表达水平。这使circRNA有可能成为ISR临床诊断和治疗新靶点,CZNF609在EC中高表达,下调CZNF609可促进EC迁移并保护EC免受氧化应激损伤。circRNA-心脏相关circRNA(HRCR)通过调控miR-223影响心力衰竭[28]。
2.4 其他ncRNA与ISR
siRNA是20~25个核苷酸长度的双链ncRNA,能与mRNA结合并促使其裂解,以沉默特定mRNA翻译过程。它可通过多种转染技术引入细胞和组织影响靶基因[29]。piRNA与Piwi蛋白相互作用,对转座子进行调控,保护生殖细胞不受转座元件失调影响。piRNA是一种生殖细胞特有的小ncRNA[30]。这两种ncRNA在ISR形成中的作用研究仍处于初步阶段,机制尚不明确。
ncRNA在ISR中的机制见图1。
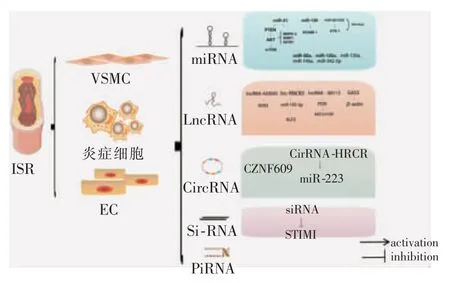
图1 ncRNA在ISR中的机制
3 ncRNA在ISR临床的应用
不同支架属性、支架直径、支架数量、支架重叠、支架膨胀不全等,均会影响血管壁完整性和血流动力学,进而导致ISR发生。临床证据表明球囊扩张时间和所施压力与miR-92a有关[31]。金属裸支架植入术后ISR发生率为17%~41%,药物球囊及DES术后ISR发生率<10%,说明支架不同属性也对ISR有影响[32]。目前研究显示临床应用DES可降低裸金属支架引起的ISR发生率,但会导致动脉延迟愈合和晚期血栓形成,而基因洗脱支架可克服这些缺点。有文献报道,可通过多种递送系统结合纳米技术将基因递送至目标区域持续释放基因,干扰VSMC、EC生物学功能,从而预防ISR[33]。抗miR-21洗脱支架在动物模型中已证实可减少VSMC增殖,且对EC无不利影响[15]。近年来,ncRNA已整合到微球集成支架、腺病毒或纳米颗粒中,准备进入临床试验阶段。
综上所述,基因洗脱支架是支架技术的一项重大突破,为解决ISR和晚期血栓形成提供了思路。该支架不仅可携带抗炎药和抗血栓药,还可携带ncRNA,将基因固定在生物材料表面,送达阻塞部位持续释放,通过影响易感区域中基因表达降低ISR和晚期血栓发生率。但基因洗脱支架仍处于探索阶段,明确其发生机制,评估其治疗有效性、长期效果等,还需进行更多研究。
