经导管动脉灌注PD-1单抗治疗恶性肿瘤所致免疫相关不良反应
2022-02-23何晶晶杨欣静范卫君
何晶晶, 杨欣静, 范卫君
恶性肿瘤已成为严重威胁人类健康的重要公共卫生问题之一。晚期恶性肿瘤的治疗手段也越来越多样化,包括手术、放射、化学、微创介入、靶向、生物治疗等,肿瘤的综合治疗成为一种趋势。近年来,免疫治疗的加入成为肿瘤综合治疗不可或缺的一部分,并在多个病种上取得了一定成果,如黑色素瘤、非小细胞肺癌等,其中程序性死亡蛋白-1(PD-1)单抗的临床应用最为成熟[1-2]。PD-1单抗通过切断肿瘤细胞与T淋巴细胞之间的PD-1/PD-L1信号通路,解除T淋巴细胞对肿瘤细胞的功能抑制状态,发挥肿瘤免疫效应,杀死肿瘤细胞[3]。而经导管动脉灌注治疗可在肿瘤供血动脉内直接灌注药物,能起到药物首过效应,从而显著提高肿瘤局部药物浓度,增加疗效[4]。在一项冷冻消融联合经导管动脉灌注帕博利珠单抗治疗黑色素瘤肝转移的前瞻性、概念性验证队列研究中发现,联合治疗的有效率可达到26%左右,明显高于常规的单药PD-1单抗静脉治疗;同时发现部分PD-1单抗静脉治疗无效的患者使用该方案后明显提高了疗效,这为黑色素瘤肝转移患者提供了新的治疗思路[5],而经导管动脉灌注PD-1单抗的治疗方式也逐渐被临床关注。免疫检查点抑制剂治疗引起的免疫相关不良反应(immunerelated adverse events,irAE)可涉及全身各个器官,故受到临床广泛重视。本研究分析了79例恶性肿瘤患者经导管动脉灌注PD-1单抗治疗的irAE发生情况,现报告如下。
1 材料与方法
1.1 研究对象
本研究为回顾性研究。纳入2020年5月至12月在中山大学肿瘤防治中心微创介入治疗科接受经导管动脉灌注PD-1单抗治疗的患者79例,男53例,女26例,年龄为(51.4±12.5)岁。纳入标准:年龄≥18岁;至少有1处可测量的实体肿瘤病灶;至少接受过一次经导管动脉灌注PD-1单抗。排除标准:有不受控制的中枢神经系统转移和/或癌性脑膜炎;合并其他恶性肿瘤,且在过去2年内进展或需要积极治疗;接受第1次治疗前7 d被诊断为免疫缺陷或正在接受全身类固醇或任何其他形式的免疫抑制治疗;治疗前存在irAE症状的患者。所有患者均签署知情同意书。不良反应等级根据美国常见不良反应事件评价标准4.0版(CTCAE)评价。
1.2 经皮穿刺股动脉置管术
采用Seldinger技术,数字减影血管造影(Philips Alluraxper FD20)选择经皮穿刺右侧股动脉行置管手术。术中患者取仰卧位,穿刺部位局麻后作3 mm皮肤切口,然后行动脉穿刺;穿刺成功后用扩张管5 F进行扩张,置入导管鞘5 F,随后置入导管及微导管并行造影,显示肿瘤部位及数目,确定导管末端留置位置,使用纱布、绷带加压包扎伤口,固定导管,导管类型为Renegade Hi Flo微导管(含导丝),型号为M001183020/M001183030.(波士顿)W20000640120。
1.3 经导管动脉灌注PD-1单抗给药方案
PD-1单抗按药物推荐剂量:卡瑞利珠单抗3 mg/kg、特瑞普利单抗3 mg/kg、帕博利珠单抗2 mg/kg、信迪利单抗200 mg、替雷利珠单抗200 mg,每3周给药1次,直至疾病进展或病情无法耐受为止。
1.4 经导管动脉灌注PD-1单抗给药流程
确定导管固定、在位、通畅后,使用医用输液泵动脉灌注给药。①选择合适过滤介质孔径的输液器,一般为0.2~5.0μm;②严格遵守无菌操作配置PD-1单抗;③联合动脉灌注化疗时,做好医护沟通,确认给药先后顺序;④给药前后使用0.9%NaCl溶液冲管,PD-1单抗动脉灌注缓慢给药维持2 h,输注前后监测患者脉搏、呼吸、血压变化;⑤做好药物不良反应相关宣教,做好动脉穿刺点伤口及导管固定的观察与护理;⑥定时观察药物输注情况、患者下肢血运及足背动脉搏动情况,指导患者多行踝泵运动,预防血栓发生。
1.5 统计学分析
采用SPSS26.0统计软件。计数资料的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 发生与未发生irAE患者的基线特征比较
发生irAE和未发生irAE患者的基线特征比较见表1。
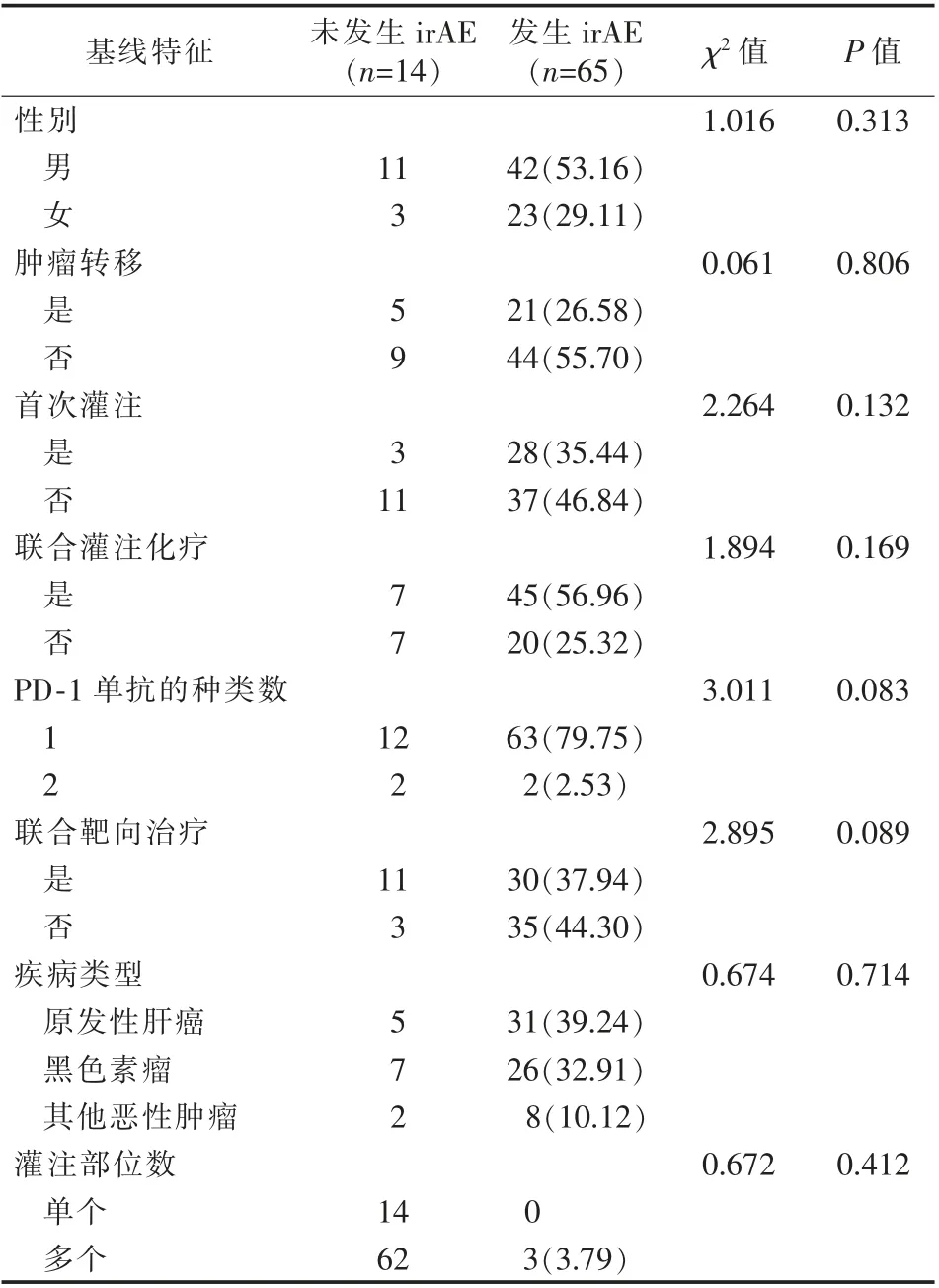
表1 发生与未发生免疫相关不良反应组患者的基线特征比较 例(%)
2.2 不同灌注次数irAE的发生率
不同灌注次数患者irAE的发生率为1.3%~60%,首次灌注患者irAE发生率的前5位为疲劳、恶心、关节痛、瘙痒和皮疹,其后为垂体炎、肾炎、肝炎、肺炎、甲亢和血糖升高。接受3次灌注的患者中irAE发生率最高的是疲劳,最低的是垂体炎。不同灌注次数irAE的发生率见表2。
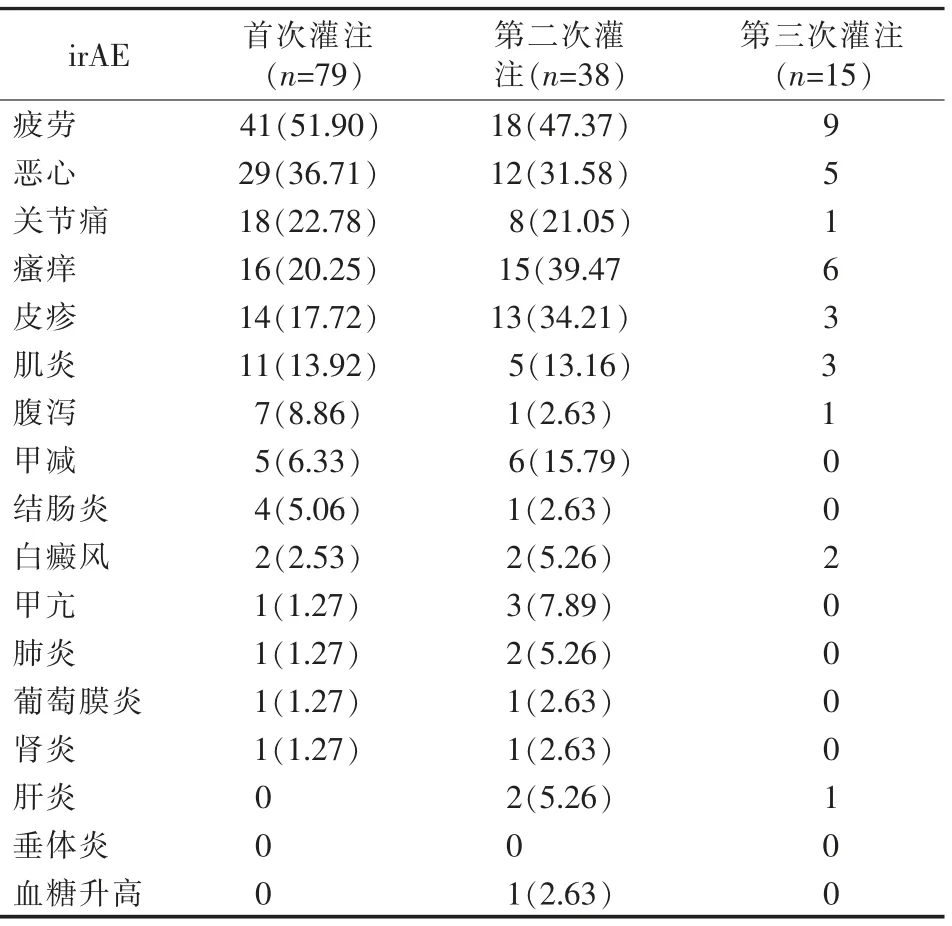
表2 不同灌注次数irAE的发生率
2.3 首次灌注时不同等级irAE的发生率
任何等级和2级或更高级别的irAE发生率分别是82.27%和27.8%。36(45.57%)例的irAE超过3种,其中15例有5种或5种以上的irAE。关节痛和肌炎是最常见的2级irAE,其次是疲劳和皮疹,1例患者出现了3级皮疹。首次灌注时不同等级irAE的发生率见表3。
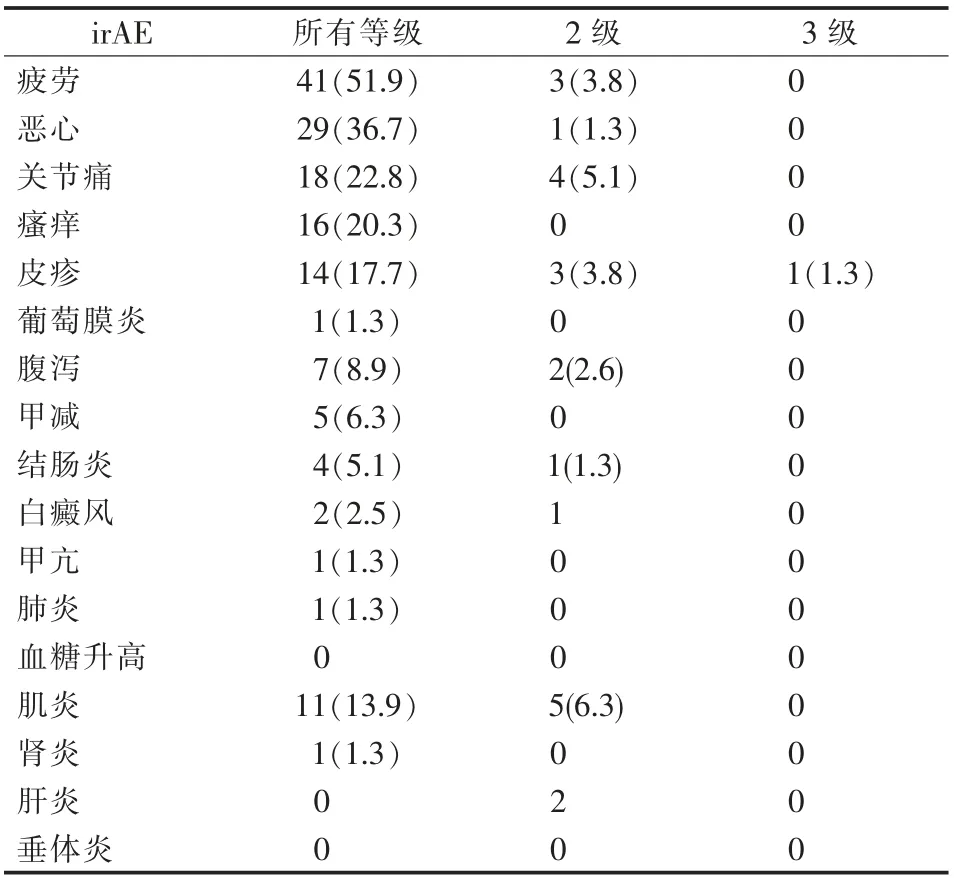
表3 79例患者首次灌注时不同等级irAE的发生率
2.4 二元logistic回归分析疲劳危险因素
二元logistic回归分析结果显示,灌注次数与疲劳有关,如果灌注次数增加1次,疲劳风险增加1.83%,非首次灌注的疲劳发生风险是首次灌注的49.77倍;灌注靶向器官和联合化疗都是疲劳发生的危险因素。二元logistic回归分析疲劳发生的危险因素见表4。
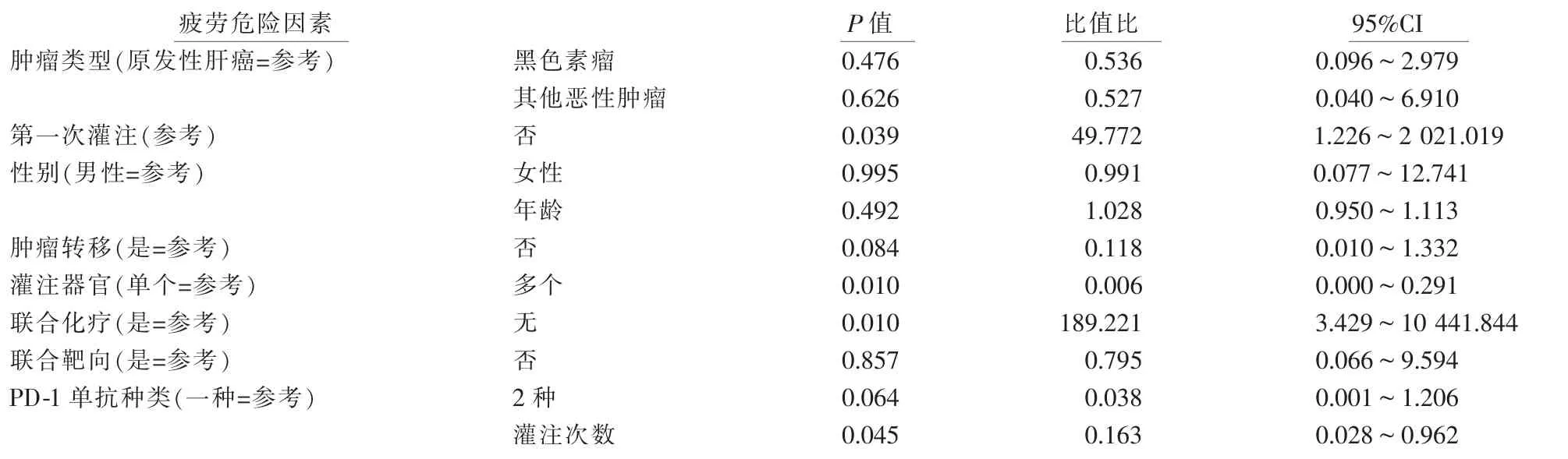
表4 二元logistic回归分析疲劳危险因素
3 讨论
本研究结果显示,疲劳是经导管动脉灌注PD-1单抗发生率最高的irAE之一,接受首次、第2次和第3次灌注的患者,其疲劳的发生率均最高,也是最常见的2级irAE之一,且非首次灌注的疲劳发生风险是首次灌注的49.77倍;同时,灌注靶向器官和联合化疗都是疲劳发生的危险因素。而PD-1单抗静脉给药途径,最常见的不良事件也是疲劳。PD-1单抗单药治疗中,疲劳的发生率为16%~37%,在与其他免疫检查点抑制剂、化疗、抗血管生成药物和靶向治疗相结合时,疲劳的发生率为21%~71%[6],与本研究的结果相似。晚期恶性肿瘤患者的病情复杂、治疗方案多样、反复治疗、治疗持续时间长等,都是疲劳发生的危险因素,控制和管理疲劳在经导管动脉灌注PD-1单抗治疗中至关重要。本研究中,无因疲劳而中断治疗的病例。
恶心是PD-1单抗静脉给药治疗中常见的irAE之一[7-8]。本研究中首次灌注后其发生率为36.7%,严重困扰和影响患者的生活质量,可能降低患者抗肿瘤治疗的依从性,从而影响疗效。对于恶心的发生需进行风险评估,以预防为主,注重全程与个体化管理[9]。本组仅有1例患者发生了2级恶心不良反应,积极处理后缓解。
关节痛也是常见的免疫不良反应之一[10-11]。有研究发现,PD-1单抗主要影响大关节,最常受累关节为肩关节、膝关节、踝关节和腕关节,手指关节、脊柱、肘部和髋部患病率较低,症状可通过非甾体抗炎药或低剂量类固醇控制[12]。本组79例首次灌注的病例中,有18例发生了关节痛(包括所有等级),其中4例为2级不良反应,未经特殊干预,症状1~2周内均可自行缓解。因动脉置管手术、肢体制动、恶性肿瘤患者疾病本身等因素均可引起关节痛,且反应多为一级不良反应,常未得到足够重视。关节痛给患者带来的困扰往往被忽视,所以缓解及控制关节痛应给予更多的关注。
在一项关于PD-1单抗治疗癌症患者发生皮疹及瘙痒的meta分析中,发现PD-1单抗的使用增加了所有级别皮疹和瘙痒的发生风险,皮疹和瘙痒是最常见的症状(静脉给药时)[13]。在本研究中,瘙痒和皮疹在首次灌注的患者中排在了第4和第5位,随着灌注次数的增加,瘙痒和皮疹的排名也随之上升。但在首次灌注的病例中,瘙痒及皮疹的发生多为1级不良反应,瘙痒无2级及以上不良反应发生,皮疹有4例2级不良反应、1例3级不良反应发生。在皮肤毒性管理中,美国肿瘤免疫治疗学会毒性管理工作组提出,大多数皮肤毒性是低级别的、可控的,但少数可能有危及生命的剥脱性皮肤反应如Stevens-Johnson综合征;如果发生4级皮肤毒性反应,应该永久终止使用免疫治疗;鼓励患者一出现症状即报告[14]。
此外,肌炎、结肠炎、腹泻的发生不可忽视。本研究中在首次灌注时肌炎发生率为13.92%,11例中有5例发生了2级不良反应。Moreira等[15]关于免疫检查点抑制剂引起的神经肌肉不良反应的研究显示,肌炎是常见的神经肌肉不良事件,有32%的患者并发心肌炎。本研究中无合并心肌炎患者,但仍然应警惕其的发生。结肠炎,可无症状或表现为腹痛、黏液便或血便等,当发生3级不良反应时可能出现重度或持续性腹痛、发热、肠梗阻、腹膜刺激征阳性,识别和早期积极干预是治疗结肠炎的关键[16]。与基线相比,大便次数增加每天<4次,造瘘口排出物轻度增加,即为发生了腹泻1级不良反应。
恶性肿瘤患者经导管动脉灌注PD-1单抗的免疫相关不良反应发生率较高,但以1~2级为主,通过全面及全程管理,均可缓解且未引起治疗中断,是晚期恶性肿瘤患者可选择的新的治疗方式之一。本研究样本量较小,在今后的临床工作中需不断积累并总结经验,完善对不良反应的管理。
