3.0T动态增强磁共振灌注成像对小肝癌射频消融疗效评估的价值研究
2022-02-23陈天佑杨柏帅侯毅斌李清涛
陈天佑, 袁 敏, 周 粟, 杨柏帅, 侯毅斌, 李清涛
手术切除和射频消融(RFA)是BCLC-A期肝细胞癌(HCC)的主要治疗手段[1]。近年RFA已成为实体肿瘤局部微创治疗中较成熟的方法。消融治疗要求有足够大范围的消融区域,除了要求完全覆盖肿瘤组织外,还需要包括其周围1 cm2范围内的相对正常的肝组织,这样才能有效降低复发率。故对于特殊部位的肝癌病灶,如肝包膜下,血管旁或胆囊旁,完全消融是治疗的难点[2]。同样,由于治疗手段的限制,对于直径>5 cm的病灶,术后可能由于局部残留而导致复发。有研究表明,RFA与手术切除对于早期HCC的疗效无显著差异,特别对于小肝癌(≤3 cm)且相对于手术治疗,RFA往往具有较好的安全性及可重复性[3-4]。
影像学检查特别是功能磁共振成像,检查肝癌的灵敏度及特异度可以达到62%及97%[5]。本研究探讨功能磁共振术前预测RFA疗效的能力,指导临床诊疗。
1 材料与方法
1.1 患者来源和纳入排除标准
选择2016年3月至2020年6月上海市公共卫生临床中心收治的HCC患者58例,入组病例均为首次发现单发病灶。分别于RFA术前1 d行DCE-MRI扫描,并取活检进行免疫组织化学染色,测定病灶微血管密度(MVD)。
入组标准:①单个病灶≤3 cm;②没有发生肝外转移;③凝血功能基本正常,无活动性感染,无腹腔积液;④无心脏起搏器,无幽闭恐惧症等。
排除标准:①术前行其他放化疗或其他辅助抗肿瘤治疗;②血管侵犯及肝外转移;③有门静脉、下腔静脉癌栓者;④肾功能不全或存在对比剂过敏者;⑤随访中因非肿瘤本身或治疗相关因素死亡者。
1.2 方法
1.2.1 常规MRI 采用3.0T MR扫描仪(Achieva,Philips,Amsterdam,Holland)8通道体部线圈,对所有病例行T1WI、T2WI和DCE-MRI扫描。患者检查前保持膀胱适度充盈。采用呼吸门控促发扫描。T1WI:采用mDIXON FEE序列,TR/TE分别为3.2/1.13 ms,FOV380×317 mm,层厚3.5 mm,层间距1.75 mm,层数120层。T2WI:采用SPAIR序列,TR/TE分别为503/70 ms,FOV 300×350 mm,层厚7 mm,层间距1 mm,层数24层。
1.2.2 DCE-MRI扫描 ①横断位采用T1 VIBE序列,TR/TE为4/2 ms,翻转角5°,激励次数1,矩阵350×350,层厚3.5 mm,总层数20层,层间距0 mm。②横断位T1 VIBE序列,翻转角15°其余参数同上。以上序列用于图像校正,解剖定位及参数图融合。③DCE-MRI采用横断位T1-FFE-3D序列,翻转角8°,其余参数同上。在扫描第4个时相经肘静脉用压力注射器注射对比剂钆双胺(欧乃影,GE,15 mL/瓶),剂量为0.2 mmol/kg,注射速率为2 mL/s,扫描时间5 min54 s。
1.2.3 图像后处理 DCE-MRI所得原始图像导入后处理软件,参照横断位及矢状位T2WI图像,选取病灶最大层面法设置感兴趣区域(region of interest,ROI),分别测量3次取平均值,尽量避免血管、胆管,出血、坏死、钙化等。得出ROI的时间信号曲线及动态增强定量参数值。参数包括容积转移常数(volume transfer constant,Ktrans),组织间隙-血浆速率常数(interstitium-to-plasma rate constant,Kep)和血管外细胞外间隙容积分数(extravascular extracellular space volume fraction,Ve)。
1.2.4 活检与治疗 以2%利多卡因5~10 mL逐层浸润麻醉联合术前地西泮5 mg肌内注射镇静。依据超声或CT图像选择合适的治疗体位及进针入路,熟悉病灶与体表定位点之间的相对位置,进针路径须经过部分肝组织,且避开大血管和胆管等重要器官。根据肿瘤的大小,选择相应规格的射频针,在实时超声或CT引导下,16 G同轴套管针步进式穿刺进入肿瘤内部建立通道,拔出套管针针芯,18 G活检枪切割肿瘤组织后取软组织3条固定,再换17 G射频针插入瘤体内,达预定位置后展开锚形电极针,再次超声或CT扫描确认电极针分布满意,以超出肿瘤周围1 cm正常肝组织为宜,消融功率设定为60~100 W,以阻抗模式进行消融,消融时间由计算机自动控制。消融完成后行针道消融后退出消融针。
手术活检标本经4%甲醛溶液固定,石蜡包埋,4μm连续切片,脱蜡、水化、抗原修复、阻断内源性过氧化物酶,滴加CD34抗体试剂、滴加酶标羊抗鼠IgG聚合物以及显影剂,苏木素体细胞染色液室温染色30~60 s,脱水,透明,封片,之后由2名高年资病理医师分别对染色后切片进行计数,结果不一致时,病理科医师讨论后做出结论。MVD计数参照Weidne等[7]的方法:先在低倍视野(×40)下选取肿瘤MVD最高区即血管热点区(hot pot),再于高倍视野(×400)下计数,每张切片记录5个高倍视野下被棕染的微血管数目,取其平均值作为该标本的MVD值,MVD以内皮细胞表面标志物CD34进行标记。每个棕染的可与周围血管、肿瘤细胞及其他结缔组织区分开的内皮细胞或内皮细胞簇,均作为一个可计数的微血管。
1.3 统计学方法
采用SPSS 20.0软件包进行统计学处理。正态分布的计量资料用±S表示。对RFA治疗前所有小肝癌的Ktrans、Kep、Ve等各灌注参数值先进行方差齐性检验,若方差齐性,则使用独立样本t检验进行比较;若方差不齐,则使用Wilcoxon符号秩和检验。DCE-MRI各灌注参数分别与MVD的关系用Pearson秩相关。以P<0.05为差异有统计学意义。
2 结果
本研究随访中位时间为12个月(4~20个月)。58例患者中,21例(36.2%)在随访期间出现肿瘤进展,进展的中位时间为8.3个月,随访过程中,均未发生肝外转移,亦未见治疗相关死亡等严重并发症。
RFA治疗后1个月内随访,消融区域在T1WI上表现为明显高信号,可伴周围低信号带,部分病灶中央显示相对等低信号区;动态增强后,大部分病灶显示完整或不完整的淡薄环形强化,病灶主体部分无强化。
58例患者中,HCC组织学分型梁索型31例,假腺状型8例,实体型19例。在400倍光镜下,以CD34标记的MVD数目跨度为39~72,微血管形状包括点状、线状及环形管状。
根据随访期内是否出现复发或者病灶进展,将所有病例分为稳定组37例及进展组21例。随访期内病灶是否稳定与病灶大小相关,但与病灶部位是否临近肝包膜、血管及胆囊无关。消融前稳定组Ktrans值、Kep值、MVD均较进展组低,且差异有统计学意义。两组患者治疗前DCE-MRI各参数值与MVD的相关分析显示Ktrans值、Ve值与MVD相关。见表1、2。
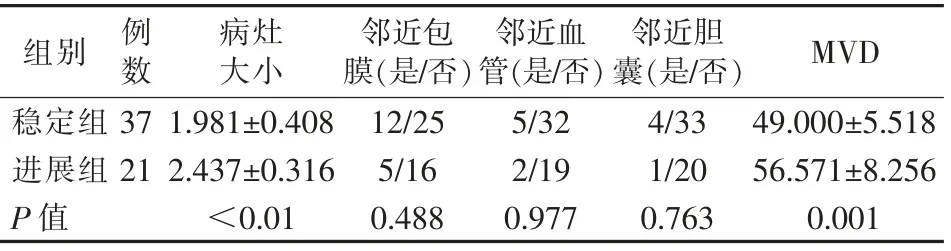
表1 稳定组和进展组病灶特征
58例患者RFA前DCE-MRI各参数与MVD的关系见图1。1例62岁男性HCC患者上腹部增强CT见图2。
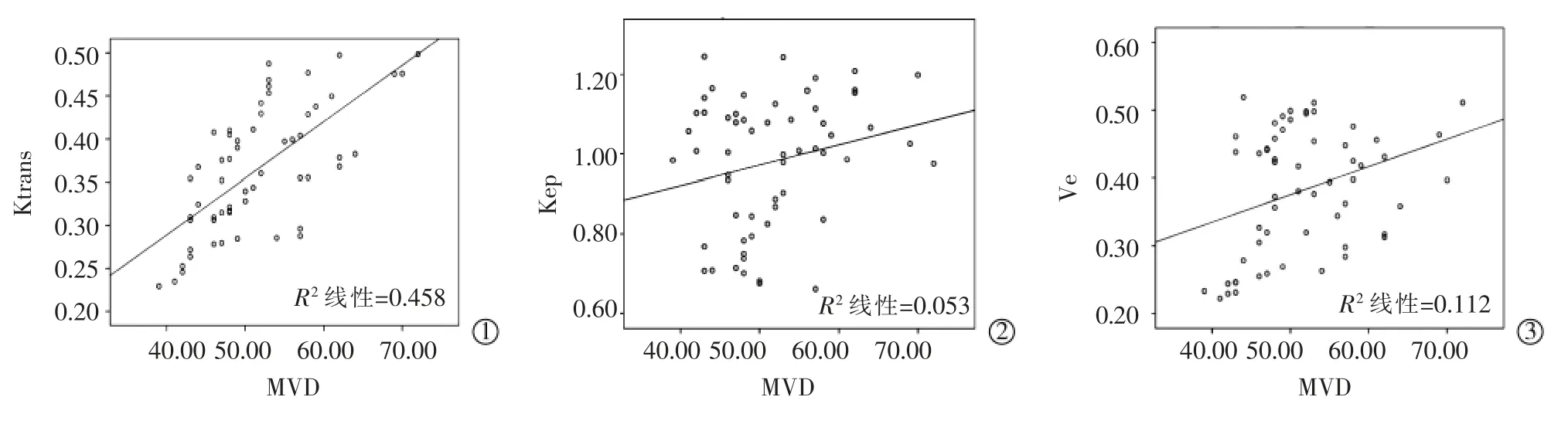
图1 58例肝细胞癌患者RFA治疗前DCE-MRI各参数与MVD的关系
图2 1例62岁男性肝癌患者的增强CT表现
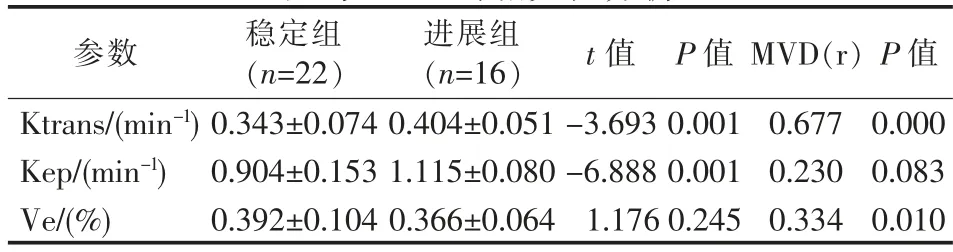
表2 稳定组和进展组RFA治疗前IVIM和PWI参数比较及与MVD的相关性分析
3 讨论
HCC血供丰富,周围可见丰富的侧支循环,经过1次介入治疗(TACE或RFA)后往往不能治愈,术后部分纤维间隔或包膜下残存的肿瘤细胞极大可能导致肿瘤复发,其微循环功能状态是肝癌复发及远处转移的主要因素之一[6]。因此,早期识别、预判肿瘤复发概率,术前对肿瘤微循环功能进行准确评估,对指导临床制定个性化治疗方案至关重要。目前肝癌疗效评价主要依靠常规磁共振T1WI、T2WI及增强进行评估,但常规磁共振难以预测肝癌病灶内微循环状态,对HCC微循环功能状态的评估主要依靠功能磁共振[7]。有研究分析认为肿瘤数目是独立复发因素[8]。故本研究入组患者均为单发HCC病灶。
MR DCE-MRI的原理是跟踪观察对比剂从毛细血管渗入到靶器官组织间隙,并从组织间隙回流入血管的过程,根据细胞外对比剂浓度在靶器官各区域动态变化来反映局部血流灌注功能状态的成像方法。DCE-MRI两室模型分析将血管内及血管外细胞外间隙作为两个空间,通过数学模型计算出对比剂在两室内流动的速度以及对比剂在血管外细胞外空间所占的比例来评价局部微血管灌注功能状态[9]。其定量参数包括Ktrans、Kep、Ve。以上三个参 数 存 在 以 下 的 数 学 关 系:Kep=Ktrans/Ve[10]。Ktrans表示的是对比剂从血浆向血管外细胞外组织间隙的转运速率。它取决于组织血流量、内皮细胞表面积大小及血管内皮细胞通透性。在组织毛细血管具有高渗透性的情况下,即通过内皮的对比剂量受到组织血流量限制,Ktrans等于血液的血浆流量/单位体积;反之,在组织毛细血管渗透性较低时,通过内皮的对比剂量主要受血管渗透性限制的,这时Ktrans值等于组织的渗透率表面积乘积/单位体积[11]。在大多数肿瘤组织中,Ktrans值同时受到来自组织血流量和渗透性的作用[12]。本研究结果显示消融前稳定组Ktrans值较进展组低,且差异有统计学意义。原因是进展组肿瘤分化程度较低,恶性程度较高,新生血管相对更丰富,血管迂曲杂乱,内皮细胞间隙较大,基底膜疏散,通透性更强,肿瘤微循环灌注情况较稳定组更加丰富。本研究结果也显示Ktrans与肿瘤微血管密度具有很好的相关性,这与Chen[13]等对经皮乙醇注射(PEI)兔VX2肝肿瘤模型DCEMRI参数与MVD的关系结果相一致。张成成等[14]通过对60例肝癌患者行动态灌注增强扫描也发现Ktrans与MVD呈线性正相关(r=0.739,P=0.000)。但Chen等[15]对34例HCC行自由呼吸状态下动态定量增强MRI时发现Ktrans与MVD不存在相关性。Oshida等[16]在关于直肠癌的研究中发现DCE-MRI灌注参数和MVD之间没有显着的相关性(Ktrans:r=-0.056;P=0.662,Ve:r=-0.103,P=0.416)。可能的解释是DCE-MRI参数与组织学之间缺乏相关性并不一定意味着参数不准确,而是组织学技术没有充分采样到复杂且不断变化的肿瘤血管生成代谢需求[17-18]。Kep反映的是对比剂在组织间隙内重新回流入血管内的速度,与Ktrans呈正相关。由于低分化肝癌新生血管数量更多,血管成熟度更差,渗透至血管外间隙的对比剂可以较快流回血管内间隙,因此,消融前稳定组Kep值(0.904±0.153)min-1均较进展组Kep值(1.115±0.080)低。所得结论与Huang等[19]的研究结果相一致,他们认为Ktrans、kep值可作为判断恶性肿瘤疗效评估的有效因子。DCE-MRI两室模型分析的Ve值主要表达血管外细胞外间隙内对比剂浓度在整个体素中比例的多少,取值介于0和1之间,因此主要反映组织间隙空间的大小,也就是间接反映细胞密度的大小。本研究中两组患者Ve值差异无统计学意义。可能是因为Ve受血管渗透性、肿瘤细胞密度、病变囊变坏死程度以及细胞外基质等多种因素共同影响[20]。本研究还发现Ve与MVD呈现正相关,宋琼等[21]研究表明肝癌的Ktrans值以及Ve值与微血管密度呈正相关,相关性强度分别为Ktrans>Ve。这些结论提示可以用DCE-MRI的定量参数值评估组织的微循环状况以及肿瘤的血管生成情况。
本研究尚存在一些不足:①纳入样本量较少,且扫描过程中患者自由平静呼吸状态,呼吸运动伪影的干扰影响功能磁共振后处理参数的准确性;②影像学分析与病理检查时只对相对应的单一层面进行了分析,两者间的对照可能存在偏差,后续研究可应用多个层面进行对比以增加研究结论的准确性;③DCE-MRI尚缺乏统一的成像标准,不同扫描参数、对比剂的种类和注射剂量、以及输入动脉的设定都对定量参数的测量造成影响。
综上所述,DCE-MRI两室模型可对HCC微循环状态进行量化评价,对肝癌射频消融疗效具有一定的术前预测作用,且DCE-MRI在一定程度上判断肿瘤微血管密度的丰富程度。随着将来DCE-MRI后处理标准的不断规范化,相信功能磁共振成像在肝癌诊断及疗效评估、预测方面将会有更广阔的应用前景。
