梯度多孔Fe-30Mn合金的制备与性能研究
2022-02-22曲美秀
曲美秀,李 强,耿 芳
梯度多孔Fe-30Mn合金的制备与性能研究
曲美秀1,李 强1,耿 芳2
(1.辽宁工业大学 材料科学与工程学院,辽宁 锦州 121001;2.美敦力(上海)有限公司,上海 310000)
采用粉末冶金技术制备梯度多孔Fe-30Mn合金,研究了造孔剂分布、烧结温度对梯度多孔Fe-30Mn合金孔隙度和压缩强度的影响,测试梯度多孔Fe合金的耐腐蚀性能,观察了梯度多孔Fe合金的物相组成、显微组织和腐蚀后微观形貌。结果表明:造孔剂含量增加,烧结产物的孔隙度增加,压缩屈服强度降低;烧结温度增加,烧结产物的孔隙度降低,压缩屈服强度增加。SEM和XRD分析表明梯度多孔Fe-30Mn合金由马氏体相(δ相)和奥氏体相(γ相)组成,随着造孔剂含量的增加,梯度多孔Fe-30Mn合金的耐腐蚀性能降低。这表明通过改变造孔剂含量可以调控梯度多孔Fe-Mn合金的腐蚀速率,有助于解决生物医用Fe材料降解速率慢的问题。
生物医用可降解材料;Fe基合金;孔隙度;压缩性能;降解速率
近年来,治疗心血管疾病的最有效方法之一是在人体内植入血管内支架。目前常见的支架材料有316L不锈钢,NiTi或CoCr合金。但是由于这些材料植入人体后不能降解,长期保留的结果是刺激血管壁,引发血膜增生,甚至是炎症,继而导致血管狭窄和晚期血栓[1-3]。当前镁基合金的可降解速率过快,锌基合金的力学性能较差,限制其生物医用的范围[4-5]。铁基合金相比镁基合金和锌基合金活泼性差,但是其生物相容性和力学性能较好,对人体无毒害作用,同时对血管抗再狭窄也有一定的积极作用[6-8]。因此铁基合金作为心血管支架是安全和有市场应用前景的,但是它腐蚀降解速率较慢,这是铁合金亟待解决的关键问题[9]。
本文采用了粉末冶金技术制备了具有梯度孔隙结构的多孔Fe-Mn合金,研究造孔剂分布、压制压力、烧结温度对梯度多孔Fe-30Mn合金孔隙度和压缩强度的影响,观察并测量了梯度多孔Fe合金的物相组成、显微组织和耐腐蚀性能。其中Mn元素的添加使Fe-30Mn合金在生理环境下形成了微电池,使降解速度得到了大大提升,同时Mn的加入有助于解决纯铁不能够进行核磁共振的问题。在本研究中,梯度多孔结构材料两端孔隙度较高,中间孔隙度较低,在保证植入体力学性能的同时,有利于水分和营养物质在植入体内的运输,促进了组织的再生与恢复,加快了痊愈的过程。同时粉末冶金产品成分均匀污染小,无铸造气孔、夹杂、偏析等缺陷制备工艺方法简便、成分易于调整和控制。
1 实验材料与方法
实验中所用的主要材料有Fe粉(200目,广州金属冶金有限公司)、Mn粉(200目,天津市致远化学试剂有限公司)和造孔剂碳酸氢铵。
实验过程如下:将Fe粉、Mn粉(Mn粉的含量为Fe粉的30 wt%)和造孔剂NH4HCO3粉末,按照计量比称好,用研磨钵混合均匀后备用,其中造孔剂呈现梯度分布:6 wt%(上层)-3 wt%(中间层)-6 wt%(下层),6 wt%-0 wt%-6 wt%,6 wt%-6 wt%-6 wt%,4 wt%-0 wt%-4 wt%。将混合均匀的Fe-Mn-NH4HCO3粉末倒入模具中,将模具放入压力机内,在200 MPa压力下压制成型。将Fe-Mn-NH4HCO3生坯室温干燥12 h后,在管式炉中烧结成型,烧结温度分别为:1 050、1 100、1 150、1 200 ℃,烧结过程中通氩气保护,保温2 h,随炉炉冷。
采用阿基米德排水法测量烧结后样品的孔隙度,采用X射线衍射仪(型号:日本Rigaku D/Max-2500/PC)对梯度多孔Fe-Mn合金进行物相分析。将烧结后梯度多孔Fe-Mn合金样品表面打磨、抛光、清洗后用4%硝酸酒精腐蚀,采用Sigma 500型场发射扫描电子显微镜观察试样的显微组织。用CMT-5035型电子万能试验机对梯度多孔Fe-Mn合金进行压缩强度测试,实验中加载速度为0.5 mm/min,试样尺寸为8 mm×8 mm×8 mm。在模拟人工模拟体液(SBF)生理环境下对梯度多孔Fe-Mn合金进行了电化学极化曲线测试和浸泡腐蚀实验。极化曲线测试在IVIUMSTAT.XRI电化学工作站上进行,电压测试范围为:-2.0~-0.3 V,扫描速率为1 mV/s,待测表面面积1 cm2。
2 实验结果与分析
2.1 造孔剂含量和烧结温度对梯度多孔Fe-30Mn合金孔隙度的影响
表1列举了具有4种不同造孔剂分布的梯度多孔Fe-30Mn合金的孔隙度。从表1中可以看出,当表层的造孔剂含量不变,中间层造孔剂从0 wt%增加到6 wt%,烧结后的梯度多孔Fe-Mn合金的孔隙度从26.5%增加到34.7%。当中间层造孔剂含量相同,表层造孔剂含量从4 wt%增加到6 wt%时,烧结后的梯度多孔Fe-Mn合金的孔隙度从21.6%增加到26.5%。在表1中可以看到,样品上下外表层和中间层孔隙出现明显的梯度分布,表层高孔隙在植入时有利于骨细胞的生长,中间低孔隙度区域有利于承担受力,这种过渡孔隙结构可以兼顾植入材料孔隙要求和力学性能要求。

表1 不同造孔剂分布下梯度多孔Fe-30Mn合金的孔隙度
孔隙产生的原因如下:一方面来源于造孔剂碳酸氢铵的分解,另一方面来源于Fe-Mn颗粒堆积时所产生的孔隙。前者形成的孔洞尺寸在200~500 μm,孔洞较大;后者通常是几十μm,孔洞较小。实验中发现碳酸氢铵含量越多分解时产生的气体越多,烧结后样品中所形成的孔洞越多,此外碳酸氢铵分解所形成的大孔会阻碍样品中Fe颗粒与Mn颗粒之间的扩散反应,影响产物的烧结性能,进一步导致烧结产物中孔隙增多。综合考虑孔隙特性和烧结性能,后续研究中造孔剂分布通常选用质量分数6%-3%-6%。
图1是经200 MPa压力压制,1 050~1 200 ℃烧结的梯度多孔Fe-30Mn合金的孔隙度。在图1中,当烧结温度从1 050 ℃提高到1 200 ℃时,烧结后样品的孔隙度由32.8%降低到24.9%,这是由于Fe颗粒和Mn颗粒的活性随着烧结温度的上升而而变得更加活泼,Fe和Mn颗粒有更充足的能量进行相互扩散反应,固体颗粒间相互键联,形成较大的烧结颈,Fe-Mn颗粒被烧结更加地紧密,所以烧结后的梯度多孔Fe-Mn合金的孔隙度逐渐减小。烧结温度过高会导致Fe合金的氧化和Mn的高温分解[10],因此本实验最终烧结温度为1 100 ℃。

图1 经不同温度烧结的梯度多孔Fe-30Mn合金的孔隙度
2.2 梯度多孔Fe-30Mn合金的显微组织分析
图2是梯度多孔Fe-30Mn合金孔隙和孔壁微观形貌照片。在图2(a)中,尺寸在200~500 μm范围内较大的孔隙是造孔剂分解所形成。植入材料在体内服役时,较大的孔隙便于体液的传输和成骨细胞的长入。在图2(a)中还可以看到样品表层和中间层孔隙出现明显的梯度分布。在图2(b)中,Fe和Mn颗粒之间堆积所形成的孔洞一般较小,通常为几十微米,这种小孔有利于纤维组织的长入。在图2(c)和图2(d)中可以看到,Mn基本上在Fe基体中均匀分布,但是局部区域也有Mn元素的缺欠和Fe元素的富集,这是因为粉末冶金烧结过程中Mn和Fe元素没有完全均匀扩散造成的。

2.3 梯度多孔Fe-30Mn合金的物相组成分析
图3是梯度多孔Fe-30Mn合金的XRD图谱。在图3中可以看到,梯度多孔Fe-30Mn合金主要由Austenite(奥氏体)相和Martensite(马氏体)相组成。这是因为粉末冶金过程是一个非平衡结晶过程,由Fe-Mn合金相图可知,在炉冷时会发生奥氏体向马氏体的转变。但当Mn含量超过27 wt%后,室温下应该仅存在Austenite(奥氏体)相。在实验结果中,在Fe-30Mn合金中发现Martensite(马氏体)相,这可能是因为混料的时候存在局部不均匀现象,在图2(d)中也可以观察到少量Mn分布不均匀现象,这导致局部区域Mn含量没有超过27 wt%,因此室温组织中存在马氏体相。但是马氏体也是反铁磁性材料,它的存在并不影响医学上核磁检测。

图3 梯度多孔Fe-30Mn合金的XRD图谱
2.4 造孔剂含量和烧结温度对梯度多孔Fe-30Mn合金压缩屈服强度的影响
表2为不同造孔剂含量下梯度多孔Fe-30Mn合金的压缩屈服强度。从表2中能够看到,当造孔剂含量从6 wt%-6 wt%-6 wt%降低到4 wt%-0 wt%-4 wt%,梯度多孔Fe-30Mn合金的压缩屈服强度从52.6 MPa增加到了89.2 MPa。造孔剂的主要作用就是使Fe-Mn合金出现更多的孔隙,因此随着造孔剂含量的减小烧结后的试样中孔隙减少,承担外加载荷的固相部分增加,单位载荷降低,同时孔壁厚度会增加,试样在受到外力而变形的时候,裂纹不容易在孔壁处扩展,这些均导致烧结后梯度多孔Fe-Mn合金压缩屈服强度增加。当表层含量相同,而中间层造孔剂含量降低时,虽然表层承担载荷的能力不变,但是中间层承载能力增强,中间层不容易变形,同时裂纹在试样内部不易延伸和扩展。因此烧结产物的压缩屈服强度增加。

表2 不同造孔剂含量的梯度多孔Fe-30Mn合金的压缩屈服强度
图4是经1 050~1 200 ℃烧结后梯度多孔Fe-30Mn合金的压缩屈服强度。由图4可知,提高烧结温度后,梯度多孔Fe-30Mn合金的压缩屈服强度升高。当烧结温度由最初的1 050 ℃逐渐升到 1 200 ℃时,压缩屈服强度从54.5 MPa上升到85.7 MPa。这是因为Fe颗粒与Mn颗粒之间的扩散反应随着烧结温度的升高而加剧,扩散所形成的烧结颈面积增大,连接强度随之增强,孔隙等缺陷减少,因此烧结后的梯度多孔Fe-Mn合金承担外加载荷的能力增强,压缩屈服强度会提高。但是,由文献[10]可知,Mn在1 200 ℃附近极其容易挥发,Mn的烧失现象非常严重,因此在考虑到生物医用材料压缩屈服强度使用范围,本文最终选择烧结温度为 1 100 ℃。

图4 不同温度烧结的梯度多孔Fe-30Mn合金压缩屈服强度
2.5 梯度多孔Fe-Mn合金的耐腐蚀性能分析
2.5.1 梯度多孔Fe-Mn合金的极化曲线分析
图5是具有不同造孔剂含量的梯度多孔Fe-30Mn合金的极化曲线。表3是极化曲线经塔菲尔拟合所得数据。

图5 不同造孔剂含量的梯度多孔Fe-30Mn合金的极化曲线

表3 造孔剂不同的梯度多孔Fe-30Mn合金极化曲线经塔费尔拟合所得的参数
由图5可知,当造孔剂从4 wt%-0 wt%-4 wt%增加到6 wt%-6 wt%-6 wt%时,梯度多孔Fe-30Mn合金的自腐蚀电位从-0.56 V降低到-0.66 V,维钝电流密度从1.13×10-4A/cm2增加到5.41×10-4A/cm2,合金的耐腐蚀性能降低。这是因为梯度多孔Fe-30Mn合金内部的孔隙越多,在电解液中浸泡时,与电解液接触的有效面积越增加,反应物增多,腐蚀几率增大,因此其耐腐蚀性能降低。在本研究中,通过调整造孔剂的含量和分布可以控制Fe-Mn合金的耐腐蚀性,进而控制其降解速率。
事实上,多孔Fe-Mn合金浸泡在模拟人工体液中,可以发生如下化学反应:


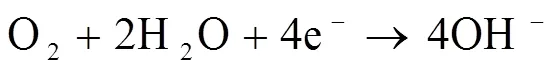
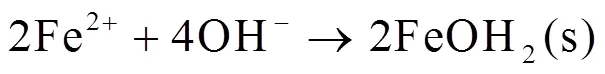


在腐蚀过程中,铁离子、锰离子在浸泡液中扩散,铁离子与OH-发生反应,形成不溶性氢氧化物(或金属含水氧化物)附着在样品表面。同时锰离子与OH-发生反应生成的氢氧化物也沉积在试样表面。试样表面呈现红棕色。这层沉积物中也存在部分的缺陷,在缺陷处点蚀可能发生,导致试样内部进一步腐蚀。最后,随着沉积时间增加,试样表面形成了Ca/P层,试样的表面稳定,腐蚀速率达到最低值。另外,考虑到试样内孔隙的存在,缝隙腐蚀在孔隙处发生,加速腐蚀进行。因此随着孔隙度增加,试样的腐蚀更快。
2.5.2 梯度多孔Fe-Mn合金腐蚀形貌分析
图6是梯度多孔Fe和Fe-30Mn合金在模拟人工体液中浸泡3 d的显微组织照片。由图6可知,梯度多孔Fe-30Mn合金表面腐蚀产物均明显比梯度多孔Fe多,这说明梯度多孔Fe-30Mn合金的耐腐蚀性能比梯度多孔Fe耐腐蚀性能差,这与上述电化学极化曲线分析结果相一致。其主要原因是Mn元素添加,一方面增加了试样内部的孔隙度,使缝隙腐蚀更加明显。其次Fe-Mn合金出现γ和δ双相,两相的电位差形成微电池腐蚀,因此Fe-Mn合金的腐蚀速率加大,试样表面所形成的腐蚀产物较多。对图6(b)中1#区域进行EDS分析。由EDS分析可知,腐蚀产物主要由Fe、Mn、Cl、Au、Ca、P、O组成,其中Au是喷金造成,Ca、P、O、Cl来源于电解液。这表明腐蚀产物主要是Fe和Mn的氧化物,此外还有来自模拟人工体液的Ca和P离子的沉积。

3 结论
(1)梯度多孔Fe-30Mn合金的孔隙度随着造孔剂含量增加而提高,但其压缩屈服强度降低;提高烧结温度将降低梯度多孔Fe-30Mn合金孔隙度,增加其压缩屈服强度。当造孔剂分布为6wt%-3wt%-6wt%,经200 MPa压力压制,1 100 ℃烧结2 h后,梯度多孔Fe-30Mn合金的孔隙度为30.9%,压缩屈服强度为64.1 MPa。
(2)SEM和XRD分析表明:当Mn元素加入Fe基体后,形成马氏体相(δ相)和奥氏体相(γ相),Fe-Mn合金中的δ相和γ相具有顺磁性,有利于扩展Fe-Mn生物医用材料在磁共振成像方面的应用。
(3)耐腐蚀性测试表明:随着中间层造孔剂含量增加,缝隙腐蚀在孔隙处发生。梯度多孔Fe-Mn合金的维纯电流密度增加,耐腐蚀性能降低。因此,通过改变造孔剂可以控制梯度多孔Fe-Mn合金的腐蚀速率,有助于解决生物医用Fe材料降解速率慢的问题。
[1] Zhang E, Chen H, Shen F. Biocorrosion properties and blood and cell compatibility of pure iron as a biodegradable biomaterial[J]. Journal of Materials Science Materials in Medicine, 2010, 21(7): 2151-2163.
[2] Zhu S, Huang N, Xu L, et al. Biocompatibility of pure iron: in vitro assessment of degradation kinetics and cytotoxicity on endothelial cells[J]. Materials Science & Engineering: C, 2009, 29(5): 1589-1592.
[3] Hermawan H, Alamdari H, Mantovani D, et al. Iron-manganese: new class of metallic degradable biomaterials prepared by powder metallurgy[J]. Powder Metallurgy, 2008, 51(1): 38-45.
[4] Hermawan H, Purnama A, Dube D, et al. Fe-Mn alloys for metallic biodegradable stents: Degradation and cell viability studies[J]. Acta Biomaterialia, 2010, 6(5): 1852-1860.
[5] 张广道, 黄晶晶, 杨柯, 等. 动物体内植入镁合金的早期实验研究[J]. 金属学报, 2007, 43(11): 68-72.
[6] 代晓军, 杨西荣, 王昌, 等. 生物医用可降解锌基合金的研究进展[J]. 材料导报, 2018, 32(21): 3754-3759.
[7] Zhang E , Chen H , Shen F. Biocorrosion properties and blood and cell compatibility of pure iron as a biodegradable biomaterial[J]. Journal of Materials Science Materials in Medicine, 2010, 21(7): 2151-2163.
[8] Moravej M, Mantovani D. Biodegradable metals for cardiovascular stent application: interests and new opportunities[J]. International Journal of Molecular Sciences, 2011, 12(7): 4250-4270.
[9] Huang S M, Nauman E A, Stanciu L A. Investigation of porosity on mechanical properties, degradation and in-vitro cytotoxicity limit of Fe30Mn using space holder technique[J]. Materials Science & Engineering, 2019, 99: 1048-1057.
[10] Hong D, Chou D T, Velikokhatnyi O I, et al. Binder-jetting 3D printing and alloy development of new biodegradable Fe-Mn-Ca/Mg alloys[J]. Acta Biomaterialia, 2016, 45: 375-386.
Study on Preparation and Property of Gradient Porous Fe-30Mn Alloys
QU Mei-xiu1, LI Qiang1, GENG Fang2
(1.School of Materials Science and Engineering, Liaoning University of Technology, Jinzhou 121001, China; 2.Medtronic(Shanghai)Co., LTD, Shanghai 310000, China)
In this study, gradient porous Fe-Mn alloys were prepared by powder metallurgy technology. The effects of pore-forming agent distribution, sintered temperature on porosity and compressive properties were investigated. Their corrosion resistance was measured. For gradient porous Fe alloys, phase composition, microstructure and micro-morphology after corrosion were observed. The results show that when increasing the pore-forming agent content the porosity of sintered products increases, the compressive yield strength decreases. When increasing sintering temperature, the porosity of the sintered products decreases and the compressive yield strength increases. SEM and XRD analyses show that martensite phase (δ phase) and austenite phase (γ phase) are formed in the gradient porous Fe-30Mn alloy. The corrosion resistance of gradient porous Fe-30Mn alloy decreases with the increase of pore-forming agents. These results indicate that the corrosion rate of gradient porous Fe-Mn alloy can be controlled by changing the content of pore-forming agent, which is helpful to solve the problem of slow degradation rate of biomedical Fe materials.
biomedical degradable material; Fe base alloy; porosity; compressive properties; degradation rate
10.15916/j.issn1674-3261.2022.06.005
R318.08
A
1674-3261(2022)06-0373-05
2022-05-05
国家自然科学基金资助项目(51805236);辽宁省教育厅基础研究项目(JJL201915407)
曲美秀(1999-),女(满族),辽宁岫岩人,本科生。
李 强(1976-),男,辽宁新民人,教授,博士。
责任编辑:刘亚兵
