慢性炎性疼痛对小鼠肠道菌群的影响
2022-02-22王小敏王俣棋曾建业周思宸邢承志胡翔宇吴亚男张昳若范红结
王小敏,徐 鹏,王俣棋,曾建业,周思宸,邢承志,胡翔宇,吴亚男,张昳若,范红结
疼痛是临床最常见的症状之一,炎性疼痛又是最重要的疼痛类型[1]。炎性疼痛是由创伤、感染等各种因素造成的炎症所诱发的疼痛,是最常见的临床疼痛类型,正成为全球健康问题之一。此外,疼痛敏感和消极情绪之间存在着相互促进作用,现有的治疗方法并不能消除慢性疼痛患者的消极情绪和抱怨[2]。肠道定居着数量庞大的微生物群,是人体最复杂的“微生态系统”,影响着人体健康[3]。然而,至今很少有研究探讨肠道菌群在慢性炎性疼痛中的作用。弗氏完全佐剂(complete freund’s adjuvant,CFA)常被用于构建慢性炎性疼痛模型。该研究基于CFA构建C57BL/6J小鼠慢性炎性疼痛模型,从小鼠结肠内粪便样本菌群的角度间接探讨慢性炎性疼痛对小鼠肠道菌群的影响。
1 材料与方法
1.1 实验动物与分组12只雌性11周龄SPF级别的C57BL/6J小鼠均购自长沙天勤生物技术有限公司,随机分为对照组(Mock组)和疼痛组(CFA组),6只/组,适应性喂养1周。随后,疼痛组小鼠右后足底皮下注射50 μl的CFA(购自默克美国Sigma公司),相应的左足作为对照;对照组小鼠右足相应部位注射等量的0.9%氯化钠溶液。
1.2 临床观察每天对小鼠的精神状态、摄食量、饮水量、皮毛光泽度、行动活跃程度和是否出现跛行等进行观察和记录,连续观察2周。
1.3 行为测定采用冯·弗雷方法量化小鼠对触觉刺激的敏感性。测定之前,小鼠在高架尼龙网地板上适应性喂养30 min。在安静的环境下,一根标准von Frey纤维被应用于一只小鼠右后足底的测试,3 s/次,重复测量3次,每次间隔至少30 s,以消除前一次刺激带来的影响。通过评分来评估右后足对触觉刺激的敏感性:① 无反应;② 快速收爪,但无畏缩或舔爪行为;③ 强烈的收爪,并伴有畏缩或/和舔爪行为。
1.4 样品采集和处理实验2周后,全部C57BL/6J小鼠经CO2吸入麻醉后颈椎脱臼实施安乐死,解剖取结肠内粪便约1 g,置于1.5 ml灭菌EP管中,组内两只小鼠的结肠内粪便进行混样,并置于-80 ℃冰箱保存。所有样品干冰保存送至上海派森诺生物科技股份有限公司进行16S rRNA的测序、OTU(Operational Taxonomic Unit)聚类分析、Alpha和Beta多样性分析、菌群差异和关联分析等。
1.5 数据分析采用Illumina MiSeq平台对小鼠结肠内粪便群落进行16S rRNA的测序,测序数据经过去噪过滤后,对每个样本测序量进行统计分析;按照Vsearch软件的分析流程进行OTU聚类,随后通过与数据库的比对,对OTU进行物种注释;通过OTU在不同样本中的分布,利用QIIME2软件评估每个样本中微生物的Alpha多样性水平;在OTU层面,计算各样本的距离矩阵,并通过多种非监督的排序、聚类手段,结合相应统计学检验方法,衡量不同样本(组)间的Beta多样性差异及差异显著性;结合分类学组成分析、UPGMA算法、LEfSe分析等方法,进一步衡量不同样本(组)间的物种丰度组成差异,寻找标志物种等。
2 结果
2.1 慢性炎性疼痛模型小鼠精神状态良好,饮食饮水正常,Mock组外观无异常,步态平稳;CFA组小鼠外观无异常,患病足红肿,活动时均有不同程度的拖足现象。与正常组相比,CFA组机械痛阈值显著降低(P<0.01),这也表明慢性炎性疼痛造模成功,CFA可明显诱导小鼠的机械痛敏反应。
2.2 微生物OTU比较分析测序结果获得后,按97%的相似度对所有序列进行OTU聚类,随后用VENN图统计分析两组样本中共有的和独有的OTU数目。结果可知,两组样本一共有2 601个OTU,共有的OTU数目为335个,CFA组和Mock组分别独有720个和1 546个。见图1。
2.3 菌群Alpha多样性分析Chao1、Simpson、Shannon、Pielou_e、Observed_species和Goods_coverage指数是可用于综合评价样本微生物群落丰富度和多样性的参数。CFA组的Chao1、Observed_species指数低于Mock组,由此可见,Mock组的物种丰富度显著高于CFA组;Mock组的Shannon、Simpson和Pielou_e指数高于CFA组,说明Mock组的物种多样性和均匀度都高于CFA组;以上表明CFA导致的慢性炎性疼痛影响了小鼠肠道菌群的结构和数量,降低了小鼠肠道菌群的菌群丰富度和多样性。Mock组和CFA组的Goods_coverage指数相差不大且都高于99.5%,表明样本测序覆盖率很高,没有被测出的概率很低,实验数据可靠。见图1。
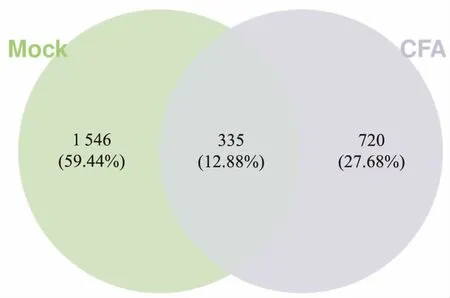
图1 慢性炎性疼痛对小鼠肠道微生物基因OTU分布的影响
2.4 菌群Beta多样性分析由图3可知,6个样本共聚为两大分支,CFA组3个样本之间的微生物群落结构相似度较高,共同聚集在上方。Mock组3个样本之间微生物群落构成相似度相对于CFA组较低,聚集在下方,其中一个样本与其他样本差异度略高。
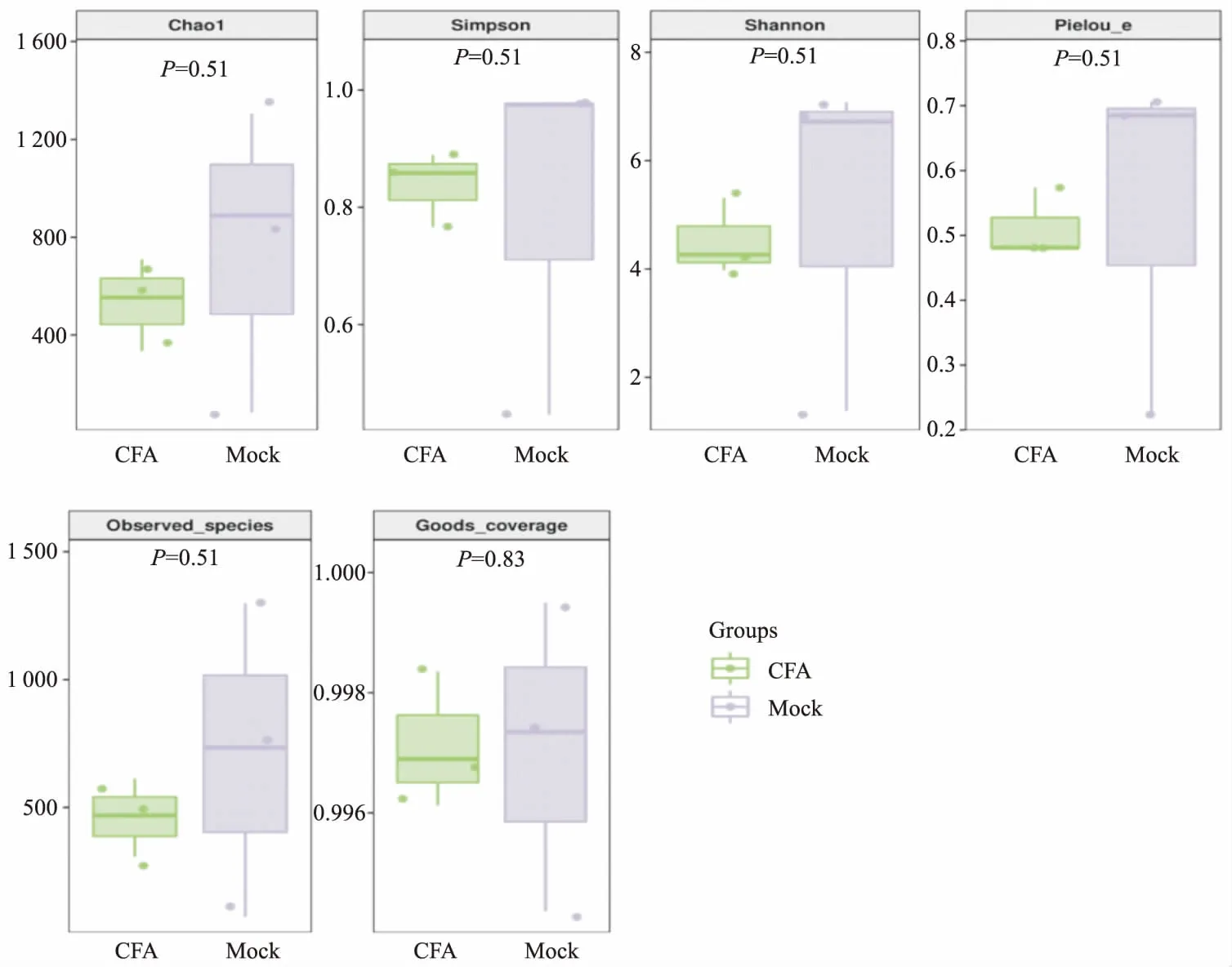
图2 慢性炎性疼痛对小鼠肠道菌群多样性指数的影响
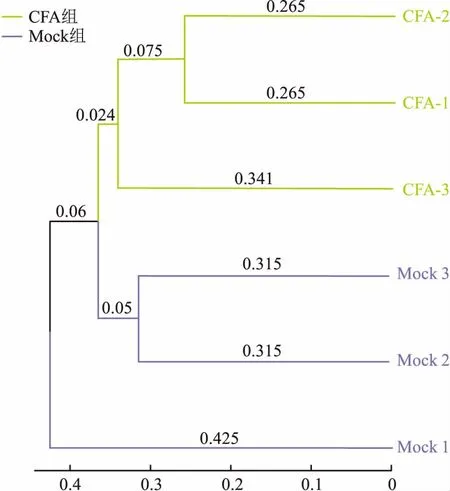
图3 小鼠肠道微生物群落聚类分析
2.5 菌群结构分析两组小鼠肠道菌群在门水平主要由5个门组成(图4A),即厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、TM7门(TM7)和放线菌门(Actinobacteria)。相对于Mock组,CFA组厚壁菌门(24.69%→66.86%)和TM7门(1.55%→5.47%)的相对丰度显著升高,而拟杆菌门(45.41%→9.20%)和变形菌门(26.30%→14.98%)的相对丰度显著降低。
在科水平上,共鉴定出114个科,两组共享52个科。CFA组和Mock组分别有53个和9个独有的科。由图4B可见,两组在科水平主要由气球菌科(Aerococcaceae)、S24-7科(S24-7)、莫拉菌科(Moraxellaceae)、乳酸杆菌科 (Lactobacillaceae)、理研菌科(Rikenellaceae)、F16科(F16)、脱硫弧菌科(Desulfovibrionaceae)、瘤胃菌科(Ruminococcaceae)、帕拉普氏菌科(Paraprevotellaceae)和毛螺菌科(Lachnospiraceae)10个科组成。相对于Mock组,CFA组气球菌科(7.31%→35.10%)、乳酸杆菌科(5.32%→23.51%)、理研菌科(2.01%→5.68%)、F16科(1.55%→5.46%)和脱硫弧菌科(0.62%→5.03%)的相对丰度均升高,S24-7科(33.66%→2.08%)、莫拉菌科(24.42%→8.77%)和瘤胃菌科(4.21%→1.28%)的相对丰度均降低,毛螺菌科(1.30%→1.40%)的相对丰度未见明显差异。
测序结果表明,肠道微生物共由184个属组成,其中CFA组为166个,Mock组为106个。图4C显示:占比最多的10个属为气球菌属(Aerococcus)、嗜冷杆菌属(Psychrobacter)、乳酸杆菌属(Lactobacillus)、脱硫弧菌属(Desulfovibrio)、普雷沃氏菌属(Prevotella)、颤螺菌属(Oscillospira)、安德克氏菌属(Adlercreutzia)、瘤胃球菌属(Ruminococcus)、拟杆菌属(Bacteroides)和双歧杆菌属(Bifidobacterium)。相对于Mock组,CFA组气球菌属(7.30%→34.74%)、乳酸杆菌属(5.30%→23.51%)和脱硫弧菌属(0.48%→4.64%)的相对丰度均升高,嗜冷杆菌属(24.09%→8.64%)、普雷沃氏菌属(1.01%→0.07%)、颤螺菌属(2.35%→0.55%)和双歧杆菌属(1.27%→0%)的相对丰度均降低。由图4D可知,CFA组和Mock组的优势菌属及所占比例均存在较大差异,其结果与结肠内粪便菌群在属水平上的微生物结构(图4C)分析相一致。
为了通过肠道微生物组成结构区分慢性炎性疼痛小鼠和健康小鼠,该研究通过LEfSe分析组间差异,寻找具有统计学差异的潜在鉴别生物标志。然而,在所有的分类水平上,即从门到属(从内圈到外圈)的主要分类等级上,发现的生物标志物较多,包括Mock组的乳球菌属(Lactococcus)及CFA组的27个潜在生物标志物(图5)。结合LDA阈值以及属水平上的微生物结构(图4C、D),可知,Mock组与CFA组菌群结构差异较大,相对于CFA组,Mock组乳球菌属的相对丰度较高,且差异显著。

图4 不同处理组在门水平、科水平和属水平上的微生物结构A:小鼠肠道微生物门水平物种组成分析图;B:小鼠肠道微生物科水平物种组成分析图;C:小鼠肠道微生物属水平物种组成分析图;D:小鼠肠道微生物属水平热图

图5 基于分类等级树的组间差异分类单元展示图
3 讨论
慢性炎性疼痛属于慢性疼痛范畴,通常与其他疾病同时发生,并表现出复杂的痛觉异常和痛觉过敏,可引起剧烈的情绪反应,一般伴有焦虑或抑郁障碍。WHO流行病学调查表明,成人慢性疼痛在全世界的平均发病率高达30%左右[4-5]。慢性疼痛伴随负性认知及情绪,给患者本人、家庭和社会都带来节点大小对应于该分类单元的平均相对丰度;空心节点代表组间差异不显著的分类单元,而其它颜色的节点则表明这些分类单元体现出显著的组间差异,且在该色所代表分组样本中丰度较高;字母为标识组间存在显著差异的分类单元的名称了严重的负担,已成为当今社会普遍关注的公共健康问题,属于重大疾病的范畴[4-6]。
研究[7-10]表明,无论是在生理还是病理条件下,肠道微生物都是肠道和大脑之间复杂交互作用中的重要因素。不同肠道微生物成分可以影响行为和认知,神经系统亦可间接影响肠道微生物的菌群结构,这些研究[11]有助于建立大脑和肠道之间的对话桥梁“肠-脑轴”。目前,有研究[12-14]表明,肠道微生物菌群可能在疼痛感知和慢性疼痛的发生发展中发挥重要作用。该研究以临床较为常见的慢性疼痛即慢性炎性疼痛作为切入点,利用小鼠足底注射CFA成功构建了慢性炎性疼痛模型,应用16S rRNA测序技术对慢性炎性疼痛模型小鼠与健康小鼠的结肠内粪便菌群进行了鉴定与分析,以间接探讨慢性炎性疼痛对小鼠肠道菌群的影响,为寻找治疗慢性炎性疼痛提供新思路。
该研究中两组样本的测序覆盖率都高于99.5%,表明实验数据可靠。经菌群分析显示,CFA组和Mock组的细菌多样性、物种丰度和微生物群落组成各不相同,CFA组小鼠肠道菌群多样性和均匀度均降低。由此可知,慢性炎性疼痛影响了小鼠肠道菌群的结构、分布和数量,造成了肠道菌群平衡的紊乱。在门水平上,CFA组大大增加了厚壁菌门这一有益微生物的丰度,降低了变形菌门这一有害微生物的丰度,以增强机体自身的免疫力;但又降低了有益菌拟杆菌门的丰度,使得拟杆菌门/厚壁菌门的比值降低,同时增加了TM7菌的丰度,亦增加了疾病发生的可能性;这也说明肠道微生物菌群在机体健康中发挥着“双刃剑”的作用,其平衡和失调在疾病的发生和发展中发挥着重要作用。在科水平上,共鉴定出114个科,CFA组和Mock组分别有53个和9个独有的科;两组在10个优势菌科的丰度上都存在较大的差异,其优势菌群气球菌科和乳酸菌科占细菌总序列的比例亦存在较大的差异,分别占CFA组和Mock组细菌总序列的58.61%(35.10%+23.51%)和12.63%(7.31%+5.32%)。在属水平上,相对于Mock组,CFA组的有益菌气球菌属、乳酸杆菌属的相对丰度升高,由此可见,即使发生慢性炎性疼痛,小鼠菌群结构发生改变,机体肠道菌群仍然能够增加部分有益菌的比例,发挥着有益菌的屏障作用,抑制有害菌的增殖,维持肠道健康,延缓疾病的发生与发展;然而,部分有益菌如普雷沃氏菌属、瘤胃球菌属、拟杆菌属的相对丰度均降低,双歧杆菌属甚至降低至无,有害菌脱硫弧菌属相对丰度升高,这也表明,慢性炎性疼痛降低了部分有益菌的比例,且有害菌脱硫弧菌属可能参与慢性炎性疼痛/消极情绪的发生发展。LEfSe分析筛选显著差异性物种,结果显示,相对于CFA组,Mock组的差异物种为具有良好改善肠道屏障功能和抵御病原微生物作用的乳球菌属。
该研究对慢性炎性疼痛小鼠结肠内粪便菌群的多样性和结构组成有了一定的认识,间接反映了肠道菌群的多样性和丰度,为今后筛选有益微生物、进一步探究通过肠道调整微生物治疗慢性炎性疼痛,经“肠-脑轴”改善病人消极情绪奠定基础。
