lncRNA PITPNA-AS1靶向miR-92a-3p/TCF21对卵巢癌OVCAR-3细胞增殖和侵袭的影响
2022-02-22曾友玲马元学
曾 洁,曾友玲,张 清,陈 说,杨 玉,马元学
卵巢癌是一种常见的妇科恶性肿瘤,病死率居妇科肿瘤首位,其发病率近年来呈现上升趋势[1]。卵巢癌的治疗方式主要包括外科手术治疗和化疗,医疗技术的进步尽管改善了卵巢癌患者的预后,但其五年生存率依然很低,严重威胁女性生命健康[2]。因此,寻找新的卵巢癌早期诊断标志物和分子治疗靶标对改善患者的预后具有重要意义。长链非编码RNA(long non-coding RNA,lncRNA)是一种转录本长度大于200个核苷酸的非编码RNA[3]。lncRNA可在转录水平或者转录后水平影响基因的表达,调控细胞分化、凋亡、衰老等各种生物学行为[4]。越来越多的研究[5]表明,lncRNA在多种肿瘤如卵巢癌、鼻咽癌、甲状腺癌、肝癌等中表达异常,在肿瘤的发生、发展过程中扮演重要角色。研究[6- 7]显示,lncRNA PITPNA-AS1定位于细胞质,可影响肝癌、肺癌、宫颈癌细胞的增殖、细胞周期、转移、凋亡等。卵巢癌中关于PITPNA-AS1的报道很少。该研究通过检测卵巢癌组织和细胞系中PITPNA-AS1的表达水平,观察过表达PITPNA-AS1后卵巢癌细胞增殖活力和侵袭能力,并进一步预测和验证PITPNA-AS1作用的分子机制。
1 材料与方法
1.1 材料
1.1.1组织标本 收集2018年6月—2020年8月在华中科技大学同济医学院附属武汉儿童医院(武汉市妇幼保健院)妇科接受手术治疗的42例卵巢癌患者的癌组织和癌旁组织。患者年龄38~74(56.42±9.13)岁。组织于液氮罐中保存,所有组织均由该院病理科医师确认,癌组织类型均为浆液性囊腺癌,高分化19例,中低分化23例。国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期为Ⅰ期+Ⅱ期28例、Ⅲ期+Ⅳ期14例。该研究经华中科技大学同济医学院附属武汉儿童医院医学伦理委员会审核通过,患者均签署知情同意书。
1.1.2 细胞与试剂人卵巢癌细胞系(HO-8910、A2780、SKOV-3、OVCAR-3、OC3)和正常卵巢上皮细胞系IOSE80均购自中国科学院上海细胞库。miR-92a-3p mimics、miR-NC、PITPNA-AS1过表达质粒、阴性对照质粒、PITPNA-AS1-WildType-Reporter(WT)载体、PITPNA-AS1-Mut-Reporter(Mut)载体、TCF21-WildType-Reporter(WT)载体、TCF21-Mut-Reporter(Mut)载体购自上海吉玛公司。DMEM/F12培养基、胎牛血清(FBS)、RPMI 1640培养基购自美国Hyclone公司。Transwell小室购自美国康宁公司。TRIzol试剂盒、Lipofectamine 3000转染试剂盒、Matrigel基质胶购自美国Invitrogen公司。细胞计数实验(cell count kit-8,CCK-8)试剂盒购自大连美仑生物技术有限公司。qPCR试剂盒、RNA逆转录试剂盒购自美国Roche公司。双荧光素酶报告基因试剂盒和一抗(TCF21、CDK6、β-Tubulin、Cyclin D2、Zeb2、Snail)均购自美国Abcam公司。
1.2 方法
1.2.1细胞培养和转染 常规复苏OVCAR-3、OC3细胞后培养于含10% FBS的RPMI 1640培养基,常规复苏HO-8910、A2780、SKOV-3、IOSE80细胞后培养于含10% FBS的DMEM/F12培养基,在37 ℃、5%体积分数CO2的培养箱中培养。将对数生长期的OVCAR-3细胞接种于6孔板,细胞汇合度为50%时,采用脂质体转染技术将PITPNA-AS1或阴性对照质粒转染进OVCAR-3细胞,记为实验组和对照组,转染方法依据Lipofectamine 3000说明书严格操作。收集转染48 h后的细胞用于后续实验。
1.2.2荧光实时定量聚合酶链反应(qPCR) 采用TRIzol法提取组织或细胞中总RNA,超微量分光光度计检测RNA的纯度及浓度,采用逆转录试剂盒逆转录RNA为cDNA。建立qPCR扩增体系,qPCR引物序列:PITPNA-AS1上游引物为 5′-GCAGGGTGGATAAAGAGGA-3′,下游引物为5′-CCTACTGACAGGATGTCCT-3′;GAPDH上游引物为 5′-AGAAGGCTGGGGCTCATTTG-3′,下游引物为5′-AGGGGCCATCCACAGTCTTC-3′;TCF21上游引物为 5′-TCCTGGCTAACGACAAATACGA-3′,下游引物为5′-TTTCCCGGCCACCATAAAGG-3′;U6上游引物为5′-CTCGCTTCGGCAGCACA-3′,下游引物为5′-ACGCTTCACGAATTTGCGT-3′;miR-92a-3p上游引物为 5′-UAUUGCACUGUCCCGGCCUGU-3′,下游引物为5′-CAGTGCGTGTCGTGGAGT-3′。采用2-ΔΔCt法处理数据,以GAPDH为内参分析PITPNA-AS1和TCF21 mRNA的表达水平,以U6为内参分析miR-92a-3p的表达水平。
1.2.3CCK-8检测OVCAR-3细胞的增殖活性 将转染后的各组OVCAR-3细胞接种于96孔板(3 000个/孔),200 μl/孔培养基,分别培养1、2、3、4、5 d,在每个时间点分别进行CCK-8法检测时,每孔中加入20 μl CCK-8试剂,在暗箱中继续培养2 h,在酶标仪上测定450 nm波长处每孔的吸光度(A)值,以A值代表细胞的增殖活性。
1.2.4Transwell实验检测OVCAR-3细胞的侵袭能力 预铺Matrigel基质胶至Transwell小室上层,在培养箱中凝固。胰酶消化收集转染后的OVCAR-3细胞,无血清培养基制备单细胞悬液,接种于Transwell小室上层(2×104个/孔),每孔200 μl培养基。在Transwell小室下层加600 μl含血清培养基。在培养箱中培养24 h,取出Transwell小室,4%多聚甲醛固定20 min,0.1%结晶紫溶液染色20 min。流水冲洗后,采用棉签擦去未穿膜的OVCAR-3细胞。室温下风干后,在光学显微镜下对侵袭细胞数计数。
1.2.5生物信息学方法预测PITPNA-AS1作用的分子机制 使用starBase v2.0网站预测PITPNA-AS1可相互作用的微小RNA(miRNA)。使用DIANA-microT网站预测miRNA的靶基因。
1.2.6双荧光素酶报告基因实验 将PITPNA-AS1-WT、PITPNA-AS1-Mut质粒分别与miR-NC、miR-92a-3p共转染至OVCAR-3细胞中,根据双荧光素酶报告基因试剂盒说明书操作,48 h后用化学发光技术测定每组细胞的相对荧光素酶活性,验证miR-92a-3p靶向结合并受PITPNA-AS1调控。将TCF21-WT、TCF21-Mut质粒分别与miR-92a-3p、miR-NC共转染至OVCAR-3细胞中,根据双荧光素酶报告基因试剂盒说明书操作,48 h后用化学发光技术测定每组细胞的萤火虫荧光素酶活性和海肾荧光素酶活性,相对荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性,验证miR-92a-3p靶向结合并可调控TCF21。
1.2.7Western blot检测 在各组细胞中加入1 ml RIPA 裂解液,冰上裂解 30 min,收集上清液并采用BCA蛋白定量试剂盒检测蛋白浓度。每孔道加等量蛋白,进行十二烷基聚丙烯酰胺凝胶电泳,转膜后用5%脱脂牛奶封闭3 h,加入均以1 ∶1 000比例稀释的一抗,在冰箱内孵育过夜。加入以1 ∶10 000比例稀释的二抗孵育3 h,滴加ECL溶液,在化学发光成像系统内显影、拍照,以β-tubulin为内参蛋白。采用Image-Pro Plus 4.0软件比较蛋白的相对表达水平。
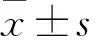
2 结果
2.1 PITPNA-AS1在卵巢癌组织和细胞系中低表达该研究结果显示,PITPNA-AS1在卵巢癌组织相对表达低于癌旁组织相对表达,差异有统计学意义(t=14.81,P<0.01),见图1。与正常卵巢上皮IOSE80细胞相比,PITPNA-AS1在人卵巢癌细胞系(HO-8910、A2780、SKOV-3、OVCAR-3、OC3)中低表达(P<0.05),见图2,以OVCAR-3细胞中PITPNA-AS1的表达最低(P<0.01),所以后续实验选该细胞系。

图1 PITPNA-AS1在卵巢癌组织和癌旁组织中的表达与癌旁组织比较:**P<0.01

图2 PITPNA-AS1在正常卵巢上皮细胞和卵巢癌细胞系中的表达与IOSE80细胞比较:*P<0.05,**P<0.01
2.2 转染PITPNA-AS1过表达质粒对OVCAR-3细胞中PITPNA-AS1的表达的影响该研究显示,PITPNA-AS1在对照组和实验组OVCAR-3细胞中相对表达分别为(1.01±0.07)和(12.12±2.54),差异有统计学意义(P<0.01),提示PITPNA-AS1质粒可有效提高OVCAR-3细胞中PITPNA-AS1的表达,表明转染成功。
2.3 过表达PITPNA-AS1对OVCAR-3细胞增殖活性的影响CCK-8法检测显示(图3),接种2 d后,对照组OVCAR-3细胞吸光度高于实验组OVCAR-3细胞(P<0.05),表明过表达PITPNA-AS1能抑制OVCAR-3细胞增殖活性。

图3 过表达PITPNA-AS1对OVCAR-3细胞增殖活性的影响与对照组比较:*P<0.05,**P<0.01
2.4 过表达PITPNA-AS1对OVCAR-3细胞的侵袭能力影响Transwell实验显示(图4),对照组穿膜细胞数个/视野多于实验组穿膜细胞数,差异有统计学意义(P<0.01),表明过表达PITPNA-AS1能抑制OVCAR-3细胞的侵袭能力。
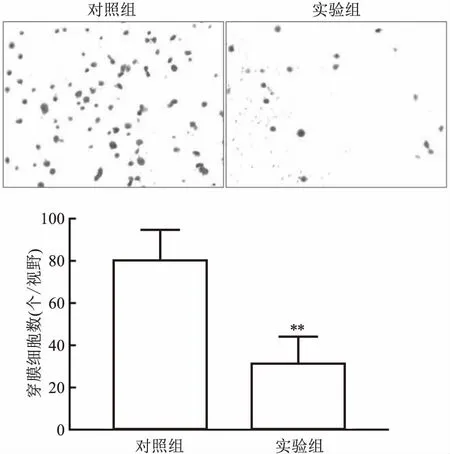
图4 过表达PITPNA-AS1表达对OVCAR-3细胞侵袭能力的影响 结晶紫染色 ×100与对照组比较:**P<0.01
2.5 生物信息学方法预测PITPNA-AS1作用的分子机制如图5,使用starBase v2.0网站预测显示,miR-92a-3p可以与PITPNA-AS1的互补序列结合。使用DIANA-microT网站预测显示,TCF21 mRNA可以与miR-92a-3p中互补序列结合。

图5 PITPNA-AS1互补结合miR-92a-3p的序列区域及miR-92a-3p互补结合TCF21 mRNA的序列区域
2.6 双荧光素酶报告基因实验如图6,共转染PITPNA-AS1-WT与miR-92a-3p后相对荧光素酶强度较PITPNA-AS1-WT与miR-NC降低(P<0.01),定点突变后,共转染PITPNA-AS1-Mut与miR-92a-3p较PITPNA-AS1-Mut与miR-NC相对荧光素酶活性差异无统计学意义,表明PITPNA-AS1能够靶向结合miR-92a-3p。如图6,共转染TCF21-WT与miR-92a-3p后相对荧光素酶强度较TCF21-WT与miR-NC降低(P<0.01),定点突变后,共转染TCF21-Mut与miR-92a-3p较TCF21-Mut与miR-NC相对荧光素酶活性差异无统计学意义,表明TCF21能够靶向结合miR-92a-3p。
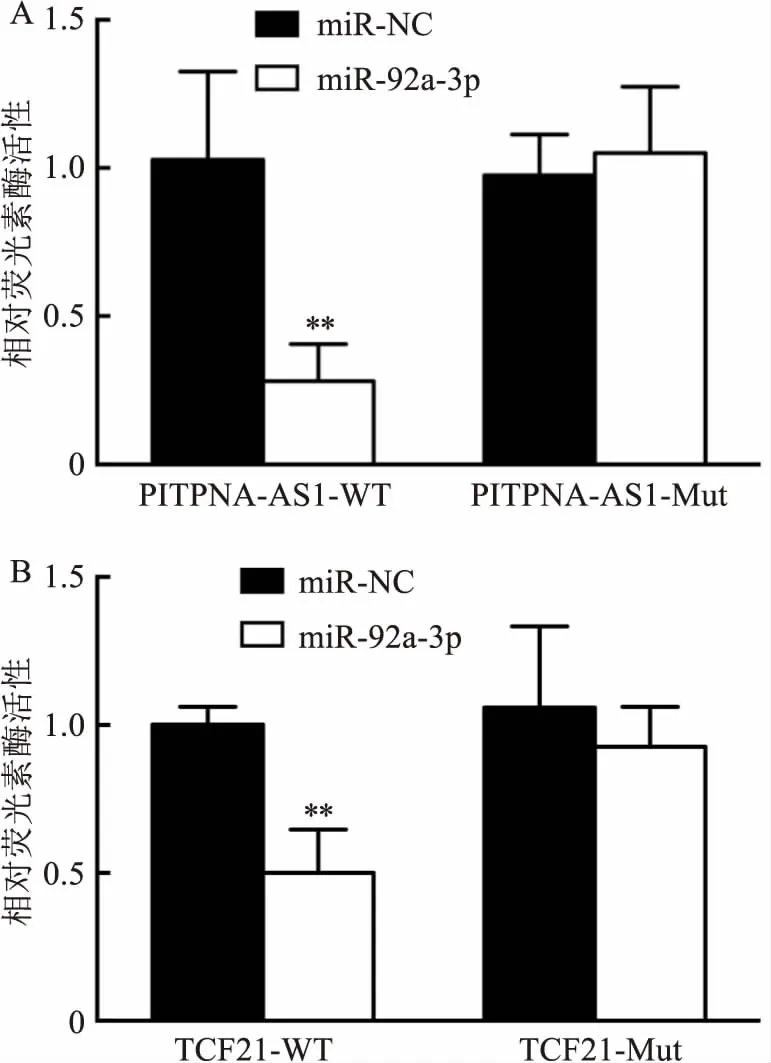
图6 双荧光素酶报告基因实验验证PITPNA-AS1作用的分子机制A:PITPNA-AS1与miR-92a-3p的靶向关系验证;B:miR-92a-3p与TCF21的靶向关系验证;与miR-NC比较:**P<0.01
2.7 过表达PITPNA-AS1的OVCAR-3细胞中miR-92a-3p和TCF21 mRNA的表达情况本研究显示,对照组OVCAR-3细胞中miR-92a-3p相对表达(1.02±0.10)高于实验组相对表达(0.35±0.09),差异有统计学意义(P<0.01);对照组OVCAR-3细胞中TCF21 mRNA相对表达(1.09±0.24)低于实验组相对表达(6.79±1.31),差异有统计学意义(P<0.01),表明过表达PITPNA-AS1能下调miR-92a-3p的表达,增加TCF21 mRNA的表达。
2.8 过表达PITPNA-AS1的OVCAR-3细胞中TCF21蛋白的表达该研究采用Western blot检测结果显示(图7),过表达PITPNA-AS1后,TCF21蛋白表达增加,细胞增殖相关蛋白CDK6、Cyclin D2表达降低,细胞侵袭相关Zeb2、Snail表达降低,间接表明卵巢癌细胞的增殖和侵袭被抑制。

图7 过表达PITPNA-AS1对OVCAR-3细胞TCF21蛋白表达的影响与对照组比较:**P<0.01
3 讨论
lncRNA在细胞中广泛存在,参与调控各种信号通路,lncRNA的异常表达与心血管疾病、自身免疫病、肿瘤等多种疾病的发生有关[8]。TPT1-AS1[3]、FAM83H-AS1[5]、KCNQ1OT1[8]等lncRNA已被研究证实可影响卵巢癌细胞的增殖、迁移、凋亡、侵袭等生物学行为,在卵巢癌的发生、发展中起到重要作用。Ren et al[7]研究发现,PITPNA-AS1在非小细胞肺癌组织和细胞系中高表达,沉默PITPNA-AS1可抑制非小细胞肺癌细胞的增殖和转移能力,并促进细胞凋亡。同一个lncRNA在不同的肿瘤中可发挥不同的作用,既可表现为癌基因作用,也可表现为抑癌基因作用[9]。PITPNA-AS1在卵巢癌中的表达和功能尚不明确。该研究结果表明,与癌旁组织和正常卵巢上皮细胞系比较,PITPNA-AS1在卵巢癌组织和细胞系中的表达降低,提示PITPNA-AS1可能参与卵巢癌的发生和发展。该研究通过CCK-8、Transwell实验证实,PITPNA-AS1对卵巢癌OVCAR-3细胞增殖和侵袭具有抑制作用,提示PITPNA-AS1在卵巢癌中表现为抑癌基因作用。
微小RNA(miRNA)是一类长度约为18~24个核苷酸的小分子单链RNA,可在转录后水平特异性结合靶基因信使RNA(mRNA)的3′非翻译区,诱导靶基因mRNA降解或者直接抑制其翻译[10]。lncRNA可通过竞争性结合miRNA促进靶基因mRNA的表达,lncRNA-miRNA-靶基因mRNA是lncRNA发挥功能的重要机制[9]。该研究采用starBase v2.0网站预测显示,PITPNA-AS1可能互补结合miR-92a-3p。miR-92a-3p是miRNA家族一员。Li et al[11]研究发现,miR-92a-3p在食管鳞状细胞癌组织和细胞系中高表达,miR-92a-3p可促进食管鳞状细胞癌细胞的增殖、迁移和侵袭,抑制其凋亡,miR-92a-3p表现为癌基因作用。与正常组织相比,miR-92a-3p在卵巢癌组织中的表达较高[12]。双荧光素酶报告基因实验显示PITPNA-AS1可互补结合miR-92a-3p。过表达PITPNA-AS1后,miR-92a-3p表达降低,提示PITPNA-AS1可能在卵巢癌细胞中竞争性结合miR-92a-3p。
该研究采用DIANA-microT网站预测显示,miR-92a-3p可能互补结合TCF21 mRNA。TCF21基因定位于染色体6q23-q24,是一种新近发现的抑癌基因[13]。TCF21蛋白属于基本螺旋环螺旋转录因子家族,研究表明TCF21在卵巢癌、胃癌、肺癌、乳腺癌等肿瘤中低表达,过表达TCF21可抑制肿瘤细胞的增殖和转移[14-15]。该研究双荧光素酶报告基因实验显示miR-92a-3p可互补结合TCF21 mRNA。miR-92a-3p表达下调后,TCF21基因的表达增加,提示miR-92a-3p在卵巢癌细胞中的靶基因是TCF21。TCF21蛋白表达增加后,细胞增殖相关蛋白CDK6、Cyclin D2表达降低,细胞侵袭相关Zeb2、Snail表达降低,间接提示卵巢癌细胞的增殖和侵袭被抑制。
综上所述,PITPNA-AS1在卵巢癌组织及细胞系中低表达,上调PITPNA-AS1通过竞争性结合miR-92a-3p,增加TCF21基因的表达,从而抑制卵巢癌OVCAR-3细胞的增殖活性和侵袭能力,PITPNA-AS1可能是卵巢癌潜在的诊疗靶标。
