慢病毒介导沉默NIPBL基因对小鼠骨髓间充质干细胞成骨分化能力的影响
2022-02-22姜德坤张惠荣潘金勇马雯晴董丽丽
姜德坤,张惠荣,潘金勇,马雯晴,刘 辉,董丽丽
德朗热综合征(Cornelia de Lange syndrome,CdLS)是一种以生长发育迟缓、严重认知障碍、特征性面容、肢体发育畸形为特点的遗传性疾病[1]。NIPBL基因为主要致病基因[2],其表达水平越低则病情越严重,在CdLS诊断中首要检测指标是确定NIPBL基因是否突变[3]。研究[4]表明其肢体发育畸形发生率高达73.1%。前期研究[5]表明NIPBL基因低表达会抑制shh、Wnt5a基因及其蛋白的表达,从而影响Wnt信号通路相关分子的表达。推测NIPBL基因可能通过Wnt信号通路调控骨髓间充质干细胞的成骨分化,但其具体机制尚未见报道。该研究用慢病毒转染小鼠骨髓间充质干细胞沉默NIPBL基因,探究成骨相关基因骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2)、骨钙素(osteocalcin,OCN)、Runt相关转录因子2(runt-related transcription factor 2,RUNX-2)的表达,以揭示NIPBL基因对骨髓间充质干细胞成骨分化相关基因表达的影响。
1 材料与方法
1.1 实验对象原代小鼠骨髓间充质干细胞购于武汉普诺赛生命科技有限公司。
1.2 试剂与仪器DMEM/F-12培养基(美国gibco公司);胎牛血清(美国Hyclone公司);反转录试剂盒、荧光定量PCR试剂盒(美国Thermo公司);CCK-8试剂盒(上海东仁化学科技有限公司);碱性磷酸酶试剂盒(美国Cyagen公司);RUNX2抗体、BMP2抗体、Osteocalcin抗体(英国Abcam公司);β-actin抗体、辣根过氧化物酶标记的二抗(武汉博士德生物工程有限公司);慢病毒(上海吉玛基因公司);倒置相差荧光显微镜(日本Nicon公司)。
1.3 实验方法
1.3.1NIPBL基因慢病毒载体构建 针对NIPBL目标基因序列,设计3条NIPBL-siRNA,分别为siRNA1:5′-GCAGATGCCTGTCTTACAACT-3′; siRNA2: 5′-GCATCCGAGTCTAATGTTTGA-3′;siRNA3:5′-GC AGGATACATGCCATATTCC-3′。阴性对照序列为:5′-TTCTCCGAACGTGTCACGT-3′。慢病毒载体的构建由上海吉玛基因股份有限公司完成。
1.3.2慢病毒转染预实验 接种细胞于96孔培养板中培养,设置感染复数(multiplicity of infection,MOI)为10、30、60、100。转染后72 h在相差荧光显微镜下观察结果(图1)。转染效率的测定:在200倍视野下均匀测定10个视野的细胞总数和带荧光细胞数,细胞转染效率=10个视野内带荧光细胞总数/细胞总数。当MOI=60时,细胞转染效率达94%,设为最适感染复数。

图1 不同MOI转染结果(倒置相差荧光显微镜 ×100)A:MOI=10;B:MOI=30;C:MOI=60;D:MOI=100
1.3.3慢病毒转染 该实验分为5组:① siRNA1组:用携带NIPBL-siRNA1的慢病毒载体转染细胞;② siRNA2组:用携带NIPBL-siRNA2的慢病毒载体转染细胞;③ siRNA3组:用携带NIPBL-siRNA3的慢病毒载体转染细胞;④ 阴性对照组:用携带阴性对照的慢病毒载体转染细胞;⑤ 空白对照组:不添加慢病毒载体,其他操作步骤与前各组相同。设置MOI=60,转染72 h后观察结果。提取各组细胞RNA,通过qRT-PCR检测转染后NIPBL基因的mRNA表达量,NIPBL、BMP-2、OCN、RUNX-2和内参基因β-actin引物由生工生物工程(上海)有限公司设计与合成,引物序列见表1。PCR反应体系(20 μl):cDNA 2 μl、上下游引物各1 μl、2×PowerUp SYBR Green Master Mix 10 μl、ddH2O 6 μl。反应条件:50 ℃、2 min,95 ℃、2 min;95 ℃、15 s,60 ℃、1 min,40个循环。采用2-ΔΔCt法计算NIPBL基因的mRNA相对表达量,确定各组的抑制效率,抑制效率=(空白组表达量-siRNA组表达量)/空白组表达量,选择抑制效率最高的siRNA进行后续实验。

表1 NIPBL、β-actin、 BMP-2、 OCN 、RUNX-2引物信息
1.3.4转染后细胞增殖能力检测 取三组细胞接种于96孔板中培养。在第1、3、5、7、9天的同一时间加入CCK-8试剂,放入培养箱中培养2 h后,用酶标仪检测450 nm波长吸光度值(optical density,OD),以时间为横坐标,OD值为纵坐标,绘制细胞的生长曲线。
1.3.5诱导成骨分化 取三组细胞于6孔板中培养。当细胞融合度达到70%时,更换培养基为成骨诱导分化完全培养基(含基础培养基175 ml、专用血清20 ml、双抗2 ml、地塞米松20 μl、抗坏血酸400 μl、β-甘油磷酸钠2 ml、谷氨酰胺2 ml),每隔3 d更换培养基。
1.3.6检测碱性磷酸酶活性 分别于成骨诱导的第5、7、10、14天收集细胞培上清液,按照说明书进行检测,使用酶标仪测定520 nm波长OD值。
1.3.7qRT-PCR检测BMP-2、OCN、RUNX-2基因的mRNA表达量 在成骨诱导的第7、14、21天,分别提取3组细胞的总RNA,反转录后,通过qRT-PCR检测BMP-2、OCN、RUNX-2基因的mRNA表达量。反应体系及条件同上文所述。采用2-ΔΔCt法计算BMP-2、OCN、RUNX-2基因的mRNA相对表达量。
1.3.8Western blot检测OCN、BMP-2、RUNX-2基因的蛋白表达水平 在成骨诱导的第7、14、21天,提取各组细胞总蛋白,BCA法检测蛋白浓度。加入5×buffer配平后煮沸变性进行电泳,转膜。使用双蒸水浸泡3 min、1×电转液浸泡12 min活化NC膜。室温摇床上封闭3 h,各自加入β-actin(1 ∶400)、Runx2(1 ∶2 000)、OCN(1 ∶2 000)、BMP2(1 ∶2 000)一抗,于4 ℃冰箱摇床孵育过夜。用TBST洗膜3次后,加入二抗(1 ∶20 000)室温摇床孵育2 h,用TBST洗膜3次后,加发光试剂(ECL)显色后扫描,使用ImageJ软件进行分析灰度值,目的蛋白表达量=目的蛋白灰度值/β-actin蛋白灰度值。
1.3.9茜素红染色分析 在成骨诱导21 d后,PBS冲洗2次,中性甲醛固定30 min,PBS冲洗2次,茜素红染液染色5 min,PBS冲洗3次,倒置相差显微镜下观察染色结果。再加入10%氯化十六烷基吡啶脱色30 min,每组取3个重复样本,使用酶标仪检测570 nm波长OD值。
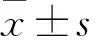
2 结果
2.1 慢病毒转染结果及抑制效率慢病毒转染后,siRNA1组、siRNA2组、siRNA3组和阴性对照组可见大量荧光,空白对照组无荧光(图2)。siRNA1组、siRNA2组、siRNA3组、阴性对照组、空白对照组NIPBL基因的mRNA相对表达量为(0.498±0.015)、(0.589±0.250)、(0.301±0.025)、(1.039±0.214)、(1.000±0.011),阴性对照组与空白对照组的NIPBL基因的mRNA表达量差异无统计学意义(P>0.05),siRNA1组、siRNA2组、siRNA3组的抑制效率分别为51%、42%、70%。NIPBL-siRNA3抑制效率最佳,用其进行后续实验。

图2 倒置相差荧光显微镜下各组慢病毒转染结果 ×100A:siRNA1组;B:siRNA2组;C:siRNA3组;D:阴性对照组;E:空白对照组
2.2 转染后细胞增殖能力比较实验组和阴性对照组及空白对照组在前5天差异无统计学意义,在第6天后,阴性对照组与空白对照组细胞增殖能力提高,实验组增殖能力增加缓慢,阴性对照组与空白对照组差异无统计学意义。见图3。
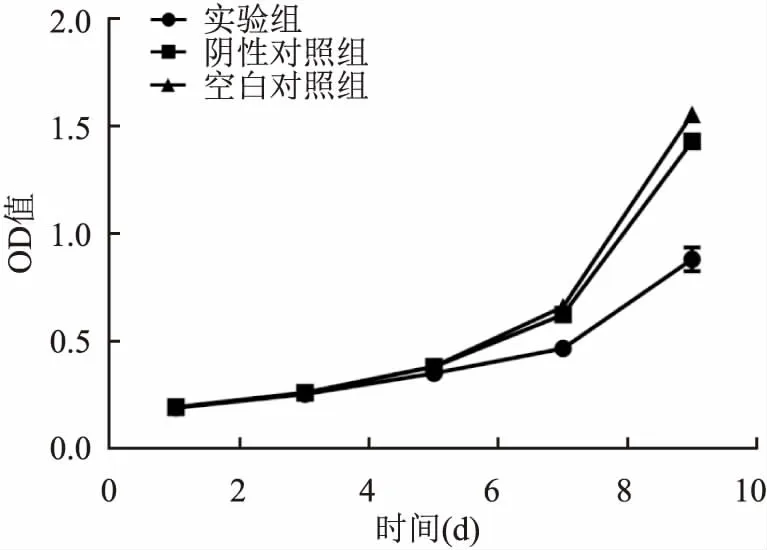
图3 各组细胞的生长曲线
2.3 碱性磷酸酶活性比较随着时间增加,各组细胞碱性磷酸酶活性均增加,实验组碱性磷酸酶活性在第5天时与阴性对照组和空白对照组无差异,在6 d后各时间点较阴性对照组和空白对照组低,差异有统计学意义(P<0.05)。阴性对照组与空白对照组之间,差异无统计学意义。见图4。

图4 各组细胞的碱性磷酸酶活性与阴性对照组比较:*P<0.05;与空白对照比较:#P<0.05
2.4BMP-2、OCN、RUNX-2基因的mRNA表达量实验组BMP-2、OCN、RUNX-2基因的mRNA表达量在第7、14及21天均低于阴性对照组和空白对照组,且差异有统计学意义(P<0.05)。阴性对照组和空白对照组在各时间点表达量无差异。见图5。

图5 BMP-2、OCN、RUNX-2基因的mRNA表达量A: BMP-2基因; B:OCN基因;C:RUNX-2基因
2.5OCN、BMP-2、RUNX-2基因的蛋白表达水平实验组BMP-2、OCN、RUNX-2基因的蛋白表达量在第7、14及21天均低于阴性对照组和空白对照组,差异有统计学意义(P<0.05),阴性对照组和空白组在各时间点,蛋白表达量差异无统计学意义。OCN基因的蛋白表达量在第7、14天无变化,第21天时表达量增加。BMP-2、RUNX-2基因的蛋白表达量均随时间增加而增加,在第21天表达量最多。见图6。

图6 各组中OCN、BMP-2、RUNX-2基因的蛋白表达水平A:第7天;B:第14天;C:第21天;
2.6 茜素红染色结果成骨诱导分化的第21天,按照说明书进行茜红素染色后观察结果,实验组钙结节低于阴性对照组和空白对照组(P<0.05),阴性对照组和空白对照组差异无统计学意义。见图7。

图7 倒置相差显微镜下茜素红染色结果 ×400A:实验组;B:阴性对照组;C:空白对照组
3 讨论
CdLS作为一种遗传异质性疾病,具有广泛的表型变异性,从轻度到重度具有不同程度的面部、肢体畸形。CdLS发病主要与粘蛋白复合体相关的基因突变有关,其中以NIPBL基因突变为主,且有研究[6]表明NIPBL基因突变所致CdLS患者有更严重的面部、肢体骨骼发育畸形。有研究[7]表明在S期、G1期和G2期,NIPBL基因参与调控将黏蛋白复合物加载到染色质上的过程。因此NIPBL基因突变引起基因表达调节的异常从而导致CdLS的发生,目前公认为NIPBL基因是CdLS的最重要的致病基因,但是其具体分子机制尚不明确,因此研究NIPBL基因对成骨分化的调控机制具有重要意义。
慢病毒载体可以将外源基因有效的整合到宿主染色体上,从而达到持久性的表达[8]。因此,该实验采取慢病毒载体将目的基因转染到小鼠骨髓间充质干细胞。该实验通过慢病毒转染抑制NIPBL基因表达,抑制效率达70%。通过CCK-8法检测转染后细胞增殖能力:空白对照组和阴性对照组的细胞增长曲线没有明显差异,实验组细胞增殖能力降低。PCR检测转染后NIPBL基因表达情况:空白对照组与阴性对照组无明显差异,实验组表达量约为空白对照组的30%。以上实验结果说明慢病毒载体不会影响细胞生长,且能使目的基因有效表达。
碱性磷酸酶是早期反映细胞成骨分化水平的重要标志物[9]。该实验在成骨诱导过程中,碱性磷酸酶活性随着时间而逐渐增加,在第5天后,实验组碱性磷酸酶活性明显低于阴性对照组和空白对照组。RUNX-2是成骨诱导分化过程中关键的一个转录因子,是骨形成的过程中较早和具有明显特征性的标志物之一[10]。OCN是成骨分化的特异性基因,形成骨基质中的主要非胶原成分,调节控制矿物质形成的方向和速度[11]。BMP-2是一种酸性糖蛋白,在调控骨形成发育中起着重要作用[12]。该实验结果显示:在成骨诱导的第7、14、21天,实验组BMP-2、OCN、RUNX-2的mRNA和蛋白表达量均低于阴性对照组和空白对照组,说明通过慢病毒转染沉默NIPBL基因后,成骨相关基因的表达受到抑制。茜素红染色结果反映成骨分化晚期的钙盐沉积情况,该实验显示在成骨诱导21天后实验组、阴性对照组和空白对照组均出现钙盐沉积,但实验组明显少于空白对照组和阴性对照组。有研究[13]表明ALP、RUNX-2可反映早期的成骨状态,BMP-2、OCN可以反映晚期的成骨状态。该实验结果明确转染后实验组ALP、RUNX-2、BMP-2、OCN的表达均下降,表明NIPBL基因在调控成骨分化过程中发挥一定作用。
课题组前期研究[5]表明敲除NIPBL基因后Wnt5a基因的表达水平受到抑制,Wnt5a是Wnt信号通路的一个重要因子,且能与ROR蛋白结合,以调节成骨和软骨的形成,从而调控肢体发育形态。Wnt/β-catenin信号通路在成骨过程中发挥作用,而OCN、RUNX-2是该信号通路的靶基因[14]。该研究显示,用慢病毒沉默NIPBL基因后,小鼠骨髓间充质干细胞的增殖能力和成骨分化能力会减弱,其机制可能是通过Wnt/β-catenin信号通路调控成骨的过程。由此推测CdLS患者的骨骼发育异常可能与Wnt信号通路的下调有关,其具体调控机制仍待进一步研究。
