6-姜酚通过调节Wnt/β-catenin信号通路对Aβ诱导的AD大鼠细胞凋亡、氧化应激和神经炎症的影响
2022-02-22肖友元马天蓉李剑萍
李 交,肖友元,谢 沁,马天蓉,李剑萍,段 俊,苏 懋
阿尔茨海默病(Alzheimer′s disease, AD)是世界范围内导致痴呆的最常见原因,部分原因是世界人口老龄化。这种神经退行性疾病有两个典型的临床特征:记忆丧失和认知障碍。AD的主要病理特征是淀粉样蛋白斑块沉积和过度磷酸化的tau蛋白神经原纤维缠结、细胞凋亡、自噬功能障碍、神经炎症、氧化应激和线粒体功能障碍[1]。尽管AD带来了重大的公共健康问题,但目前仅有5种药物被批准用于治疗AD,而这些药物的作用是控制症状、延缓痴呆症的发作,从而减慢病程加剧的速率[2]。研究[3]表明Wnt/β-catenin信号通路的持续缺失是AD发生和进展的基础,该信号通路参与淀粉样前体蛋白(amyloid precursor protein,APP)处理、肽类神经毒性、磷酸化和脑内载脂蛋白E功能调节。6-姜酚[(5S)-5-羟基-1-(4-羟基-3-甲氧基苯基)癸烷-3-酮]是生姜的主要药理活性成分[4]。与6-姜烯酚、8-姜酚和10-姜酚(生姜中的其他三种植物化学物质)相比,6-姜酚被报道具有广泛的生物化学和药理作用,包括抗菌、抗炎、抗氧化和抗肿瘤能力[4-6]。研究[7]表明6-姜酚能够减轻乏氧/复氧诱导的H9C2心肌细胞损伤,其机制与抑制氧化应激和炎症反应有关。6-姜酚通过激活Wnt/β-catenin信号通路抑制3T3-L1细胞的成脂分化[8]。该实验旨在研究6-姜酚通过调节Wnt/β-catenin信号通路对β-淀粉样蛋白(amyloid β-protein,Aβ)诱导的AD大鼠细胞凋亡、氧化应激和神经炎症的影响。
1 材料与方法
1.1 分组及阿尔茨海默病大鼠模型建立大鼠随机均分为6组:对照组、模型组、低剂量6-姜酚组、中剂量6-姜酚组、高剂量6-姜酚组和阳性对照组。将所有大鼠腹腔注射氯胺酮和二甲苯(按体质量分别为80 mg/kg和20 mg/kg)进行麻醉,除对照组外,其余各组注射Aβ1-421.0 μl构建阿尔茨海默病大鼠模型。方法[9]:制备合成低聚Aβ1-42溶液, Aβ1-42在PBS溶液溶解,使用前在37 ℃孵化72 h,孵化72 h后使用1 μl汉密尔顿注射器从大鼠双侧大脑的海马体中,以0.1 μl/min速度注射Aβ1-421.0 μl。模型建立第15天时,低、中、高剂量6-姜酚组灌胃6-姜酚50、75、100 mg/kg,阳性对照组灌胃盐酸多尼哌齐0.9 mg/kg,对照组和模型组灌胃相同体积的0.9%氯化钠溶液,均每日1次,连续21 d。
1.2 神经损伤评分神经损伤在各组大鼠制模15 d后进行评分,具体参考Longa神经评分法[10]。0分:正常,无神经损伤;1分:左侧前爪不能完全伸展,轻度神经损伤;2分:行走时,大鼠向瘫痪侧转圈,中度神经功能缺损;3分:行走时,大鼠身体向瘫痪侧倾倒,重度神经功能缺损;4分:不能自发行走,有意识丧失。
1.3 脑含水量的检测脑组织含水量的测定[11](干湿重法测定):取小鼠脑组织约100 mg,称重(湿脑重量),将脑组织置于110 ℃的烤箱中烘烤24 h以上至恒重后,称取干脑重量。计算公式:脑组织含水量=(湿重-干重)/湿重×100%。
1.4 HE染色HE染色,采集大鼠海马体,用苏木精-伊红染色,并在显微镜下进行观察。
1.5 TUNEL染色采集大鼠海马体,用切片机将不同组的石蜡包埋的组织切成薄片(厚度为3 μm)。常规对组织进行脱蜡,并加入50 μl 3%过氧化氢溶液。随后将切片在20 ℃下孵育10 min,并用磷酸盐缓冲盐水(PBS)冲洗3次。将切片在50 μl TUNEL中于37 ℃孵育60 min。然后,在加入50 μl过氧化物酶(POD)在37 ℃下再次孵育30 min,并用PBS冲洗3次。将Dolichosbiflorusagglutinin(DBA)试剂盒中的试剂A、B和C各1滴加入1 ml蒸馏水中混匀,再滴加至切片显色10 min。之后,将切片用PBS洗涤3次,用苏木精复染10 s。用显微镜观察和计数凋亡细胞(颜色为黄棕色)。图像是用OLYMPUS DX51荧光显微镜(日本奥林巴斯公司)拍摄的。在每个组织切片中评估心肌细胞区域的积分选择密度(integrated option density,IOD)和面积,然后获得平均吸光度值(OD = IOD /面积)。选择了4个切片,每切片4个视野。
1.6 流式细胞术采用Annexin v-荧光素(AV)和碘化丙啶(PI)细胞凋亡检测试剂盒(Invitrogen公司,美国) 流式细胞术检测不同处理组细胞的凋亡率。简单地说用胰蛋白酶分解的细胞,在药物刺激后,用PBS洗涤后,10 L Annexin V-FITC和5 L PI在室温黑暗中孵育15 min。流式细胞术使用FACScan流式细胞仪(美国贝克曼库尔提公司)进行流式分析,数据使用FlowJo软件(美国Tree Star公司) 进行分析。
1.7 酶联免疫吸附法(ELISA)根据制造商的说明,直接测量海马体组织中的细胞因子(iNOS、IL-6和TNF-α)和氧化应激指标(SOD、GSH-Px和MDA)的表达量。用BIO-RAD酶标仪(美国Bio-Rad公司)测定吸光度值。使用ELISA试剂盒提供的细胞因子标准品建立测量的标准曲线。
1.8 提取总RNA、反转录和荧光定量使用TRIzol从海马体组织提取总RNA,提取的总RNA首先去除基因组中的 DNA,然后进行反转录,以上步骤根据产品说明书进行操作。荧光定量检测反应体系:5 μl的SYBR Premix,各0.5 μl的上游引物和下游引物,3 μl的 RNase Free dH2O,1 μl的cDNA。程序:95 ℃预变性2 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s共40个循环。扩增完成后进行熔解曲线分析:95 ℃维持10 s,65 ℃处理1 s,此后从65 ℃开始,每一个循环温度增加0.5 ℃,时间为1 s。
1.9 Western blot实验海马体加入液氮研磨,并用裂解缓冲液裂解在4 ℃并以14 000 r/min离心15 min,形成浓缩蛋白质。然后测量蛋白质浓度。取20 μg总蛋白在12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)并转移至聚偏二氟乙烯(PVDF)膜。将膜在37 ℃下用1 h封闭5%的牛血清白蛋白,然后与抗Wnt和β-catenin在4 ℃过夜。用TBST缓冲液(含Tween-20的Tris缓冲盐水)清洗,加入辣根过氧化物酶标记的山羊抗兔IgG(二抗)37 ℃反应1 h;洗膜后ECL曝光成像并应用Quantity one软件分析蛋白条带的灰度值。
2 结果
2.1 6-姜酚对Aβ诱导的AD大鼠神经损伤和脑含水量的影响神经损伤评分检测结果表明,模型组大鼠神经损伤程度在(3.08±0.46)分。而中剂量和高剂量组大鼠神经损伤程度降低(P<0.05),且阳性对照组鼠神经损伤程度降低(P<0.01)。脑含水量的检测结果表明,模型组大鼠脑含水量在(89.76±6.33)%。中剂量和高剂量6-姜酚组大鼠脑含水量减少(P<0.05),且阳性对照组大鼠脑含水量减少(P<0.01)。见表1。
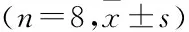
表1 神经损伤及脑含水量测定
2.2 6-姜酚对Aβ诱导的AD大鼠海马体病理损伤的影响HE染色结果表明,模型组AD大鼠海马体椎体细胞神经元萎缩,细胞空泡化,细胞疏松。而中剂量和高剂量6-姜酚组或阳性对照组治疗后Aβ诱导的AD大鼠,上述情况明显好转。见图1。

图1 海马体病理切片HE染色 ×400A:对照组;B:模型组;C:低剂量6-姜酚组;D:中剂量6-姜酚组;E:高剂量6-姜酚组;F:阳性对照组
2.3 6-姜酚对Aβ诱导的AD大鼠海马体细胞凋亡的影响流式细胞术和TUNEL染色检测结果表明,模型组AD大鼠细胞凋亡升高(P<0.01),而中剂量和高剂量6-姜酚组AD大鼠细胞凋亡降低(P<0.05),且阳性对照组AD大鼠细胞凋亡降低(P<0.01)。流式细胞检测细胞凋亡各组比较F=155.649,P<0.01;TUNEL染色检测细胞凋亡各组比较F=80.754,P<0.01。见图2。
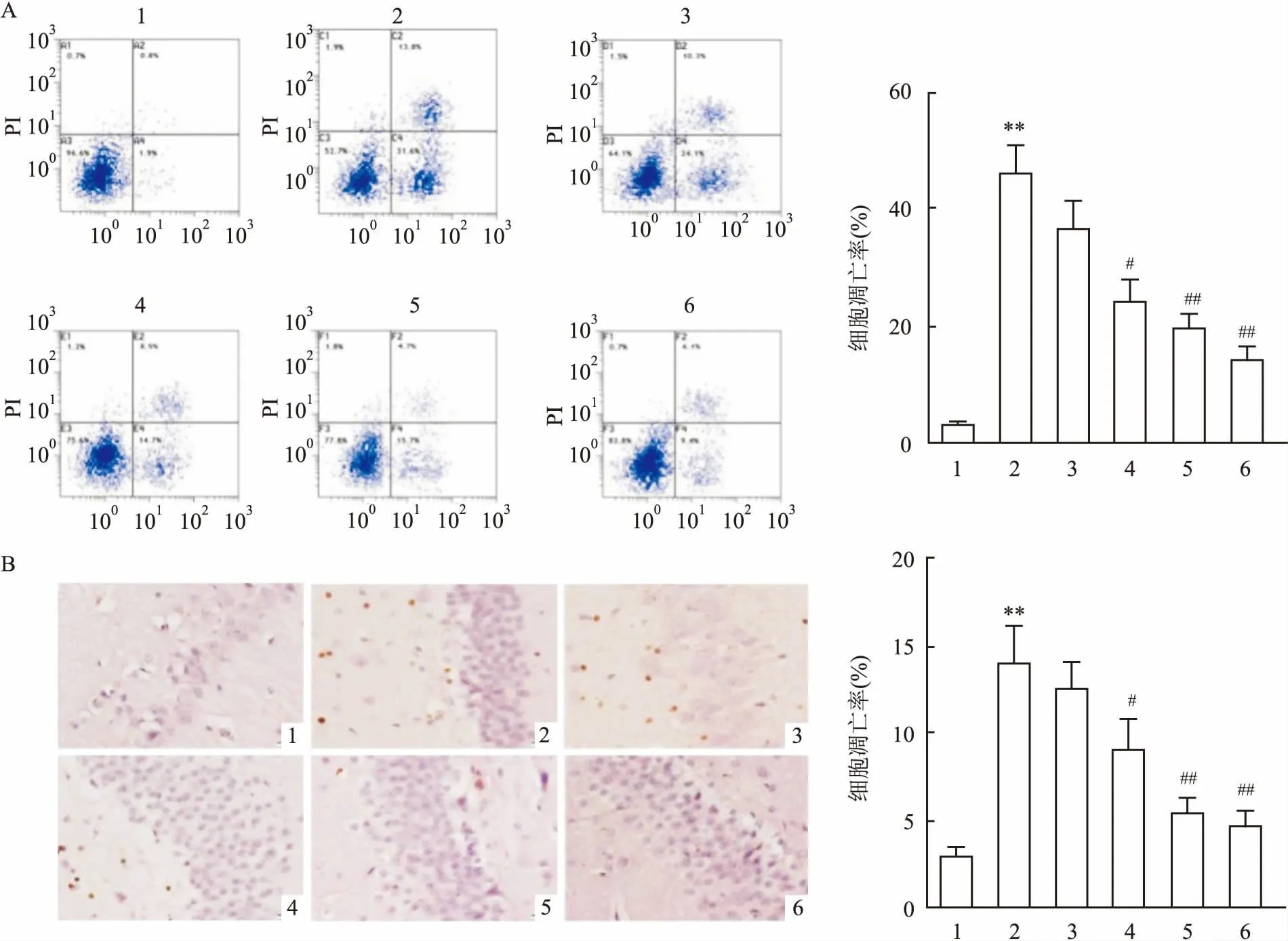
图2 6-姜酚对Aβ诱导的AD大鼠海马体细胞凋亡的影响A:流式细胞检测细胞调亡率;B:TUNEL染色细胞调亡率; 1:对照组;2:模型组;3:低剂量6-姜酚组;4:中剂量6-姜酚组;5:高剂量6-姜酚组;6:阳性对照组;与对照组比较:*P<0.05,**P<0.01;与AD大鼠模型组比较:##P<0.01
2.4 6-姜酚对Aβ诱导的AD大鼠海马体促炎细胞因子的影响ELISA检测结果表明,模型组AD大鼠海马体中促炎因子iNOS、IL-6和TNF-α的表达量均上调(P<0.01),而G与模型组比较中剂量和高剂量6-姜酚组AD大鼠海马体中促炎因子iNOS,IL-6和TNF-α的表达量均下调(P<0.05),且阳性对照组AD大鼠海马体中促炎因子iNOS、IL-6和TNF-α的表达量均下调(P<0.01)。见表2。

表2 促炎因子iNOS,IL-6和TNF-α表达量的测定
2.5 6-姜酚对Aβ诱导的AD大鼠海马体氧化应激的影响ELISA检测结果表明,模型组AD大鼠海马体中氧化应激标志物SOD和GSH-Px的表达量均下调(P<0.01),氧化应激标记物MDA的表达量上调(P<0.01)。而与模型组比较中剂量和高剂量6-姜酚组AD大鼠SOD和GSH-Px的表达量均上调(P<0.05),MDA的表达量下调(P<0.05)。且阳性对照组AD大鼠SOD和GSH-Px的表达量均上调(P<0.01),MDA的表达量下调(P<0.01)。见表3。
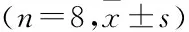
表3 氧化应激标志物SOD、GSH-Px和MDA表达量的测定
2.6 6-姜酚对Aβ诱导的AD大鼠Wnt/β-catenin信号通路的影响qRT-PCR和Western blot检测结果表明,模型组AD大鼠Wnt和β-catenin的mRNA和蛋白相对表达量均下调(P<0.01),而与模型组比较中剂量和高剂量6-姜酚组AD大鼠Wnt和β-catenin的mRNA和蛋白相对表达量均上调(P<0.05),且阳性对照组AD大鼠Wnt和β-catenin的mRNA和蛋白相对表达量均上调(P<0.01)。qRT-PCR检测Wntm RNA相对表达量(F=215.364,P<0.001);qRT-PCR检测β-cateninm RNA相对表达量(F=286.140,P<0.001);Western blot检测Wnt蛋白相对表达量(F=23.304,P<0.01);Western blot检测β-catenin蛋白相对表达量(F=36.703,P<0.01)。见图3。
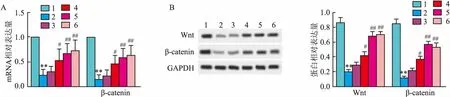
图3 6-姜酚对Aβ诱导的AD大鼠Wnt/β-catenin信号通路的影响A:qRT-PCR检测Wnt和β-catenin的mRNA相对表达量;B:Western blot检测Wnt和β-catenin的蛋白相对表达量;1:对照组;2:模型组;3:低剂量6-姜酚组;4:中剂量6-姜酚组;5:高剂量6-姜酚组;6:阳性对照组;与对照组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01
3 讨论
AD是一种神经退行性疾病,会导致记忆、判断和推理等精神和认知过程的逐渐衰退[12]。6-姜酚通过下调丝氨酸-苏氨酸蛋白激酶(Akt)/雷帕霉素哺乳动物靶标(mTOR)/信号转导子和转录激活子3(STAT3)通路,抑制小胶质细胞介导的神经炎症,从而改善脑缺血损伤[13]。该实验中在6-姜酚治疗后Aβ诱导的AD大鼠后,大鼠神经损伤程度显著下调,脑含水量显著下调。结果表明6-姜酚对脑组织有保护作用。
AD的病理表现为细胞凋亡、神经炎症和氧化应激。氧化应激是AD发病机制中的一个重要因素,对淀粉样蛋白的生成具有重要作用。AD与血脑屏障的通透性增加有关。氧化应激降低了低密度脂蛋白受体相关蛋白1的表达,上调了血脑屏障中晚期糖基化终末产物受体的表达,增加了血脑屏障的通透性,这可能会导致蛋白在AD脑内的沉积增多。凋亡发生在AD的发病过程中,氧化应激通过外在途径和内在途径促进细胞凋亡。氧化应激诱导的细胞凋亡可能是导致细胞凋亡的潜在因素[14]。研究[7]表明,6-姜酚能够减轻乏氧/复氧诱导的H9C2心肌细胞损伤,其机制与抑制氧化应激和炎症反应有关。以上文献表明,改善AD细胞调亡,氧化应激和神经炎症有助于缓解AD造成的神经损伤。在该实验中,6-姜酚治疗后,细胞凋亡率降低,促炎细胞因子iNOS、IL-6和TNF-α的表达量下调,SOD和GSH-Px的蛋白含量上调,而MDA蛋白含量下调。结果表明6-姜酚能缓解Aβ诱导的AD大鼠细胞凋亡、氧化应激和神经炎症。
在AD中,典型Wnt/β-catenin信号通路下调,而过氧化物酶体增殖激活受体上调。Wnt/β-catenin的下调,是通过淀粉样蛋白β激活糖原合酶激酶3β以及磷脂酰肌醇3激酶/ 丝氨酸-苏氨酸蛋白激酶信号失活而引起的[15]。研究[8]表明,6-姜酚通过激活Wnt/β-catenin信号通路抑制3T3-L1细胞的成脂分化。该实验中6-姜酚治疗后Wnt和β-catenin的mRNA和蛋白相对表达量均显著上调。这些结果表明6-姜酚能通过调节Wnt/β-catenin信号通路缓解Aβ诱导的AD损伤。
综上所述,该研究表明6-姜酚能通过调节Wnt/β-catenin信号通路缓解Aβ诱导的AD大鼠细胞凋亡、氧化应激和神经炎症。该研究仅为体内实验初步探讨6-姜酚具有缓解AD的治疗效果,为进一步研究6-姜酚药理学功能提供参考。
