氢化可的松联合维生素C、维生素B1治疗脓毒症疗效的Meta分析
2022-02-22王建张炎程璐鲁俊周江
王建,张炎,程璐,鲁俊,周江
本研究价值:
氢化可的松联合维生素C、维生素B1(HAT)理论上可改善脓毒症患者病理生理异常状态,并有回顾性研究表明其能明显降低脓毒症患者病死率,但各前瞻性临床试验并未得到一致性的结论。本研究通过收集HAT治疗脓毒症相关的随机对照试验(RCT)进行Meta分析,以进一步寻求循证医学证据。结果显示,HAT无法降低脓毒症患者病死率,而亚组分析发现HAT或可降低未合并休克的脓毒症患者的病死率,但所纳入的研究数量偏小,且研究中的样本量偏少,还需要大样本量的临床试验进一步证实该结论。
脓毒症是宿主对感染反应失调引起的危及生命的多器官功能障碍[1]。流行病学研究表明,我国ICU中脓毒症发病率约为20.6%,90 d病死率高达35.5%[2]。即使根据《拯救脓毒症运动》指南严格规范脓毒症的治疗,脓毒症患者的院内病死率仍高达23.7%[3]。因此,进一步探索脓毒症的有效治疗策略、降低脓毒症病死率迫在眉睫。MARIK等[4]回顾性研究发现,氢化可的松联合维生素C、维生素B1(hydrocortisone,ascorbic acid and thiamine,HAT)可明显降低脓毒症患者院内病死率,延缓器官功能障碍的发生,缩短血管活性药物使用时间。然而,HAT治疗脓毒症的疗效目前尚缺乏循证医学证据。本研究旨在采用Meta分析评价HAT治疗脓毒症的疗效,以期为临床医师应用HAT治疗脓毒症提供循证医学证据。本研究PROSPERO注册号:CRD42019137952。
1 资料与方法
1.1 文献纳入与排除标准
1.1.1 文献纳入标准 (1)研究类型为随机对照试验(randomized controlled trial,RCT)。(2)研究对象为脓毒症或脓毒性休克患者。符合2016年美国重症医学会(Society of Critical Care Medicine,SCCM)与欧洲重症医学会(European Society of Intensive Care Medicine,ESICM)联合发布的脓毒症3.0诊断标准[1]。(3)治疗方案:对照组采用脓毒症集束化基础治疗,包括液体复苏、抗感染、维持水电解质及酸碱平衡、器官功能维护、营养支持等;试验组在对照组基础上采用HAT治疗,具体用药剂量不限。(4)主要观察指标为院内病死率,次要观察指标为72 h序贯器官衰竭估计评分变化值(the change of sequential organ failure assessment score at 72 h,72 h ∆SOFA)、血管活性药物使用时间、急性肾损伤(acute kidney injury,AKI)发生率,并有用于计算相对危险度(relative risk,RR)或标准均数差(standard mean difference,SMD)及其95%可信区间(confidential interval,CI)的原始数据。
1.1.2 文献排除标准 (1)回顾性研究、队列研究、历史对照研究、病例报告等非RCT。(2)对照组采用HAT治疗。(3)动物实验、综述、摘要、述评等非临床研究。(4)研究对象年龄≤18岁。(5)非中英文语种文献。(6)重复发表文献。
1.2 文献检索策略 检索PubMed、Embase、Cochrane Library、Web of Science、中国知网、万方数据知识服务平台、中国生物医学文献服务系统及维普网自建库至2021-08-01发表的HAT治疗脓毒症的相关文献。中文检索主题词:维生素C、维生素B1、氢化可的松、代谢疗法、脓毒症、脓毒性休克;英文检索主题词:Vitamin C、Ascorbic Acid、Vitamin B1、Thiamine、Hydrocortisone、HAT Therapy、Sepsis、Septic Shock。采用主题词与自由词相结合的方式进行检索。
1.3 文献筛选、资料提取和文献质量评价 由2名研究者独立检索文题、摘要及全文,评估是否符合文献纳入标准,当存在分歧时,由第3名研究者加入探讨,达成共识,最后交由主要研究者进一步复筛。提取的资料包括第一作者、发表年份、样本量、疾病分类(脓毒症、脓毒性休克)、年龄、急性生理学和慢性健康状况评价Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)评分、乳酸、序贯器官衰竭估计(sequential organ failure assessment,SOFA)评分、观察指标。应用Cochrane偏倚风险评估工具[5]评价纳入文献的方法学质量,评估内容包括:(1)随机序列产生;(2)分配隐藏;(3)对受试者、试验人员实施盲法;(4)对结局评估员施盲;(5)结果数据不完整;(6)选择性报告研究结果;(7)其他偏倚来源。每项内容可判定为“低偏倚风险”“高偏倚风险”或“偏倚风险不清楚”。
1.4 统计学方法 应用RevMan 5.3软件评估纳入文献的偏倚风险,应用R 3.6.2软件Meta包进行Meta分析。计量资料以(±s)表示,计数资料以相对数表示;以RR及其95%CI作为二分类变量的效应值,以SMD及其95%CI作为连续性变量的效应值。采用固定效应模型进行Meta分析,如果各文献间存在统计学异质性(I2>50%或P<0.05),则采用随机效应模型进一步进行Meta分析,并根据疾病类型将患者分为脓毒症、脓毒症和脓毒性休克、脓毒性休克3类,进行亚组分析。应用漏斗图和Egger检验评估纳入文献的发表偏倚,存在发表偏倚时则进一步采用剪补法进行矫正。以P<0.05为差异有统计学意义。
2 结果
2.1 文献筛选结果 初检出相关文献233篇,剔重后获得文献225篇,通过阅读文题和摘要初筛剔除文献208篇,通过阅读全文复筛剔除文献7篇,最终纳入文献10篇[6-15],共包含1 611例患者,其中试验组805例、对照组806例。2篇文献[6,9]纳入研究对象为脓毒症患者,共178例(试验组88例,对照组90例);4篇文献[7,10,13,15]纳入研究对象为脓毒症和脓毒性休克患者,共774例(试验组388例,对照组386例);4篇文献[8,11-12,14]纳入研究对象为脓毒性休克患者,共659例(试验组329例,对照组330例)。文献筛选流程见图1,纳入文献的基本特征见表1。

表1 纳入文献的基本特征Table 1 Basic features of the involved literature

图1 文献筛选流程Figure 1 Literature screening flowchart
2.2 纳入文献的方法学质量评价 在随机序列产生方面,7篇文献[7,10-15]为低偏倚风险,2篇文献[6,9]为高偏倚风险,1篇文献[8]的偏倚风险不清楚;在分配隐藏方面,7篇文献[7,10-15]为低偏倚风险,2篇文献[6,9]为高偏倚风险,1篇文献[8]的偏倚风险不清楚;在对受试者、试验人员施盲及对结局评估员施盲、结果数据不完整、选择性报告研究结果、其他偏倚来源方面,10篇文献[6-15]均为低偏倚风险,见图2。

图2 纳入文献的Cochrane偏倚风险评估结果Figure 2 Cochrane bias risk assessment results of the involved literature
2.3 Meta分析结果
2.3.1 院内病死率 共10篇文献[6-15]报道了HAT治疗脓毒症患者的院内病死率〔总体病死率为37.68%(607/1 611)〕,各文献间无统计学异质性(I2=45%,P=0.06),故采用固定效应模型进行Meta分析,结果显示,试验组与对照组院内病死率比较,差异无统计学意义〔RR=1.03,95%CI(0.92,1.15),P=0.65〕,见图3。

图3 试验组与对照组院内病死率比较的森林图Figure 3 Forest map of comparison of in-hospital mortality between the experimental group and the control group
亚组分析:有2篇文献[6,9]的疾病类型为脓毒症,各文献间无统计学异质性(I2=0,P=0.91),故采用固定效应模型进行Meta分析,结果显示,试验组院内病死率低于对照组,差异有统计学意义〔RR=0.27,95%CI(0.12,0.63),P=0.01〕;有4篇文献[7,10,13,15]的疾病类型为脓毒症和脓毒性休克,各文献间无统计学异质性(I2=43%,P=0.15),故采用固定效应模型进行Meta分析,结果显示,试验组与对照组院内病死率比较,差异无统计学意义〔RR=1.02,95%CI(0.89,1.18),P=0.09〕;有4篇文献[8,11-12,14]的疾病类型为脓毒性休克,各文献间无统计学异质性(I2=0,P=0.85),故采用固定效应模型进行Meta分析,结果显示,试验组与对照组院内病死率比较,差异无统计学意义〔RR=1.12,95%CI(0.91,1.38),P=0.31〕,见图4。

图4 不同疾病类型患者试验组与对照组院内病死率比较的森林图Figure 4 Forest map of comparison of in-hospital mortality between the experimental group and the control group in patients with different types of diseases
2.3.2 72 h ∆SOFA 共8篇文献[6,9-15]报道了HAT治疗脓毒症患者的72 h ∆SOFA,各文献间存在统计学异质性(I2=94%,P<0.01),故采用随机效应模型进行Meta分析,结果显示,试验组72 h ∆SOFA高于对照组,差异有统计学意义〔SMD=0.58,95%CI(0.09,1.07),P=0.02〕,见图5。亚组分析:有2篇文献[6,9]的疾病类型为脓毒症,各文献间无统计学异质性(I2=44%,P=0.18),故采用固定效应模型进行Meta分析,结果显示,试验组72 h ∆SOFA高于对照组,差异有统计学意义〔SMD=0.95,95%CI(0.64,1.27),

图5 试验组与对照组72 h∆SOFA比较的森林图Figure 5 Forest map of comparison of 72 h∆SOFA between the experimental group and the control group
P=0.04〕;有3篇文献[10,13,15]的疾病类型为脓毒症和脓毒性休克,各文献间有统计学异质性(I2=67%,P=0.05),故采用随机效应模型进行Meta分析,结果显示,试验组与对照组72 h ∆SOFA比较,差异无统计学意义〔SMD=0.22,95%CI(-0.09,0.53),P=0.05〕;有3篇文献[11-12,14]的疾病类型为脓毒性休克,各文献间有统计学异质性(I2=98%,P<0.01),故采用随机效应模型进行Meta分析,结果显示,试验组与对照组72 h ∆SOFA比较,差异无统计学意义〔SMD=0.66,95%CI(-0.58,1.90),P=0.30〕,见图6。
2.3.3 血管活性药物使用时间 共4篇文献[6,8,10,13]报道了HAT治疗脓毒症患者的血管活性药物使用时间,各文献间无统计学异质性(I2=0,P=0.62),故采用固定效应模型进行Meta分析,结果显示,试验组血管活性药物使用时间短于对照组,差异有统计学意义〔SMD=-0.66,95%CI(-0.84,-0.47),P<0.000 1〕,见图7。
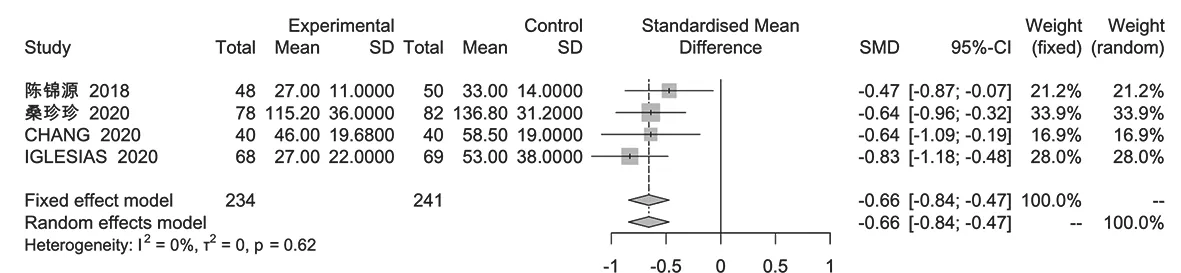
图7 试验组与对照组血管活性药物使用时间比较的森林图Figure 7 Forest map of comparison of the use time of vasoactive drugs between the experimental group and the control group
2.3.4 AKI发生率 共7篇文献[6,9-14]报道了HAT治疗脓毒症患者的AKI发生率,各文献间无统计学异质性(I2=50%,P=0.06),故采用固定效应模型进行Meta分析,结果显示,试验组与对照组AKI发生率比较,差异无统计学意义〔RR=1.04,95%CI(0.89,1.21),P=0.70〕,见图8。

图8 试验组与对照组AKI发生率比较的森林图Figure 8 Forest map of comparison of the incidence of AKI between the experimental group and the control group
亚组分析:有2篇文献[6,9]的疾病类型为脓毒症,各文献间无统计学异质性(I2=0,P=0.92),故采用固定效应模型进行Meta分析,结果显示,试验组AKI发生率低于对照组,差异有统计学意义〔RR=0.32,95%CI(0.15,0.66),P<0.01〕;有2篇文献[10,13]的疾病类型为脓毒症和脓毒性休克,各文献间无统计学异质性(I2=0,P=0.54),故采用固定效应模型进行Meta分析,结果显示,试验组与对照组AKI发生率比较,差异无统计学意义〔RR=1.05,95%CI(0.88,1.26),P=0.73〕;有3篇文献[11-12,14]的疾病类型为脓毒性休克,各文献间无统计学异质性(I2=0,P=0.88),故采用固定效应模型进行Meta分析,结果显示,试验组与对照组AKI发生率比较,差异无统计学意义〔RR=1.25,95%CI(0.91,1.71),P=0.16〕,见图9。

图9 不同疾病类型患者试验组与对照组AKI发生率比较的森林图Figure 9 Forest map of comparison of the incidence of AKI between the experimental group and the control group in patients with different types of diseases
2.4 发表偏倚评估 漏斗图分析结果显示,HAT治疗脓毒症患者的院内病死率文献的漏斗图分布不对称,见图10。Egger回归分析结果显示,HAT治疗脓毒症患者的院内病死率文献存在发表偏倚(P=0.02),进一步利用剪补法进行矫正(见图11),结果显示,试验组与对照组院内病死率比较,差异无统计学意义〔RR=1.07,95%CI(0.84,1.38),P=0.57〕,提示文献原结果具有真实性。
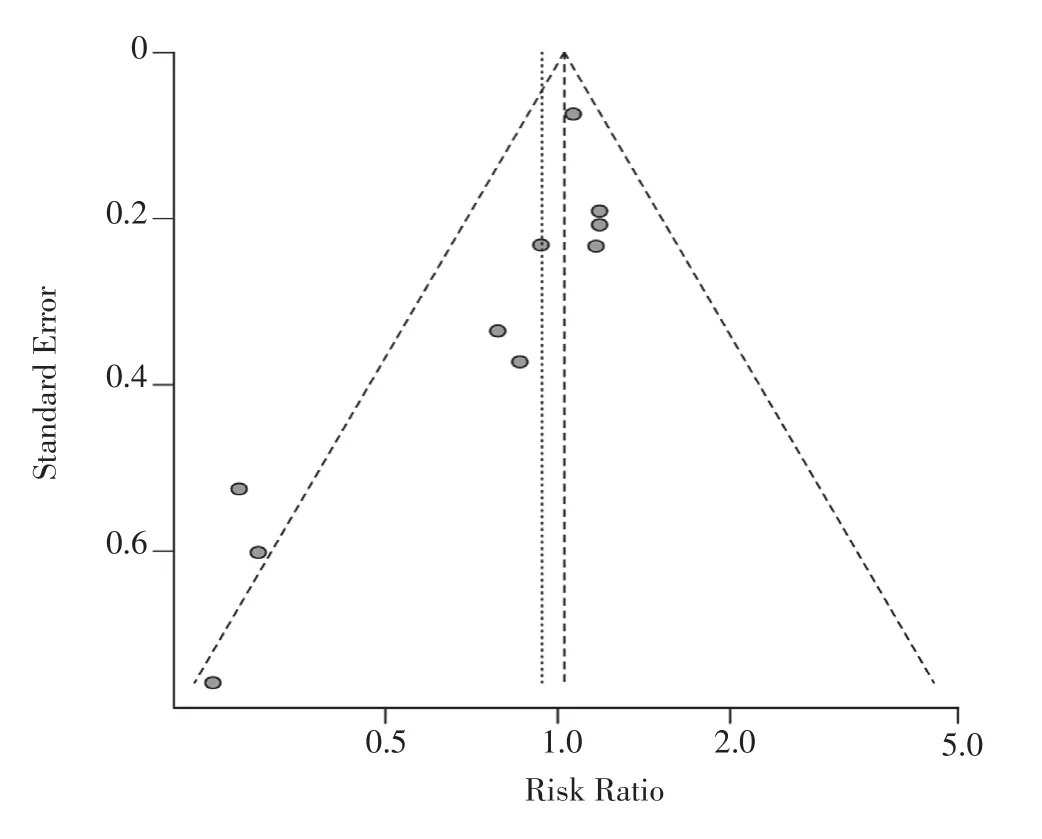
图10 HAT治疗脓毒症患者的院内病死率文献的漏斗图Figure 10 Funnel chart of the literature on in-hospital mortality in patients with sepsis treated with HAT

图11 剪补法矫正后的HAT治疗脓毒症患者的院内病死率文献的漏斗图Figure 11 Funnel chart of the literature on in-hospital mortality in patients with sepsis treated with HAT corrected by trim and filling method
3 讨论
脓毒症是由感染引起的生理、病理和生化异常综合征,其发病机制包括炎症反应失衡、免疫功能紊乱、凝血功能障碍、氧化应激、神经内分泌网络失衡等[14],故寻求脓毒症综合治疗手段是目前重症医学的研究重点。MARIK等[4]通过回顾性研究发现,HAT能有效预防进行性器官功能障碍,降低脓毒症患者死亡率。维生素C无法被人体合成,却为机体所必须,ICU患者的维生素C水平普遍低于参考范围下限值的25%[17]。作为电子供体,维生素C可直接清除由脂多糖刺激微血管内皮细胞而产生的氧自由基,并通过抑制还原型烟酰胺腺嘌呤二核苷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidases,NOX)活性而减少新自由基的产生[18],令机体获得良好的抗氧化能力。同时维生素C是合成内源性血管加压素、皮质醇和加压素的共同底物[19],并能通过促进胶原合成、加强内皮与上皮细胞间连接来维护内皮功能和微循环血流[20]。另外,维生素C还能调节巨噬细胞杀菌活性,抑制转录蛋白核因子-κB的激活,下调促炎递质[21],抑制脓毒症发生发展过程中的过度炎症反应。维生素B1作为外源性维生素是参与糖代谢和能量生成等多种生化反应的酶(丙酮酸脱氢酶、α-酮戊二酸脱氢酶、戊糖磷酸途径的转酮醇酶等)的辅因子[22],并作为氨基酸代谢及γ-氨基丁酸的重要辅酶,维护神经功能和参与髓鞘修复[23]。脓毒症患者的高代谢状态、再喂养综合征、肾脏替代治疗等可导致维生素B1过度消耗或丢失,糖代谢受抑制,三磷酸腺苷(adenosine triphosphate,ATP)生成减少,从而引发细胞代谢紊乱和能量耗竭,患者可出现充血性心力衰竭、谵妄、多发性神经病变、胃肠功能障碍等病症[24]。由于维生素C代谢过程中会产生草酸盐,大剂量应用后可在肾脏形成草酸盐结晶,但维生素B1可催化乙醛酸氧化产生二氧化碳,减少草酸的生成,二者合用可能降低肾脏损伤风险[25]。氢化可的松是肾上腺皮质激素,能提高机体应激能力,发挥抗炎、抗休克、抗毒、抗免疫“四抗”作用,在脓毒症患者中,辅助应用氢化可的松可抑制宿主免疫反应,降低肿瘤坏死因子α水平并提高白介素10水平[26]。对于脓毒性休克患者,氢化可的松能维护其血管内皮细胞功能,减少患者血管活性药物的使用,加速患者血流动力学的恢复[27]。
本研究旨在评价HAT治疗脓毒症的疗效,并对纳入的10篇文献进行Meta分析,结果显示:(1)试验组与对照组院内病死率、AKI发生率比较无统计学差异,提示HAT对脓毒症患者院内病死率、AKI发生率无明显影响;但亚组分析结果显示,在脓毒症患者中,试验组院内病死率、AKI发生率低于对照组;在脓毒症和脓毒性休克患者中,试验组与对照组院内病死率、AKI发生率比较无统计学差异;在脓毒性休克患者中,试验组与对照组院内病死率、AKI发生率比较无统计学差异;提示HAT可降低早期脓毒症患者的院内病死率及AKI发生率,却未降低脓毒性休克患者的院内病死率及AKI发生率,这可能与脓毒性休克病情较严重、大循环和微循环进一步恶化、病理生理机制更为复杂有关,脓毒症是机体对感染的适应性变化,不仅是过度的促炎反应,还包括抗炎反应及后期的促炎/抗炎反应失调的免疫麻痹状态[28],而HAT主要针对脓毒症发生、发展过程中的促炎反应起到调节作用,因此可能对严重脓毒症患者的治疗效果有限。(2)试验组血管活性药物使用时间短于对照组,提示HAT可缩短脓毒症患者血管活性药物使用时间,分析原因可能为维生素C发挥抗氧化作用维护血管内皮功能,维生素B1改善细胞代谢,减轻酸中毒,并与糖皮质激素协同作用维护血管内皮功能,从而改善患者血流动力学。(3)试验组72 h ∆SOFA高于对照组,且亚组分析结果显示,在脓毒症患者中,试验组72 h ∆SOFA高于对照组,提示HAT能降低脓毒症患者72 h SOFA评分,改善其预后。但在脓毒症和脓毒性休克患者中,试验组与对照组72 h∆SOFA比较无统计学差异;在脓毒性休克患者中,试验组与对照组72 h ∆SOFA比较无统计学差异;提示HAT并不能降低脓毒性休克患者的72 h SOFA评分。分析原因,SOFA评分包括对呼吸、凝血、肝脏、循环、神经、肾脏功能状态的评分,临床对脓毒症患者的常规治疗已经包括呼吸支持、补液、血管活性药物、肾脏替代等维护器官功能,并在HAT的协同作用下尤其能缩短血管活性药物使用时间、降低早期脓毒症患者AKI发生率,通过改善循环起到一定的肾脏保护作用,以此降低整体SOFA评分,但若患者病情进展,并发脓毒性休克,器官功能障碍进一步加重,HAT改善循环的作用被抵消,故难以降低脓毒性休克患者SOFA评分。
综上所述,HAT可降低早期脓毒症患者的院内病死率及AKI发生率,缩短血管活性药物使用时间,改善其预后,但对于脓毒性休克患者的治疗效果有限。但本研究亦有不足之处:(1)纳入部分文献[7,10,13,15]的研究者在进行临床试验时未考虑到疾病的个体差异,即未对脓毒症及脓毒性休克患者进行严格区分或亚组分析。(2)HAT治疗早期脓毒症患者的文献[6,9]数量较少,并可能在筛选患者时存在选择偏倚,因此利用HAT治疗早期脓毒症患者仍缺乏高质量研究。(3)根据本研究结果推测HAT或可对早期脓毒症患者有益,但目前尚无关于脓毒症患者HAT治疗时机的研究。(4)纳入标准未对HAT治疗的剂量进行限定,目前尚无关于不同剂量HAT治疗脓毒症的研究。(5)纳入研究的文献总体数量偏少,漏斗图存在不对称性,虽剪补法提示结果具有真实性,但不排除存在发表偏倚的可能,仍需更多高质量的临床研究进一步证实。
作者贡献:王建、鲁俊、周江进行文章的构思与设计、研究的实施与可行性分析、结果分析与解释;王建、张炎、程璐进行数据收集、整理、分析;王建撰写、修订论文;周江负责文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。
