不同施肥模式下轮作制度引起的土壤磷素有效性变化及其影响因素
2022-02-22李帅帅郭俊杰刘文波韩春龙贾海飞凌宁郭世伟
李帅帅,郭俊杰,刘文波,韩春龙,贾海飞,凌宁,郭世伟
不同施肥模式下轮作制度引起的土壤磷素有效性变化及其影响因素
李帅帅1,郭俊杰1,刘文波1,韩春龙2,贾海飞2,凌宁1,郭世伟1
1南京农业大学资源与环境科学学院/江苏省固体有机废弃物资源化高技术研究重点实验室,南京 210095;2如皋市农业科学研究所,江苏如皋 226575
【】探究不同轮作体系对土壤磷素有效性的影响,评估不同轮作体系土壤磷素活化潜力,为农田磷素高效利用提供科学依据。试验于2018—2020年在江苏省如皋市农业科学研究所开展,设置水稻-小麦(R-W)、水稻-油菜(R-O)、水稻-包菜(R-C)、水稻-闲田(R-F)4个轮作模式,每种轮作模式下设置3种施肥处理,分别为不施肥处理(CK)、不施磷处理(NK)、氮磷钾肥处理(NPK)。通过分析旱季和稻季成熟期不同施肥条件下地上部作物吸磷量、土壤磷组分含量、土壤微生物量及碱性磷酸酶活性等,明确不同水旱轮作体系下土壤磷素平衡及有效性变化规律,并探究其主要影响因素。NK处理下土壤磷素的严重失衡导致不同轮作体系土壤有效磷的补充存在差异。在NK处理下,R-O轮作可以保持较高的磷素输出以及促进土壤有效磷的补充。具体表现为NK处理下旱季R-O轮作体系下土壤活性磷相对含量较其他轮作体系低5.7%—7.3%,土壤中等活性磷和稳定性磷相对含量分别较其他轮作体系高4.2%—6.4%和0.9%—1.9%。相比之下,NK处理下稻季土壤中等活性磷相对含量较其他轮作体系高0.5%—3.0%,活性磷和稳定性磷相对含量则分别较其他轮作体系低0—1.5%和0.2%—2.3%。NK处理下,R-O轮作土壤微生物量碳磷比在旱季和稻季均相对较小,且在稻季时显著低于R-W轮作。土壤微生物量氮磷比也具有类似的规律。R-O轮作土壤碱性磷酸酶在旱季和稻季均保持较高活性。路径分析模型表明,磷素携出量(-0.53)和碱性磷酸酶(-0.51)分别对旱季和稻季土壤有效磷含量的贡献最高。在土壤磷素相对亏缺时,水稻-油菜轮作可以通过在旱季释放更多的碱性磷酸酶和调节稻季的土壤微生物量碳磷比,进而促进微生物活化非活性态磷库以补充活性态磷库,以保证在不影响磷素输出的情况下维持土壤有效磷含量的相对稳定。
轮作制度;施肥;磷有效性;磷组分;微生物量;微生物量化学计量比
0 引言
【研究意义】磷缺乏是限制土壤维持可持续生产力的因子之一[1]。近30年的统计数据表明,我国农田土壤磷素平均累积量达1 926 kg P2O5·hm-2,年均磷素盈余量达60 kg P2O5·hm-2[2]。尽管土壤中有大量磷素盈余,但大部分的磷被土壤固定,或为微生物固持,能被植物吸收利用的仅占小部分[3-4]。磷素利用率低下导致生产活动中需要施用更多的肥料来提高作物产量和维持土壤磷素有效性,这不仅导致了农田系统的可持续性下降,而且容易造成环境负面影响。当土壤中的非活性磷能够被调动时,即使不施磷肥,土壤中的磷含量也可以满足作物对磷的需求[5-6]。因此,在减施磷肥的基础上,维持土壤肥力、提高磷素利用率具有重要意义。【前人研究进展】水旱轮作是一种能兼顾水稻和旱地作物生产的种植模式,主要分布在我国的长江流域,轮作方式包括水稻-小麦、水稻-油菜、水稻-蔬菜、水稻-绿肥等[7]。据统计,长江流域的磷素总累积量已达到280×108kg,但其有效磷含量却难以成比例地增加[8]。而水旱轮作模式中,作物和季节性的水热变化会引起土壤物理、化学和生物学特征的差异[7]。研究表明,水旱轮作会使得土壤还原过程与氧化过程交替进行,从而影响土壤中无机磷的化学行为和有效性[9]。在淹水时,较低的氧化还原电位可将土壤中可溶性较低的Fe3+、Mn4+还原为可溶性较高的Fe2+、Mn2+[10-11],而增加的磷酸铁化合物正是土壤中磷有效性较高的形式[12-13]。对于有机磷库,只有将其转化为无机磷形态后才能被植物利用,而微生物在驱动磷素转化的过程中至关重要[14-15]。一方面,植物可以通过释放根系分泌物等措施来招募有益微生物群落,微生物通过分泌磷酸酶来矿化有机磷以释放无机磷[16-17],而磷酸酶驱动无机磷的释放过程被认为是重要的有效磷潜在来源[18];其次,土壤微生物量是土壤磷的动态库[19],并且与磷的快速吸收以及随后的释放和再分配等磷循环过程密切相关[20]。干湿交替的剧烈变化过程会使土壤中微生物细胞破裂溶解,土壤有效磷会由于微生物中磷的释放而增加[21]。因此,在水旱轮作模式下,可以通过适当减少水稻季磷的用量和补足旱季磷来满足作物吸收和土壤磷素的固定[22]。然而土壤中磷的形态多样且存在着复杂的转化关系,简单地将磷素分为无机磷和有机磷两大类,无法揭示土壤不同形态磷素的转化关系。HEDLEY依据土壤磷在不同的浸提剂中的溶解性提出了兼顾无机磷和有机磷磷素分级方法[23],而后经MOIR和TIESSEN等改进,能够在一定程度上反映土壤的磷素含量水平和供磷能力[24]。此外,不同作物轮作模式对磷素需求的差异也会造成磷素利用的不同,一般粮食作物轮作存在较小的磷素亏缺,而蔬菜作物轮作由于磷携出量较低存在磷盈余[25]。【本研究切入点】以往对土壤磷素的研究主要是基于对单一作物种植季的不同施肥模式进行分析比较,以明确土壤磷活化增效的调控途径。近期基于多年定位试验的研究表明,轮作制度同样是引起土壤磷素有效性变化的重要因素[26]。因此,本研究针对轮作模式引起的土壤有效磷的变化来讨论各影响因素对土壤磷素有效性的贡献大小。【拟解决的关键问题】本研究通过水旱轮作田间试验,比较不同轮作模式对土壤磷素活化的潜力,探讨磷素累积量、土壤磷素形态以及微生物学特征对土壤磷有效性的贡献,以期为土壤磷素活化和高效利用提供理论依据。
1 材料与方法
1.1 试验地概况
试验于2018年6月在江苏省如皋市农业科学研究所园区试验田(120°28′ E,32°22′ N)开展。该区地处亚热带,年均温16.1℃,年降雨量815.8 mm。供试土壤为江淮冲积物形成的高砂土,土壤基本理化性质:pH 7.4,土壤有机质15.8 g·kg-1,全氮1.1 g·kg-1,有效磷50.5 mg·kg-1,速效钾102.7 mg·kg-1。
1.2 试验设计
试验设置水稻-小麦(R-W)、水稻-油菜(R-O)、水稻-包菜(R-C)、水稻-闲田(R-F)4个轮作体系,每种轮作模式下设置3种施肥处理,分别为不施肥处理(CK)、不施磷处理(NK)、氮磷钾肥处理(NPK)。随机区组排列,每个处理设置3次重复,其中NPK处理小区面积为40 m2,CK和NK处理小区面积为13.3 m2。供试水稻、小麦、油菜和包菜品种分别为镇稻11号、扬麦16号、秦优10号和鑫旺旺。水稻于每年6月中旬进行插秧,每穴2株,种植密度为25 cm×13 cm;小麦于每年11月中旬进行条播,播种量为150 kg·hm-2,行距为25 cm;油菜移栽于11月中旬,定植12万株/hm2;包菜移栽于2月下旬,定植7万棵/hm2。水稻的氮肥用量为180 kg·hm-2,其中NK处理按50%基肥+50%分蘖肥比例施用,NPK处理按50%基肥+30%分蘖肥+20%穗肥比例施用;油菜和小麦的氮肥用量为120 kg·hm-2,按40%基肥+60%拔节肥比例施用;包菜的氮肥用量为250 kg·hm-2,40%用作基肥,剩下的60%分3次作追肥。水稻、小麦、油菜的磷肥用量为60 kg·hm-2,包菜的磷肥用量为90 kg·hm-2,均做基肥一次性施入。水稻的钾肥用量为75 kg·hm-2,NK处理作基肥施入,NPK处理按60%基肥+40%穗肥比例施用;小麦和油菜的钾肥用量为45 kg·hm-2,包菜的钾肥用量为120 kg·hm-2,均做基肥一次性施用。其中供试肥料分别为尿素(含N 46%),过磷酸钙(含P2O514%),氯化钾(含K2O 60%)。各小区秸秆均不还田,小区间田埂用防水布覆盖,四周设保护行。在水稻季,除水稻生长过程中需要的排水晒田外,田面水保持在5 cm左右;旱季作物的水源主要来自于降雨。根据当地的田间管理习惯进行除草、打药等田间活动。
1.3 样品采集与分析
样品采集于2018—2020年,分别在每年的10月下旬水稻成熟期和5月下旬旱季作物成熟期采集土壤样品。每个小区采取5点0—20 cm土层的土壤,然后将土样带回实验室先过10目筛以除去根系和石砾。一部分土壤样品留作鲜样以测定微生物量碳、氮、磷及碱性磷酸酶活性;另一部分土样自然风干,分别过20目和100目筛,用于测定土壤有效磷、全磷、有机质、pH、磷组分等。以自然年计作轮作周年,并在2019年的旱季和稻季成熟期采集植株样品。在旱季,选择长势均匀的15株小麦、2株油菜、2棵包菜样品;稻季时选择有代表性的2穴水稻植株样品。所有采集的植株样品均将根系剪掉,洗净后分为茎、叶、穗(或果),先置于105℃烘箱中杀青30 min,后于75℃下烘干至恒重,分别称重以计算生物量,并留存部分样品以测定植株养分含量。
土壤全磷、有效磷和植株磷的测定参照鲍士旦的方法[27],即采用HClO4-H2SO4法测定土壤全磷;采用H2SO4-H2O2消煮、钼锑抗比色法测定植株磷;采用0.5 mol·L-1NaHCO3(pH 8.5)浸提、钼锑抗比色法测定土壤有效磷。土壤磷素分级依据修正的Hedley分级方法[24],根据不同磷组分的生物有效性,分为活性磷(labile phosphorus)、中等活性磷(moderately labile phosphorus)和稳定性磷(stable phosphorus)三类。其中活性磷包括树脂提取态磷(Resin-Pi)、0.5 mol·L-1NaHCO3提取态有机磷(NaHCO3-Po)和无机磷(NaHCO3-Pi);中等活性磷包括 0.1 mol·L-1NaOH提取态有机磷(NaOH-Po)和无机磷(NaOH-Pi),以及1 mol·L-1HCl提取态磷(d.HCl-Pi);稳定性磷包括浓盐酸提取态有机磷(c.HCl-Po)和无机磷(c.HCl-Pi)以及残留态磷(Residual-P)。用过硫酸铵氧化法来测定NaHCO3-P、NaOH-P和d.HCl-P中的总磷,土壤总磷含量与无机磷含量之差即为土壤有机磷含量。详细的磷素提取流程见图1。根据不同磷组分的形态,亦可将以上磷组分分为无机磷、有机磷和残余态磷[28],其中残余态磷由不能被独立提取出来的无机磷和有机磷两部分组成。土壤微生物量磷(microbial biomass phosphorus,MBP)采用氯仿熏蒸、0.5 mol·L-1NaHCO3溶液浸提(土水比为1﹕20)、钼锑抗比色法,转化系数为0.4[29];土壤微生物量碳(microbial biomass carbon,MBC)和微生物量氮(microbial biomass nitrogen,MBN)采用氯仿熏蒸、0.5 mol·L-1K2SO4(土水比为1﹕4)溶液浸提、经TOC/TN仪(德国耶拿 multi N/C 3100)测定,转化系数分别取0.45、0.54[30-31];采用磷酸苯二钠比色法测定土壤碱性磷酸酶(Alkaline phosphatase,ALP)的活性[32]。
1.4 计算公式及数据分析
磷积累量(phosphorus accumulation, kg P2O5·hm-2)=籽粒(或角果)生物量(kg·hm-2)×籽粒(或角果)磷含量(%)+茎生物量(kg·hm-2)×茎磷含量(%)+叶生物量(kg·hm-2)×叶磷含量(%);

图1 连续浸提法测土壤磷组分[24]
磷盈亏(P surplus, kg P2O5·hm-2)=磷肥施用量(kg P2O5·hm-2)-作物磷累积量(kg P2O5·hm-2);
磷肥回收率(P recovery efficiency, %)=(施磷区作物地上部磷积累总量-不施磷区作物地上部磷积累总量)/ 磷肥施用总量×100;
磷活化系数(phosphorus activation coefficient, %)=有效磷含量(mg·kg-1)/全磷含量(mg·kg-1)×100。
采用Excel 2016对数据进行统计和图表制作,同时采用SPSS 20.0进行双因素方差分析和LSD多重比较(α=0.05)。采用R 4.0.3进行Pearson相关性分析,并用多重假设检验(FDR 检验)对值进行校正;采用偏最小二乘路径分析法(PLS-PM)来构建模型以明确各影响因素对土壤有效磷的贡献。
2 结果
2.1 不同轮作体系对土壤磷表观平衡及磷肥回收率的影响
轮作制度和施肥均显著影响了作物磷携出量及土壤磷盈余(表1,<0.05)。3种施肥处理下,R-O轮作下旱季磷携出量高于其他轮作体系,并且在NPK处理中达到最高;相比之下,R-O轮作稻季磷携出量均低于其他轮作体系,但与R-W轮作无显著差异。相对于NPK处理,旱季四种轮作NK处理磷携出量占比分别为95.9%、70.5%、66.7%和0%,稻季4种轮作NK处理磷携出量占比分别为86.3%、88.0%、77.2%和89.6%。由此表明,水稻季不同轮作对磷肥的依赖程度大小为R-C>R-W>R-O>R-F。4种轮作体下土壤磷素均处于亏缺状态,并且在NK处理下磷素亏缺量最大。与其他轮作相比,R-O轮作土壤磷携出量和土壤磷盈余均处于较高水平;同样地,R-O轮作磷肥回收率处于较高水平,达32.7%。
2.2 不同轮作体系下磷素特征及有效性
2.2.1 土壤磷含量和有效性 在两个轮作周年内,相对于NK处理,施用磷肥使稻季土壤有效磷含量平均增加7.5和4.3 mg·kg-1,而旱季土壤有效磷含量主要在不同轮作体系间存在显著差异(表2,<0.05)。在无磷肥投入情况下(CK、NK处理),两个轮作周年内旱季R-O轮作土壤有效磷含量均值分别为39.1和33.7 mg·kg-1,分别较其他轮作体系低15.0—15.8和7.2—10.8 mg·kg-1;NPK处理,旱季R-O轮作土壤有效磷平均含量较其他轮作体系低6.2—15.3 mg·kg-1。旱季NK处理下土壤有效磷含量整体表现为R-O轮作显著低于其他轮作体系,而稻季时各轮作之间差异不显著。轮作制度对土壤全磷和PAC影响不大,仅CK处理下存在显著差异。
2.2.2 磷组分含量和有效性 轮作制度显著影响了旱季土壤活性磷和中等活性磷的含量,而稻季时各轮作体系的土壤磷组分无显著差异(图2)。在旱季和稻季,4种轮作体系之间土壤稳定态磷库(c.HCl-Pi、c.HCl-Po、Residual-P)差异均不大。与稳定态磷库的变化不同,活性态和中等活性态的磷组分变化更加明显。Resin-Pi、NaHCO3-Pi、NaOH-Pi含量在旱季所有施肥处理下均表现为R-O轮作显著低于其他轮作体系,但旱季CK、NK处理下d.HCl-Pi含量以及CK处理下NaHCO3-Po含量则是R-O轮作较其他轮作体系高,而稻季R-O轮作仅NaHCO3-Pi以及NK处理下NaOH-Po含量显著低于其他轮作体系。Pearson相关分析表明(图 3),旱季时土壤有效磷含量与Resin-Pi、NaHCO3-Pi呈显著正相关,与c.HCl-Po呈显著负相关;稻季时土壤有效磷含量与NaHCO3-Pi呈显著正相关,与NaOH-Po呈显著负相关。
2.2.3 磷组分相对含量和有效性 轮作制度显著影响了旱季土壤活性磷的相对含量,而稻季时不同磷形态比例在各轮作体系之间无显著差异(表3,<0.05)。在4种轮作体系中,活性磷含量占比在旱季所有施肥处理中表现为R-O轮作分别较R-W、R-C和R-F轮作低2.9%—7.3%、0.3%—6.7%和1.5%—6.3%,而稻季R-O轮作则分别低于其他轮作1.5%—3.5%、0.3%—2.6%和-0.3%—2.8%。在NK处理下,水旱两季R-O轮作中等活性磷含量占比在4种轮作中均是最高,在旱季和稻季分别较其他轮作体系高4.2%—6.4%和0.5%—3.0%;旱季R-O轮作稳定性磷含量占比略低于R-F轮作,但分别较R-W和R-C轮作高0.9%和1.9%,而稻季R-O轮作稳定性磷含量占比较其他轮作体系低0.2%—2.3%。

表1 不同轮作体系下周年磷表观平衡及磷肥回收率
CK:不施肥处理;NK:不施磷处理;NPK:氮磷钾肥处理。R-W:水稻-小麦轮作;R-O:水稻-油菜轮作;R-C:水稻-包菜轮作;R-F:水稻-闲田轮作。同列不同小写字母表示同一施肥处理不同轮作体系间差异显著(<0.05)。*、**、***分别代表在0.05,0.01,0.001水平下显著。ns表示不显著。下表同
CK: No fertilization treatment; NK: No phosphate treatment; N, P, K: NPK fertilization treatment. R-W, R-O, R-C, R-F indicates rice-wheat, rice-oilseed rape, rice-cabbage, and rice-fallow rotation, respectively. Different lowercase letters in the same column indicate significant differences at<0.05 under different rotation systems in the same fertilization treatment. *, **, *** significant at the 0.05, 0.01 and 0.001 probability levels, respectively. ns: Indicates not significant. The same as below

表2 不同轮作体系下磷含量及有效性
TP: Total phosphorus; AP: Available phosphorus; PAC: Phosphorus activation coefficient
同列不同小写字母表示旱季(或稻季)同一施肥处理不同轮作体系间差异显著(<0.05)
Different lowercase letters in the same column indicate significant differences at<0.05 between different rotation systems under the same fertilization treatment in the dry season (or rice season)

Resin-Pi:树脂提取态磷;NaHCO3-Pi/NaHCO3-Po:0.5 mol·L-1NaHCO3提取态无机磷或有机磷;NaOH-Pi/ NaOH-Po:0.1 mol·L-1NaOH提取态无机磷或有机磷;d.HCl-Pi:1 mol·L-1HCl提取态无机磷;c.HCl-Pi/ c.HCl-Po:浓盐酸提取态无机磷或有机磷;Residual-P:残留态磷
图中数据为平均值±标准差。不同小写字母表示旱季(或稻季)同一施肥处理不同轮作体系间差异显著(<0.05)
Resin-Pi: Resin extracted phosphorus; NaHCO3-Pi/NaHCO3-Po: 0.5 mol·L-1NaHCO3extracted inorganic or organic phosphorus; NaOH-Pi/ NaOH-Po: 0.1 mol·L-1NaOH extracted inorganic phosphorus or organic phosphorus; d.HCl-Pi: 1 mol·L-1HCl extracted inorganic phosphorus; c.HCl-Pi/ c.HCl-Po: concentrated hydrochloric acid extracted inorganic or organic phosphorus; Residual-P: Residual phosphorus
The data in the figure is the mean ± standard deviation. Different lowercase letters in the same column indicate significant differences at<0.05 between different rotation systems under the same fertilization treatment in the dry season (or rice season)
图2 2019年旱季(a)和稻季(b)不同轮作体系下各磷组分含量
Fig. 2 Phosphorus fraction contents in dry season (a) and rice season (b) under different rotation systems in 2019
施肥显著影响了土壤中不同形态磷组分的占比(表3,<0.05)。与NK处理相比,NPK处理下土壤无机磷占比在旱季和稻季分别增加了1.2%和0.4%,并且不同轮作体系间存在显著差异。在NPK处理中,旱季R-O轮作有机磷占比较其他轮作体系高1.8%—4.8%、无机磷占比较其他轮作体系低4.8%—8.4%,而稻季R-O轮作有机磷占比则分别较R-W和R-F轮作低1.9%和2.2%,无机磷占比较其他轮作体系高0.7%—3.0%(R-C轮作除外)。Pearson相关分析表明(图3),土壤有效磷含量与活性态磷、无机磷含量呈显著正相关,与稻季土壤有机磷含量呈显著负相关。

表3 不同磷组分含量占比
活性磷包括Resin-Pi、NaHCO3-Pi和NaHCO3-Po;中等活性磷包括NaOH-Pi、NaOH-Po和d.HCl-Pi;稳定性磷包括c.HCl-Pi、c.HCl-Po和Residual-P;有机磷包括NaHCO3-Po、NaOH-Po和c.HCl-Po;无机磷包括Resin-Pi、NaHCO3-Pi、NaOH-Pi、d.HCl-Pi和c.HCl-Pi;残余态磷:Residual-P
Labile phosphorus includes Resin-Pi, NaHCO3-Piand NaHCO3-Po; Moderately labile phosphorus includes NaOH-Pi, NaOH-Poand d.HCl-Pi; Stable phosphorus includes c.HCl-Pi, c.HCl-Poand Residual-P. Organic phosphorus includes NaHCO3-Po, NaOH-Poand c.HCl-Po; Inorganic phosphorus includes Resin-Pi, NaHCO3-Pi, NaOH-Pi, d.HCl-Piand c.HCl-Pi
2.3 不同轮作体系下土壤微生物学特征的差异
轮作制度和施肥均显著影响了水旱两季土壤微生物量、微生物量化学计量比及碱性磷酸酶活性(表4,<0.05)。旱季R-O轮作土壤微生物量磷较R-W轮作低20.7%—28.6%;相比之下,稻季R-O轮作土壤微生物量磷较R-W轮作高-12.6%—157.5%。R-O轮作土壤微生物量碳磷比和微生物量氮磷比在旱季和稻季均相对较小。与微生物量化学计量比相反,R-O轮作土壤碱性磷酸酶活性在旱季和稻季均保持较高水平,但土壤碱性磷酸酶活性仅在旱季CK处理下不同轮作之间存在显著差异(表4,<0.05)。Pearson相关分析表明(图3),稻季土壤有效磷含量与土壤微生物量磷含量呈显著正相关,与微生物量碳磷比、微生物量氮磷比以及碱性磷酸酶活性存在显著负相关关系。

表4 不同轮作体系下土壤微生物学特征

ns表示不显著,*代表P<0.05,**代表P<0.01 ns: Indicates not significant; * Indicates P<0.05, ** Indicates P<0.01
2.4 各影响因素对土壤有效磷的贡献
PLS-PM综合分析了土壤微生物量、土壤碱性磷酸酶、土壤磷素形态以及地上部磷素携出量对土壤有效磷的直接与间接影响(图4)。由路径分析模型可知,影响旱季土壤有效磷含量的因素的总效应大小为:P uptake(-0.53)>ALP(-0.49)>Microbial biomass(0.34)>Organic P(0.14)>Inorganic P(0.02),这些因素一共解释了49%的土壤有效磷含量变异。影响稻季土壤有效磷含量的因素的总效应大小为:ALP(-0.51)>Stoichiometric ratio(-0.50)>Inorganic P(0.42)>P uptake(0.24)>Organic P(0.23),这些因素一共解释了60%的土壤有效磷含量变异。其中磷素携出量(-0.53)和碱性磷酸酶(-0.51)分别是影响旱季和稻季土壤有效磷含量的最主要的因子。
3 讨论
3.1 不同轮作体系对磷素平衡及磷有效性的影响
土壤有效磷被广泛应用于评价土壤供磷特征[33]。与前人研究结果相似,施用磷肥可以提高磷素输出和土壤有效磷含量[25,34]。此外,本研究还发现,同一施肥处理下不同轮作体系之间土壤磷素有效性存在显著差异(表2,<0.05)。一般认为,当土壤中磷素养分供应无法满足作物需求时,作物对磷素的携出会导致土壤耕层磷素亏缺,土壤有效磷含量也会随之降低[34],这与本研究磷素携出量与土壤有效磷含量呈负相关的结果一致(图4-a)。相比于其他施肥处理,NK处理磷素失衡现象最为明显(表1)。在NK处理下,旱季R-O轮作土壤有效磷含量显著低于其他轮作,而稻季NK处理下R-O轮作的土壤有效磷含量与其他轮作之间无显著性差异。另外,在两个轮作周年内,相比于旱季,后茬R-O轮作NK处理下土壤有效磷含量分别增加2.9和4.9 mg·kg-1,在4种轮作中增幅最大。由此可见,R-O轮作体系中旱季作物对稻季作物维持土壤磷素有效性的影响强于其他轮作。与本研究结果相似,近期一项研究表明,稻-稻-油轮作早稻成熟期土壤中有效磷含量是稻-稻-闲轮作的2倍左右[35]。此外,相比与其他轮作,R-O轮作周年磷携出量土壤磷素亏缺量处于较高水平(表1),同时不同轮作体系磷肥回收率大小为R-O>R-F>R-W。因此,R-O轮作可以维持前后茬土壤磷素的持续输出或许是土壤磷素的活化能力强于其他轮作。
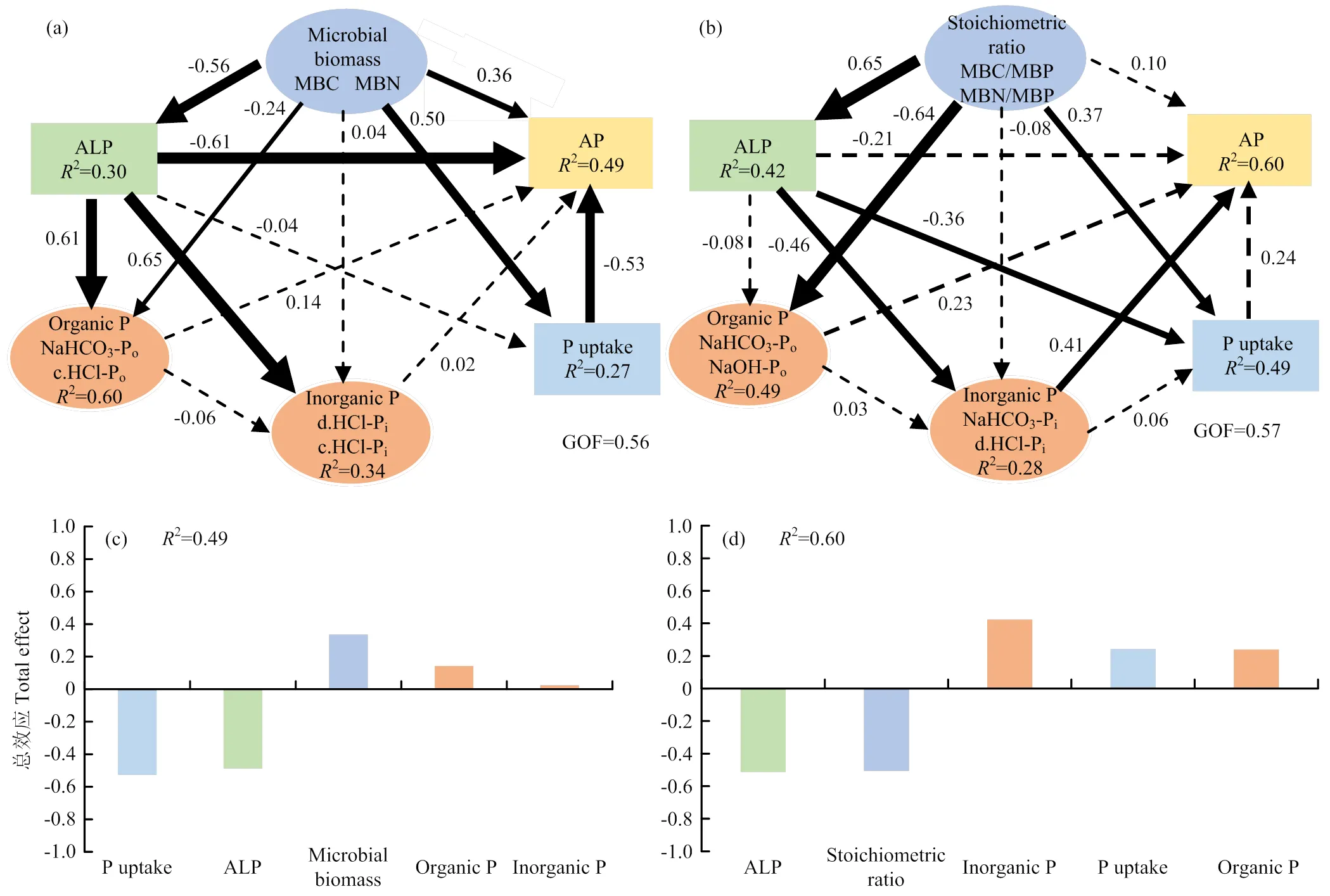
实线表示作用路径显著,虚线表示作用路径不显著;线的粗细表示路径系数的大小
3.2 不同轮作体系下磷组分特征与磷有效性的关系
施用磷肥显著增加了旱季和稻季土壤中无机态磷的占比,而无机态磷中的土壤活性磷和中等活性磷的再分布受到轮作制度的显著影响(图2,表3)。一般认为,活性磷和中等活性磷是土壤有效磷的库源[36]。本研究中稳定态磷库从旱季到稻季呈减小趋势,尤其在NK处理下,旱季R-O轮作稳定性磷含量占比高于其他轮作(R-F轮作除外),而稻季R-O轮作稳定性磷含量占比在四种轮作中最低,说明磷素亏缺时,稳定态磷库可能作为作物的有效磷源。有机酸溶解被认为是微生物或植物对稳定磷库中的磷进行增溶和补充土壤溶液的重要机制[37]。R-O轮作能够较大幅度地促进稳定性磷的溶解,将稳定态磷库转化为其他活性态磷库(表3),或许与油菜根系分泌柠檬酸的速率较快[38],一定程度上提高了土壤中有机酸的丰度有关。活性态磷库是对作物有效性最高的磷库,其含量高低和土壤有效磷含量存在显著正相关关系(图3)。在本研究NK处理下,R-O轮作土壤活性磷含量占比较其他轮作低,幅度由旱季的5.7%—7.3%变为稻季的0—1.5%;而中等活性磷含量占比较其他轮作高,幅度由旱季的4.2%—6.4%变为稻季的0.5%—3.0%。R-O轮作土壤稳定态和中等活性态磷库的转化使得活性态的磷库得到补充,减小了R-O轮作与其他轮作之间的差异,因此R-O轮作在没有磷肥投入的情况下,依旧可以维持磷素输出和土壤有效磷含量相对稳定。此外,Resin-Pi与 NaHCO3-Pi是土壤中对作物有效性最高的磷形态[39],本研究所有轮作体系NaHCO3-Pi含量均有下降,可能是NaHCO3-Pi被作物大量吸收所致,而稻季R-O轮作活性态磷库占比与其他轮作差异减小主要与Resin-Pi含量增加有关,这与朱文彬的研究结果类似[40]。
土壤中有机磷含量一般为土壤全磷的20%—40%,本试验中土壤中有机磷含量为3.9%—11.4%,含量略低的原因是Hedley磷素分级方法中的有机磷含量并非是土壤中的全部有机磷,仍有一部分的有机磷以残余态磷的形式存在而不能被提取出来。本研究还发现,相比于CK处理,NPK处理土壤有机磷占比显著降低,并且在不同轮作体系中转化速率存在差异(表3)。在NPK处理中,旱季R-O轮作有机磷占比高于其他轮作,无机磷占比低于其他轮作,而稻季R-O轮作无机磷占比和有机磷占比较其他轮作则表现出与旱季相反的规律。此外,由于土壤有效磷含量与有机磷和无机磷含量分别呈负相关和正相关关系,而非活性态的NaOH-Po和c.HCl-Po与土壤有效磷的相关系数在有机磷中最高(图3),且与土壤磷库的转化密切相关(图4),是潜在的有效磷来源[41-42]。R-O轮作活性态磷库可以得到补充,或许与非活性态中有机磷的矿化有关。
3.3 不同轮作体系下土壤微生物学特征与磷有效性的关系
水旱交替过程中,除了物理化学过程可以释放磷,微生物过程也是磷释放的主要来源[15]。由于受到植物生长阶段和养分投入的影响,微生物量的变化是非稳态的[43]。本试验结果表明,与NK处理相比,NPK处理可以增加土壤微生物量,并且轮作制度之间存在显著差异(表4,<0.05)。微生物生物量的化学计量比是控制微生物调节功能的重要因素[44],在一定程度上能反映出土壤的养分限制因子。一般认为,微生物量碳、氮、磷化学计量比在土壤中介于11﹕1﹕1到93﹕10﹕1[45],当微生物量碳磷比较小时,则有利于微生物通过矿化过程以补充土壤有效磷;反之,则说明微生物同化有效磷并与作物竞争磷[46]。本研究稻季微生物量碳磷比与土壤有效磷和有机磷显著的负相关关系也证实了上述观点(图3,图4-b)。此外,在NK处理下,旱季4种轮作的微生物量碳磷比无显著差异,而在稻季时则表现为R-O、R-C、R-F轮作显著低于R-W轮作,NPK处理中也有类似的趋势。稻季R-C、R-F轮作微生物量碳磷比较R-W轮作低的原因可能是前茬氮素累积促进了微生物对磷素的需求[41]。在肥料投入相同的情况下,相比于R-W轮作,稻季R-O轮作较低的微生物量碳磷比或许有利于促进微生物通过矿化过程释放磷,以此来维持土壤磷素的有效性。酶水解被认为是补充土壤有效磷的另一个重要机制[37]。本研究旱季和稻季R-O轮作土壤碱性磷酸酶活性在4种轮作中均处于较高水平,说明矿化有机磷的潜力大小与土壤碱性磷酸酶的活性有关。路径分析模型也表明,旱季土壤碱性磷酸酶对土壤有效磷的直接效应最大(图4-a),而在稻季微生物量化学计量比对土壤有效磷的调控最强(图4-b)。由此可见,R-O轮作通过维持更大的碱性磷酸酶活性来潜在地影响土壤中有效磷的补充。在缺乏磷素的土壤中,微生物获取碳时会通过释放磷酸酶来矿化土壤中的有机磷以增加土壤磷的有效性,这与本文的研究结果一致[43,47-49]。
4 结论
在土壤磷素亏缺条件下,水稻-油菜轮作体系更有利于维持磷素输出和土壤有效磷含量的相对稳定,这与水稻-油菜轮作体系可以矿化非活性态磷库中的有机磷以补充活性态磷库的过程有关,而水稻-小麦、水稻-包菜和水稻-闲田轮作的活性态磷库补充量小于水稻-油菜轮作,微生物量碳磷化学计量比和碱性磷酸酶活性是影响轮作制度磷素活化差异的关键因素。
[1] BALEMI T, NEGISHO K. Management of soil phosphorus and plant adaptation mechanisms to phosphorus stress for sustainable crop production: a review. Journal of Soil Science and Plant Nutrition, 2012(ahead).doi:10.4067/s0718-95162012005000015.
[2] 马进川. 我国农田磷素平衡的时空变化与高效利用途径[D]. 北京: 中国农业科学院, 2018.
MA J C. Temporal and spatial variation of phosphorus balance and solutions to improve phosphorus use efficiency in Chinese arable land[D]. Beijing: Chinese Academy of Agricultural Sciences, 2018. (in Chinese)
[3] LUEDERS T, KINDLER R, MILTNER A, FRIEDRICH M W, KAESTNER M. Identification of bacterial micropredators distinctively active in a soil microbial food web. Applied and Environmental Microbiology, 2006, 72(8): 5342-5348. doi:10.1128/AEM.00400-06.
[4] BHATTACHARYYA P N, JHA D K. Plant growth-promoting rhizobacteria (PGPR): Emergence in agriculture. World Journal of Microbiology & Biotechnology, 2012, 28(4): 1327-1350. doi:10.1007/ s11274-011-0979-9.
[5] ZHANG H Z, SHI L L, WEN D Z, YU K L. Soil potential labile but not occluded phosphorus forms increase with forest succession. Biology and Fertility of Soils, 2016, 52(1): 41-51. doi:10.1007/ s00374-015-1053-9.
[6] MENEZES-BLACKBURN D, GILES C, DARCH T, GEORGE T S, BLACKWELL M, STUTTER M, SHAND C, LUMSDON D, COOPER P, WENDLER R, BROWN L, ALMEIDA D S, WEARING C, ZHANG H, HAYGARTH P M. Opportunities for mobilizing recalcitrant phosphorus from agricultural soils: A review. Plant and Soil, 2018, 427(1): 5-16. doi:10.1007/s11104-017-3362-2.
[7] 范明生, 江荣风, 张福锁, 吕世华, 刘学军. 水旱轮作系统作物养分管理策略. 应用生态学报, 2008, 19(2): 424-432.
FAN M S, JIANG R F, ZHANG F S, LÜ S H, LIU X J. Nutrient management strategy of paddy rice-upland crop rotation system. Chinese Journal of Applied Ecology, 2008, 19(2): 424-432. (in Chinese)
[8] POWERS S M, BRUULSEMA T W, BURT T P, CHAN N L, ELSER J J, HAYGARTH P M, HOWDEN N J K, JARVIE H P, YANG L, PETERSON H M, SHARPLEY A N, SHEN J B, WORRALL F, ZHANG F S. Long-term accumulation and transport of anthropogenic phosphorus in three river basins. Nature Geoscience, 2016, 9(5): 353-357. doi:10.1038/NGEO2693.
[9] FLESSA H, FISCHER W R. Plant-induced changes in the redox potentials of rice rhizospheres. Plant and Soil, 1992, 143(1): 55-60. doi:10.1007/BF00009128.
[10] LINDSAY W L, NORVELL W A. Development of a DTPA soil test for zinc, iron, manganese, and copper. Soil Science Society of America Journal, 1978, 42(3): 421-428. doi:10.2136/sssaj1978. 03615995004200030009x.
[11] 刘学军, 吕世华, 张福锁, 毛达如. 水肥状况对土壤剖面中锰的移动和水稻吸锰的影响. 土壤学报, 1999, 36(3): 369-376.
LIU X J, LÜ S H, ZHANG F S, MAO D R. Effect of water and fertilization on movement of manganese in soils and on its uptake by rice. Acta Pedologica Sinica, 1999, 36(3): 369-376. (in Chinese)
[12] 鲁如坤, 蒋柏藩, 牟润生. 磷肥对水稻和旱作的肥效及其后效的研究. 土壤学报, 1965, 2(2): 152-160.
LU R K, JIANG P F, MU Y S. Studies on the methods of application of phosphatic fertilizer in relation to the yield of crops. Acta Pedologica Sinica, 1965, 2(2): 152-160. (in Chinese)
[13] FAN Y X, ZHONG X J, LIN F, LIU C, YANG L M, WANG M H, CHEN G S, CHEN Y, YANG Y S. Responses of soil phosphorus fractions after nitrogen addition in a subtropical forest ecosystem: Insights from decreased Fe and Al oxides and increased plant roots. Geoderma, 2019, 337: 246-255. doi:10.1016/j.geoderma.2018.09.028.
[14] PII Y, MIMMO T, TOMASI N, TERZANO R, CESCO S, CRECCHIO C. Microbial interactions in the rhizosphere: Beneficial influences of plant growth-promoting rhizobacteria on nutrient acquisition process. A review. Biology and Fertility of Soils, 2015, 51(4): 403-415. doi:10.1007/s00374-015-0996-1.
[15] BÜNEMANN E K, KELLER B, HOOP D, JUD K, BOIVIN P, FROSSARD E. Increased availability of phosphorus after drying and rewetting of a grassland soil: Processes and plant use. Plant and Soil, 2013, 370(1): 511-526. doi:10.1007/s11104-013-1651-y.
[16] ROMANYÀ J, ROVIRA P. Organic and inorganic P reserves in rain-fed and irrigated calcareous soils under long-term organic and conventional agriculture. Geoderma, 2009, 151(3/4): 378-386. doi:10.1016/j.geoderma.2009.05.009.
[17] RICHARDSON A E. Prospects for using soil microorganisms to improve the acquisition of phosphorus by plants. Functional Plant Biology, 2001, 28(9): 897. doi:10.1071/pp01093.
[18] DELUCA T H, GLANVILLE H C, HARRIS M, EMMETT B A, PINGREE M R A, DE SOSA L L, CERDÁ-MORENO C, JONES D L. A novel biologically-based approach to evaluating soil phosphorus availability across complex landscapes. Soil Biology and Biochemistry, 2015, 88: 110-119. doi:10.1016/j.soilbio.2015.05.016.
[19] ROSLING A, MIDGLEY M G, CHEEKE T, URBINA H, FRANSSON P, PHILLIPS R P. Phosphorus cycling in deciduous forest soil differs between stands dominated by ecto- and arbuscular mycorrhizal trees. New Phytologist, 2016, 209(3): 1184-1195. doi:10.1111/nph.13720.
[20] PISTOCCHI C, MÉSZÁROS É, TAMBURINI F, FROSSARD E, BÜNEMANN E K. Biological processes dominate phosphorus dynamics under low phosphorus availability in organic horizons of temperate forest soils. Soil Biology and Biochemistry, 2018, 126: 64-75. doi:10.1016/j.soilbio.2018.08.013.
[21] TANG X, SHI X, MA Y, HAO X. Phosphorus efficiency in a long-term wheat–rice cropping system in China. The Journal of Agricultural Science, 2011, 149(3): 297-304. doi:10.1017/ s002185961000081x.
[22] YADVINDER-SINGH, DOBERMANN A, BIJAY-SINGH, BRONSON K F, KHIND C S. Optimal phosphorus management strategies for wheat-rice cropping on a loamy sand. Soil Science Society of America Journal, 2000, 64(4): 1413-1422. doi:10.2136/sssaj2000.6441413x.
[23] HEDLEY M J, STEWART J W B, CHAUHAN B S. Changes in inorganic and organic soil phosphorus fractions induced by cultivation practices and by laboratory incubations. Soil Science Society of America Journal, 1982, 46(5): 970-976. doi:10.2136/sssaj1982. 03615995004600050017x.
[24] MOIR J, TIESSEN H. Characterization of available P by sequential extraction//Soil Sampling and Methods of Analysis. 2nd ed. CRC Press, 2007.
[25] MALTAIS-LANDRY G, SCOW K, BRENNAN E, TORBERT E, VITOUSEK P. Higher flexibility in input N: P ratios results in more balanced phosphorus budgets in two long-term experimental agroecosystems. Agriculture, Ecosystems & Environment, 2016, 223: 197-210. doi:10.1016/j.agee.2016.03.007.
[26] 孙博, 李帅帅, 周毅, 张莹, 陈健, 刘田, 郭俊杰, 凌宁, 郭世伟. 不同轮作模式下优化施肥对水稻产量及磷素积累与分配的影响. 南京农业大学学报, 2020, 43(4): 658-666.
SUN B, LI S S, ZHOU Y, ZHANG Y, CHEN J, LIU T, GUO J J, LING N, GUO S W. Effects of optimized fertilization on rice yield and accumulation and distribution of phosphorus under different rotation systems. Journal of Nanjing Agricultural University, 2020, 43(4): 658-666. (in Chinese)
[27] 鲍士旦. 土壤农化分析. 3版. 北京: 中国农业出版社, 2000.
BAO S D. Soil and Agricultural Chemistry Analysis. 3rd ed. Beijing: Chinese Agriculture Press, 2000. (in Chinese)
[28] CROSS A F, SCHLESINGER W H. A literature review and evaluation of the. Hedley fractionation: Applications to the biogeochemical cycle of soil phosphorus in natural ecosystems. Geoderma, 1995, 64(3/4): 197-214. doi:10.1016/0016-7061(94) 00023-4.
[29] BROOKES P C, POWLSON D S, JENKINSON D S. Measurement of microbial biomass phosphorus in soil. Soil Biology and Biochemistry, 1982, 14(4): 319-329. doi:10.1016/0038-0717(82)90001-3.
[30] WU J, JOERGENSEN R G, POMMERENING B, CHAUSSOD R, BROOKES P C. Measurement of soil microbial biomass C by fumigation-extraction—An automated procedure. Soil Biology and Biochemistry, 1990, 22(8): 1167-1169. doi:10.1016/0038-0717(90) 90046-3.
[31] BROOKES P C, LANDMAN A, PRUDEN G, JENKINSON D S. Chloroform fumigation and the release of soil nitrogen: A rapid direct extraction method to measure microbial biomass nitrogen in soil. Soil Biology and Biochemistry, 1985, 17(6): 837-842. doi:10.1016/ 0038-0717(85)90144-0.
[32] NANNIPIERI P, GIAGNONI L, LANDI L, RENELLA G. Role of phosphatase enzymes in soil//Soil Biology. Berlin, Heidelberg: Springer Berlin Heidelberg, 2010: 215-243. doi:10.1007/978-3-642- 15271-9_9.
[33] BAI Z H, LI H G, YANG X Y, ZHOU B K, SHI X J, WANG B R, LI D C, SHEN J B, CHEN Q, QIN W, OENEMA O, ZHANG F S. The critical soil P levels for crop yield, soil fertility and environmental safety in different soil types. Plant and Soil, 2013, 372(1): 27-37. doi:10.1007/s11104-013-1696-y.
[34] 黄晶, 张杨珠, 徐明岗, 高菊生. 长期施肥下红壤性水稻土有效磷的演变特征及对磷平衡的响应. 中国农业科学, 2016, 49(6): 1132-1141. doi:10.3864/j.issn.0578-1752.2016.06.009.
HUANG J, ZHANG Y Z, XU M G, GAO J S. Evolution characteristics of soil available phosphorus and its response to soil phosphorus balance in paddy soil derived from red earth under long-term fertilization. Scientia Agricultura Sinica, 2016, 49(6): 1132-1141. doi:10.3864/j.issn.0578-1752.2016.06.009. (in Chinese)
[35] LU S, LEPO J E, SONG H X, GUAN C Y, ZHANG Z H. Increased rice yield in long-term crop rotation regimes through improved soil structure, rhizosphere microbial communities, and nutrient bioavailability in paddy soil. Biology and Fertility of Soils, 2018, 54(8): 909-923. doi:10.1007/s00374-018-1315-4.
[36] WEAND M P, ARTHUR M A, LOVETT G M, SIKORA F, WEATHERS K C. The phosphorus status of northern hardwoods differs by species but is unaffected by nitrogen fertilization. Biogeochemistry, 2010, 97(2): 159-181. doi:10.1007/s10533-009- 9364-2.
[37] ZHANG H Z, SHI L L, LU H B, SHAO Y H, LIU S R, FU S L. Drought promotes soil phosphorus transformation and reduces phosphorus bioavailability in a temperate forest. Science of the Total Environment, 2020, 732: 139295. doi:10.1016/j.scitotenv.2020. 139295.
[38] WANG Y L, ALMVIK M, CLARKE N, EICH-GREATOREX S, ØGAARD A F, KROGSTAD T, LAMBERS H, CLARKE J L. Contrasting responses of root morphology and root-exuded organic acids to low phosphorus availability in three important food crops with divergent root traits. AoB PLANTS, 2015, 7(10.1093): aobpla. doi:10.1093/aobpla/plv097.
[39] VERMA S, SUBEHIA S K, SHARMA S P. Phosphorus fractions in an acid soil continuously fertilized with mineral and organic fertilizers. Biology and Fertility of Soils, 2005, 41(4): 295-300. doi:10.1007/ s00374-004-0810-y.
[40] ZHU W B, ZHAO X, WANG S Q, WANG Y. Inter-annual variation in P speciation and availability in the drought-rewetting cycle in paddy soils. Agriculture, Ecosystems & Environment, 2019, 286: 106652. doi:10.1016/j.agee.2019.106652.
[41] FAN Y X, LIN F, YANG L M, ZHONG X J, WANG M H, ZHOU J C, CHEN Y, YANG Y S. Decreased soil organic P fraction associated with ectomycorrhizal fungal activity to meet increased P demand under N application in a subtropical forest ecosystem. Biology and Fertility of Soils, 2018, 54(1): 149-161. doi:10.1007/s00374-017- 1251-8.
[42] YANG K, ZHU J J, GU J C, YU L Z, WANG Z Q. Changes in soil phosphorus fractions after 9 years of continuous nitrogen addition in aplantation. Annals of Forest Science, 2015, 72(4): 435-442. doi:10.1007/s13595-014-0444-7.
[43] HEUCK C, WEIG A, SPOHN M. Soil microbial biomass C: N: P stoichiometry and microbial use of organic phosphorus. Soil Biology and Biochemistry, 2015, 85: 119-129. doi:10.1016/j.soilbio.2015.02. 029.
[44] YUAN H Z, LIU S L, RAZAVI B S, ZHRAN M, WANG J R, ZHU Z K, WU J S, GE T D. Differentiated response of plant and microbial C: N: P stoichiometries to phosphorus application in phosphorus-limited paddy soil. European Journal of Soil Biology, 2019, 95: 103122. doi:10.1016/j.ejsobi.2019.103122.
[45] TISCHER A, POTTHAST K, HAMER U. Land-use and soil depth affect resource and microbial stoichiometry in a tropical mountain rainforest region of southern Ecuador. Oecologia, 2014, 175(1): 375-393. doi:10.1007/s00442-014-2894-x.
[46] HE Z L, WU J, O’DONNELL A G, SYERS J K. Seasonal responses in microbial biomass carbon, phosphorus and sulphur in soils under pasture. Biology and Fertility of Soils, 1997, 24(4): 421-428. doi:10.1007/s003740050267.
[47] WANG J P, WU Y H, ZHOU J, BING H J, SUN H Y. Carbon demand drives microbial mineralization of organic phosphorus during the early stage of soil development. Biology and Fertility of Soils, 2016, 52(6): 825-839. doi:10.1007/s00374-016-1123-7.
[48] ACUÑA J J, DURÁN P, LAGOS L M, OGRAM A, DE LA LUZ MORA M, JORQUERA M A. Bacterial alkaline phosphomonoesterase in the rhizospheres of plants grown in Chilean extreme environments. Biology and Fertility of Soils, 2016, 52(6): 763-773. doi:10.1007/ s00374-016-1113-9
[49] 袁佳慧. 太湖稻麦轮作农田土壤磷素生物有效性研究[D]. 哈尔滨: 东北农业大学, 2018.
YUAN J H. Availability of soil P in A rice-wheat cropping rotation in Taihu lake region[D]. Harbin: Northeast Agricultural University, 2018. (in Chinese)
Influence of Typical Rotation Systems on Soil Phosphorus Availability Under Different Fertilization Strategies
LI ShuaiShuai1, GUO JunJie1, LIU WenBo1, HAN ChunLong2, JIA HaiFei2, LING Ning1, GUO ShiWei1
1College of Resources and Environmental Sciences, Nanjing Agricultural University/Jiangsu Provincial Key Laboratory of Solid Organic Waste Utilization, Nanjing 210095;2Rugao Institute of Agricultural Sciences, Rugao 226575, Jiangsu
【】 In order to provide a scientific basis for the efficient utilization of phosphorus in farmland, the effects of different rotation systems on the availability of soil phosphorus were explored to evaluate the potential of soil phosphorus activation in different crop rotation systems. 【】 The experiment was conducted at Rugao Institute of Agricultural Sciences, Jiangsu Province from 2018 to 2020. Four paddy-upland rotation systems in the experiment included rice-wheat (R-W), rice-oilseed rape (R-O), rice-cabbage (R-C), and rice-fallow (R-F) rotation. Three fertilization treatments under each rotation system were applied, including no fertilization treatment (CK), no phosphate treatment (NK), and NPK fertilization treatment (NPK). The variation patterns and main influencing factors of soil phosphorus balance and availability under different paddy and upland rotation systems were clarified by analyzing the phosphorus uptake by aboveground crops, soil phosphorus fraction contents, soil microbial biomass and soil alkaline phosphatase activity under different phosphorus application conditions in dry season and rice season maturity. 【】The severe imbalance of soil phosphorus under NK treatment resulted in differences in the supplement of soil available phosphorus in different rotation systems. Under NK treatment, R-O rotation could maintain a higher phosphorus output and promote the replenishment of soil available phosphorus. Specifically, the relative content of soil labile phosphorus in R-O rotation in dry season under NK treatment was 5.7%-7.3% lower than that in other rotations, and the relative content of soil moderately labile phosphorus and stable phosphorus were 4.2%-6.4% and 0.9%-1.9% higher than that in other rotations, respectively. However, the relative content of soil moderately labile phosphorus in R-O rotations under NK treatment in rice season was 0.5%-3.0% higher than that under other rotations, and the soil labile phosphorus and stable phosphorus were 0-1.5% and 0.2%-2.3% lower than that under other rotations, respectively. Under NK treatment, the soil microbial biomass C/P ratios of R-O rotation was relatively small in both dry season and rice season, and it was significantly lower than that under R-W rotation in rice season. The soil microbial biomass N/P ratios also had a similar trend. But the soil alkaline phosphatase activity of R-O rotation maintained a high level in both dry season and rice season. The path analysis model showed that the phosphorus accumulation (-0.53) and the soil alkaline phosphatase (-0.51) had the most contribution to the soil available phosphorus in dry season and rice season, respectively. 【】 When the soil phosphorus was relatively imbalance, the rice-oilseed rape rotation released more alkaline phosphatase in dry season and regulated the soil microbial biomass C/P ratio in rice season, which was conducive to promoting the activation of the non-labile phosphorus by microorganisms to supplement the labile phosphorus, so as to ensure the relative stable of soil available phosphorus content without affecting phosphorus output.
rotation system; fertilization strategies; phosphorus availability; phosphorus fractions; microbial biomass; microbial biomass stoichiometric ratio

10.3864/j.issn.0578-1752.2022.01.009
2020-12-26;
2021-04-02
国家重点研发计划(2017YFD0200200)、国家自然科学基金(U2003210)、江苏省自然科学基金(BK20190543)
李帅帅,E-mail:2018103102@njau.edu.cn。通信作者郭世伟,E-mail:sguo@njau.edu.cn
(责任编辑 李云霞)
