外源ABA 对藜麦种子萌发的影响
2022-02-22王德领庄东英蒋润枝时丕彪费月跃殷建祥林四新顾闽峰
王德领 庄东英 蒋润枝 方 迪 时丕彪 费月跃 殷建祥 林四新 顾闽峰
(1 江苏省盐城市新洋农业试验站,盐城 224049;2 江苏省沿海开发(东台)有限公司,盐城 224049)
藜麦(Chenopodium quinoaWilld.)又 称 为藜谷、南美藜、昆诺阿藜等,属于苋科藜属一年生短日照双子叶植物,在南美洲安第斯山地区已有超过7000 年的种植历史,是古印加民族的主要粮食作物之一[1-2]。藜麦是全谷全营养完全蛋白的碱性食物,蛋白质的含量高达16%~22%,富含人体所必需的9种氨基酸,氨基酸比例适当且易于人体吸收[3-4]。同时含有中量元素钙、镁,微量元素铁、锌、硒、锰、铜等多种矿物质营养元素,此外还含有维生素类物质如B 族维生素和维生素E 以及多种功能活性物质如叶酸、胆碱、甜菜碱、α-亚麻酸、β-葡聚糖等[5-6],所以藜麦就有了“素食之王”和“营养黄金”美誉之称[7]。联合国粮农组织(FAO)是一个关注人类营养健康和食品安全的国际性组织,通过多年调研将藜麦列为唯一可以提供人体全部基本营养物质需求的完美农作物,联合国将2013 年命名为“国际藜麦年”,这说明了藜麦是未来最具研究开发潜力的农作物之一,具有无比广阔的发展前景[2,8-9]。
藜麦的种子很小,千粒重一般在2.5~4.5g 之间,与小米籽粒大小差不多,但是其种子的胚芽十分发达,种皮很薄,且容易溶于水。所以,藜麦种子成熟以后,遇到连续阴雨天气极易在植株上发芽,严重影响了藜麦的产量及品质[10]。作物种子萌发是一个复杂的过程,会受到多种植物生长调节剂的调控。其中脱落酸(ABA)具有阻碍农作物种子胚芽吸收水分、阻碍细胞壁降解酶的合成、促使种子胚芽细胞分裂停止和抑制种子胚乳软化的作用,这些作用使ABA 具有了抑制农作物种子萌发和促进种子休眠的功能[11-13]。有研究表明用浓度70~110mg/L 的外源ABA 处理杂交水稻时发现种子萌发受到明显抑制,用浓度5~1000μmol 的外源ABA 处理蒺藜状苜蓿种子,种子的发芽势被极显著抑制,并且外源ABA 浓度越高,抑制效应越强。但在研究过程中也有学者发现低浓度外源ABA(10mg/L)可以提高发芽势从而促进作物种子的萌发。到目前为止,研究发现不同农作物或者同种农作物不同品种的种子在外源ABA 处理后的萌发情况并不完全一样,有的表现为抑制,有的表现为低浓度促进而高浓度抑 制[14-16]。藜麦作为一种新兴的全营养健康作物,目前关于外源ABA 对藜麦种子萌发动态的影响还鲜有报道,并且种植过程中也发现了藜麦种子遇水容易发芽,为此研究了不同浓度外源ABA 对藜麦种子萌发动态的影响,观察不同浓度ABA 对藜麦种子萌发的抑制作用,期望为解决藜麦田间穗发芽问题提供参考。
1 材料与方法
1.1 试验材料以苏藜1 号种子为试验材料,该品种由江苏沿海地区农业科学研究所新洋试验站藜麦种质资源课题组选育。
1.2 试验方法
1.2.1 ABA 工作溶液配制先配制浓度为100mg/L 的ABA 母液,再依次稀释得到5、10、20、40、60、80mg/L 的工作溶液,以蒸馏水为0mg/L 对照(CK)。
1.2.2 发芽试验取足量饱满的藜麦种子用70%乙醇消毒2~3min,然后用自来水冲洗干净,再用蒸馏水漂洗2~3 遍[17]。采用铺有2 层滤纸的方形培养皿(12cm×12cm×5cm)为发芽床,将已消毒的供试种子均匀置于培养皿中,加盖,每皿100 粒种子,设8 个ABA 浓度梯度处理,即0、5、10、20、40、60、80、100mg/L,其中0mg/L ABA 浓度为空白对照(CK),每个处理设置3 次重复,将培养皿放于恒温光照培养箱中培养,培养条件为25±0.5℃,光暗周期为16h/8h。以种子的胚芽长度达到藜麦种子长度的一半视为种子发芽[18-19],每天在固定时间观察记录种子发芽数。
1.2.3 发芽指标测定在第3 天统计种子发芽势;在第7 天统计种子发芽率;第10 天每个处理随机选择5 株正常发育的幼苗,分别测定幼苗根长、苗高,称量鲜重。各指标计算公式如下。

1.2.4 数据统计与分析利用Microsoft Excel 2013进行试验数据分析和作图,运用SPSS 19.0 统计软件进行试验数据方差分析和差异显著性检验。
2 结果与分析
2.1 ABA 对藜麦种子萌发动态变化的影响由图1 可以发现,不同浓度外源ABA 降低了藜麦种子的发芽率,并且随着ABA 浓度升高,抑制效应逐渐增强,藜麦种子开始萌发的时间也往后延迟。空白处理的种子在第1 天达到萌发高峰,5mg/L ABA 处理萌发高峰在第3 天,10mg/L ABA 处理萌发高峰在第7 天,≥20mg/L ABA 处理无明显萌发高峰。5mg/L 和10mg/L ABA 处理发芽率和空白处理接近,都在95%以上,≥40mg/L ABA 处理发芽率都在60%以下,受到明显抑制。另外80mg/L 和100mg/L ABA处理的藜麦种子在处理后第3 天才开始萌发。由此可见,外源ABA 可以延缓藜麦种子的发芽进程,高浓度ABA 对藜麦种子的萌发具有一定的抑制作用。
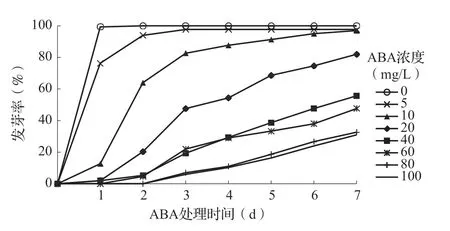
图1 不同浓度ABA 处理下藜麦种子的萌发动态
2.2 ABA 对藜麦种子发芽势和发芽指数的影响由图2 可以看出,不同处理藜麦种子的发芽势和发芽指数变化规律基本相同。即随着外源ABA 浓度升高,种子发芽势和发芽指数均降低。与CK 相比5mg/L ABA 处理种子的发芽势和发芽指数差异性不显著,说明低浓度ABA 对藜麦种子的萌发影响较小,其他处理种子的发芽势和发芽指数都显著低于对照,并且随着ABA 浓度增大处理间差异性达到显著水平,说明高浓度ABA 对藜麦种子的萌发具有显著的抑制效应,并且随浓度升高抑制效应增强。
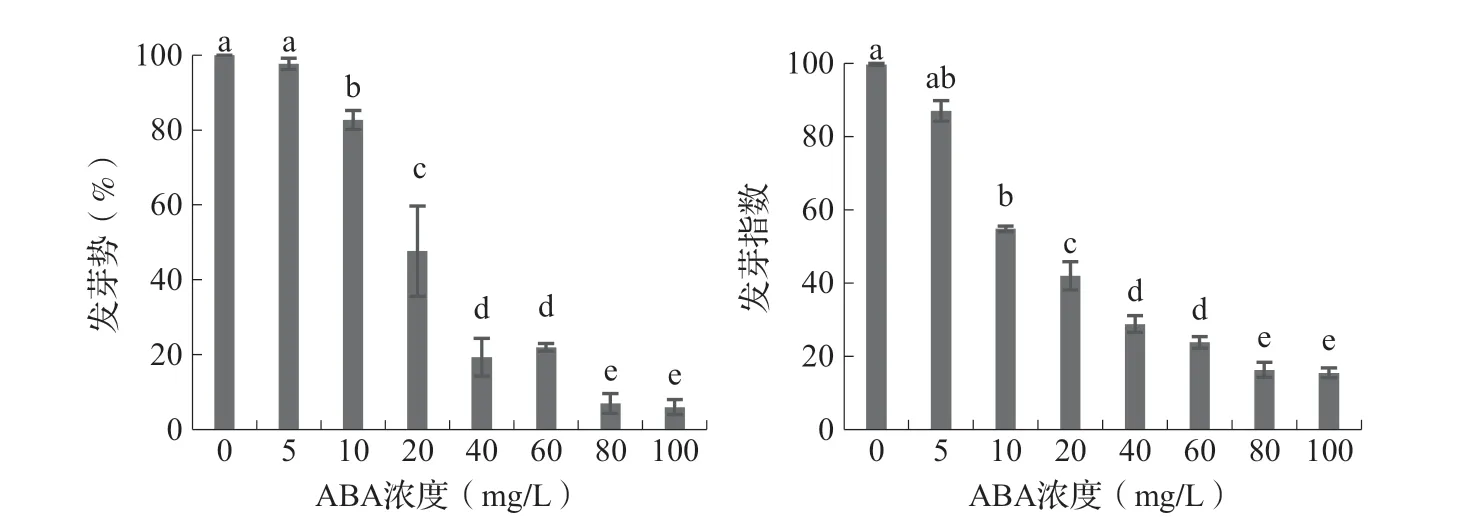
图2 不同浓度ABA 处理下藜麦种子的发芽势和发芽指数
2.3 ABA 对藜麦种子活力指数的影响种子的活力指数是发芽指数与幼苗根长的乘积,是种子发芽速率和生长量的综合反映,代表种子活力的强弱。如图3 所示,CK 处理种子活力指数最大,添加外源ABA 后,各处理与CK 相比差异均达到了显著水平,种子的活力受到抑制,随着ABA 浓度增大,各处理对藜麦种子萌发的抑制作用增强。
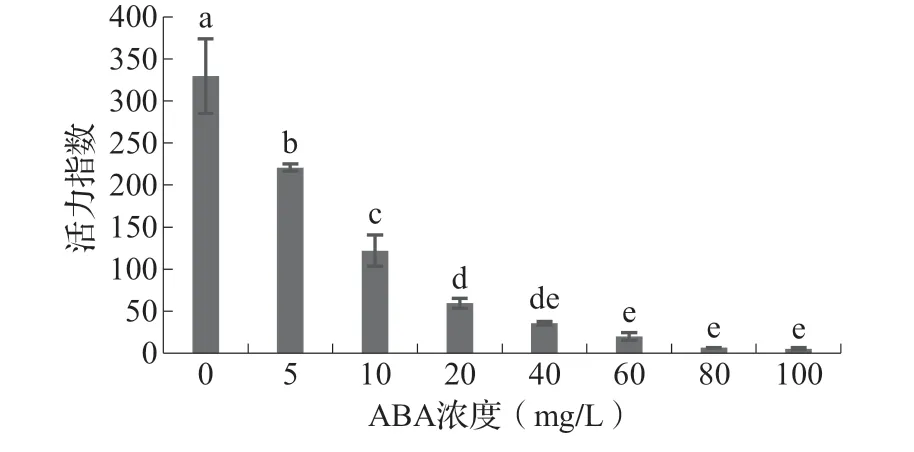
图3 不同浓度ABA 处理下藜麦种子的活力指数
2.4 ABA 对藜麦幼苗根长、苗高和鲜重的影响从表1 可以看出不同浓度外源ABA 处理抑制了藜麦幼苗根长、苗高、鲜重的增加,并且随着ABA 浓度的增加,抑制作用增强。与CK 相比,外源ABA处理藜麦幼苗根长减少均达到显著水平,≥20mg/L ABA 处理根长减少量均达到了50%以上,其中,80mg/L 和100mg/L ABA 处理减少量为88.22%和90.03%。藜麦幼苗苗高和鲜重在≥20mg/L ABA 的处理与CK 相比均达到显著水平,其中,80mg/L 和100mg/L ABA 处理藜麦幼苗苗高减少量为83.75%和86.68%,幼苗鲜重减少量为79.90%和83.71%。由此可见,在高浓度ABA 处理下,藜麦幼苗根长的减少量高于苗高和鲜重的减少量,说明高浓度外源ABA 对苗高的抑制作用小于根长。

表1 不同浓度ABA 处理下的藜麦幼苗根长、苗高和鲜重
3 结论与讨论
生长调节物质对作物籽粒发芽的调控,包括种子发育过程中对休眠的诱导、保持和解除到最初的萌发转变,以及种子萌发过程中贮藏物质代谢的调控等[20-22]。种子在萌发过程中要诱导种子胚芽细胞进行细胞分裂,打破种子的休眠,而ABA 可以阻碍种子胚芽细胞分裂,维持种子的休眠状态,从而抑制了种子的萌发[23]。
本研究发现高浓度ABA 可以抑制藜麦种子的萌发,藜麦种子的发芽势、发芽指数、活力指数以及幼苗根长、苗高和鲜重均受到影响,且随着ABA 浓度升高,对种子的抑制作用增强;低浓度ABA 对种子萌发无显著影响。汤日圣等[24]研究ABA 对水稻种子萌发的调控作用时发现用低浓度ABA(0.5~1.0mg/L)处理水稻种子后,水稻种子的发芽率变化不明显,但有效控制了水稻幼苗根和芽的伸长生长;用高浓度ABA(>5.0mg/L)处理水稻种子后,水稻种子的发芽率和幼苗根、芽的伸长生长受到了显著的抑制作用。黄益洪等[25]在研究ABA 对小麦种子萌发的调控作用时发现用高浓度ABA(80~100mg/L)处理小麦种子后,小麦种子的萌发被明显抑制,并且随着浓度升高,抑制作用增强。傅寿仲等[26]在研究油菜种子时,使用ABA 处理油菜种子后发现,油菜种子的萌发不受低浓度ABA(<40mg/L)的影响,但是在高浓度ABA(400~1500mg/L)处理下油菜种子的萌发受到显著的抑制作用。本研究结果与前人研究结果有类似之处,即藜麦种子萌发会受到外源ABA 的调控,低浓度ABA 调控种子萌发作用不明显,高浓度ABA 阻碍了种胚细胞分裂,维持住了种子的休眠,进而抑制了种子的萌发。
本研究揭示,外源ABA 可以抑制藜麦种子的萌发,高浓度ABA 处理下,藜麦种子的发芽势、发芽指数、活力指数以及幼苗的根长、苗高和鲜重均受到显著抑制,此外,80mg/L 和100mg/L ABA 处理的藜麦种子萌发起始时间比对照推迟2d,该研究结果可以为解决我国沿海地区藜麦田间发芽问题提供参考。
