基于SSR标记的芋头种质资源遗传多样性分析及抗疫病鉴定
2022-02-21郭巨先吴廷全李沐蓉姚春鹏李桂花罗文龙
郭巨先,吴廷全,李沐蓉,唐 康,姚春鹏,李桂花,罗文龙,王 瑞
(1广东省农业科学院蔬菜研究所/广东省蔬菜新技术研究重点实验室,广州 510640;2广东省农业科学院设施农业研究所,广州 510640;3华南农业大学,广州 510642)
0 引言
芋(Colocasia esculenta(L.)Schott)属于天南星科,是一种重要的粮菜兼用作物,被称为第五大根茎作物[1],具有重要的食用和医疗价值,为世界范围内广泛种植[2]。近年来,芋头产业迅猛发展,芋头资源的保护与利用研究也越来越受到重视。由于芋头栽培品种大多为无性繁殖,各地引进交流频繁,导致‘一种多名’或者‘一名多种’现象常见,但从表型难以准确分类。因此利用基因组信息对芋头种质资源进行遗传多样性分析及构建核心种质资源对芋头种质资源的保护利用尤为重要。另外,种植结构调整,由于芋头产值高,其栽培面积逐年扩大,而长期的无性繁殖导致芋头疫病呈现逐年严重的趋势,严重制约了芋头产业的发展[3]。目前已有报道的用于芋资源遗传多样性分析的研究分子标记有RAPD、AFLP、ISSR、SSR、SNP等[4-8],IRW IN等[9]利用PAPD标记将47个芋资源分为3大类群,发现亚洲品种与太平洋品种遗传距离较远。KREIKE等[10]利用AFLP标记对来自7个国家的255份芋头资源进行多样性分析,结果将其分为2大类,一类来自亚洲国家,另一类来自太平洋地区,且两类材料遗传距离较远;董红霞等[11]利用ISSR标记对72份芋种质资源进行多样性分析。在遗传系数0.725处,将72份芋种质资源聚为3大类,发现分子标记分类和形态学分类并不一致。胡侃等[12]利用SSR分子标记对105份芋头资源进行遗传相似性分析,将105份芋头资源划分为六大类。王直新等[13]利用SNP标记对二倍体芋资源进行遗传多样性分析,将69份芋资源分为5个类群。在芋头抗性鉴定方面的研究目前国内也仅有少量报道,周清平等[14]利用离体叶片人工接种病原菌孢子悬浮液的方法筛选到8个抗病品系,11个中抗品系,并认为离体叶片接种法是一种简洁快速鉴定芋头疫病抗性的方法。莫俊杰等[15]采用离体叶片人工接种方法对芋资源进行疫病抗性鉴定同时采用SSR分子标记方法进行多样性分析,筛选到8个抗或中抗品系。但是由于SSR标记有限,导致品种间差异没有很好的区分。随着芋头研究越来越受到研究者的重视,大量的SSR,SNP分子标记被开发出来[16-17],为芋头的进一步研究提供了很好的工具。本研究收集了来自国内多个省份的芋资源,为研究其遗传关系及不同类型芋头对疫病的抗性,拟采用100对SSR分子标记对其进行聚类分析,并利用人工接种芋疫霉菌鉴定其抗性。本研究的开展为更好的利用保护,鉴评种质资源及其创新利用提供理论依据。
1 材料与方法
1.1 试验材料
试验所采用的109份芋头种质材料由广东省农业科学院蔬菜研究所搜集。试验在广东省蔬菜新技术研究重点实验室完成。时间于2010—2021进行。
1.2 试验方法
1.2.1 DNA的提取 供试材料于2019年种植于广东省农业科学院白云试验基地。取苗期幼嫩叶片于2m L离心管中。于磨样机磨碎后用CTAB法提取DNA,用核酸测定仪测定DNA浓度,稀释至工作浓度,-20℃保存备用。
1.2.2 标记来源 所用100对引物为文献[18]公布。采用10份表型差异大的材料进行引物筛选,选择条带清晰,重复性较好,多态性丰富的SSR标记用于进一步遗传多样性分析。
1.2.3 SSR扩增体系及检测
(1)扩增体系为10μL,其中1μL为模板。
(2)PCR扩增程序。94℃预变性5 m in,95变性30 s,55℃退火30 s,72°C延伸40 s,35个循环后,72℃延伸7m in,然后置于4℃冰箱保存待检测。
(3)电泳检测。PCR扩增产物在浓度为8%的双垂直非变性聚丙烯酰胺凝胶上电泳分离,120 V稳压1.5 h,电泳结束后进行银染显色,拍照保存分析。
1.3 数据分析
根据电泳图谱进行数据统计与整理,有条带记为“1”,无条带记为“0”,条带缺失记为“9”,构建数列矩阵,用DataFormater软件将读取的数据进行转换[19]。用Popgene 32软件计算观察等位基因数(No)、有效等位基因数(Ne)、Nei’s基因多样性指数(H)、Shannon’s多态信息指数(I)。利用生物学统计软件DPS中遗传聚类模块,基于Jiccard方法进行材料间的遗传距离计算,得到遗传距离矩阵,利用MEGA11软件以类平均法(UPGMA)进行聚类分析,绘制聚类图[20]。
1.4 疫病抗性鉴定
1.4.1 病原菌的分离 从白云基地芋头田块取发病芋头叶片于实验室分离。从病健交接处剪取1×1 cm小块于70%酒精快速消毒5 s,移入0.1%升汞溶液20 s后移到无菌水中清洗。后用灭菌滤纸将表面水分吸干,置于V8培养基(加入利福平与卡那霉素)上,于28℃恒温箱培养3天。挑去外围菌丝转接到新的V8培养基上,培养3天,挑去菌丝提取基因组DNA。以通用引物ITS1、ITS4扩增特异条带,确定菌株[16]。
1.4.2 接种方法 参考莫俊杰等[15]采用离体叶片接种。取芋头植株第二新鲜叶片,平铺托盘中,取培养3天的芋头疫霉菌块(沿菌盘边缘打孔直径0.5 cm)置于叶片中间位置,躲开主叶脉,每个材料接种3片叶子。保鲜膜封闭托盘保湿。置于28℃恒温箱中培养。接种5天后测量病斑直径。
1.4.3 抗性评价方法 参考莫俊杰等[15]利用离体叶片鉴定芋头对疫病的抗性分级评价标准。即病斑直径大于40mm为感病,21~40mm为中等抗病,小于20mm为抗病。
2 结果与分析
2.1 引物的筛选及遗传多样性分析
本研究用10份表型差异大的芋头资源对100对SSR引物进行筛选,获得了21对多态性丰富,条带清晰,稳定性好的引物组合,利用这21对引物对109份芋头种质资源进行遗传多样性分析。21对SSR引物在109份芋头资源共扩增71个等位基因,变幅在2~4个,平均等位基因数3.38。观测杂合度(Ho)变化范围为0.0481~0.8900,平均为0.3483;预期杂合度的变化范围(He)0.0841~0.6709。平均为0.3794,种群平均Shannon遗传多样性指数为0.6733。遗传距离在0~1之间,平均遗传距离为0.6014。Shannon指数的平均值大于0.5,说明供试芋资源的遗传多样性比较丰富(表1、表2)。

表1 引物序列
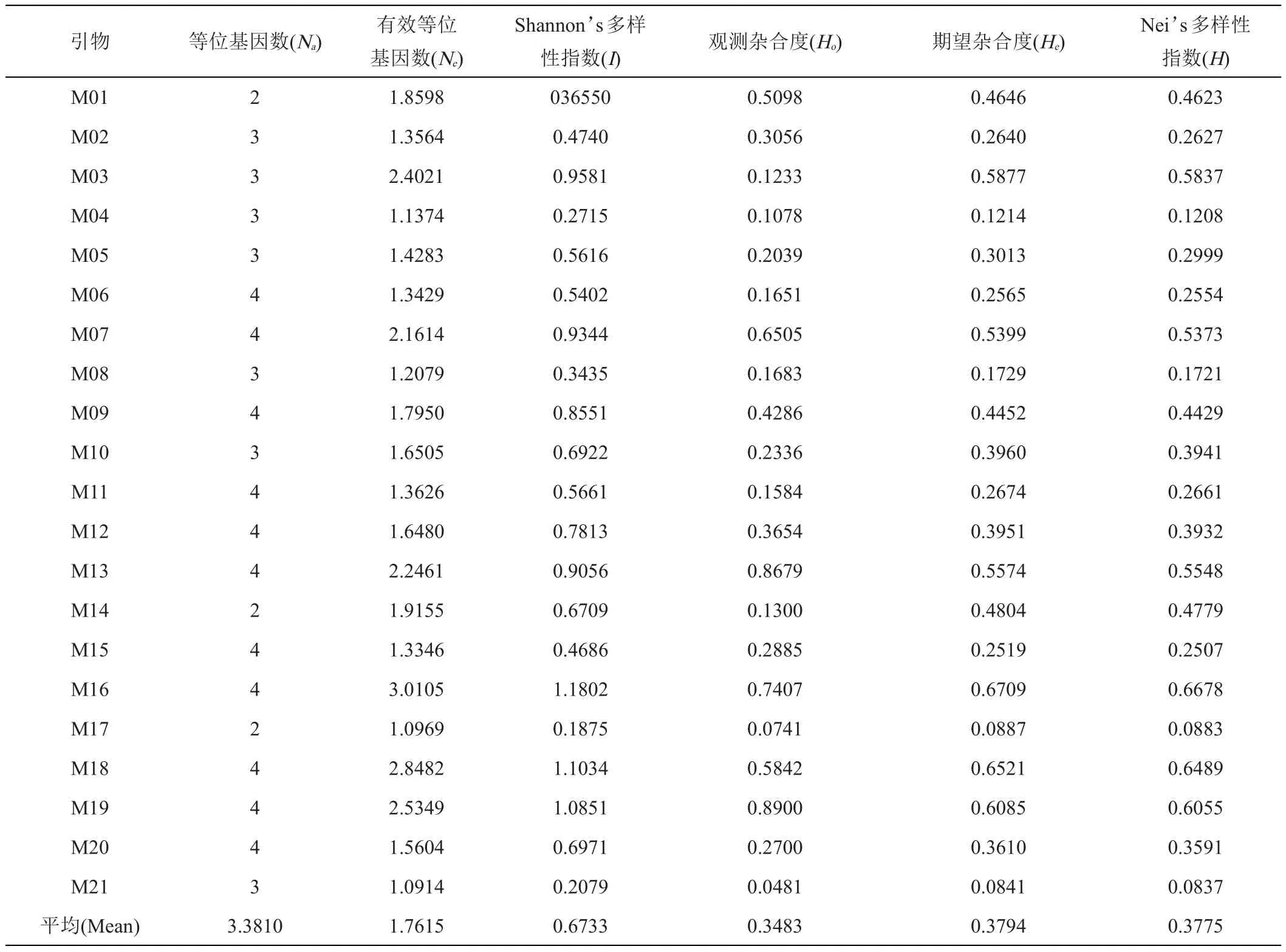
表2 21对SSR在109份材料中的遗传多样性参数
2.2 抗病性鉴定
根据109份芋头种质资源对芋头疫霉菌的抗性鉴定结果,发现大部分芋头资源表现为感病,只有7份材料表现为中抗(NO.12、NO.19、NO.22、NO.35、NO.43、NO.49、NO.64),4 份 表 现 为 抗 病 (NO.40、NO.45、NO.59、NO.97),仅占10%。其中表现中抗的NO.43、NO.19是来自广东地区的地方品种,而表现为抗病的NO.40、NO.45、NO.59、NO.97为来自云南八达的地方品种。从抗病类型来看,魁芋表现抗病的品种比较多,占88%。大部分多子芋表现为感病。缺乏优良的疫病抗性资源,也是芋疫病严重影响芋头产业发展的重要原因。
2.3 聚类分析
基于Jaccard方法进行遗传距离计算,利用UPGMA方法对109份芋头种质材料进行聚类分析,结果表明,利用21对SSR标记可以将109份芋头资源相互分开,在遗传距离0.49处可以将供试材料分为3个大类群(图1)。I为第1类群,II为第2类群,III、IV、V、VI、VII为第3大类群;在遗传距离在0.30处可将第3类群分为两个小类群。将类群III与IV、V、VI、VII分开。类群I由来自同一个地方的三个材料(NO.43、NO.19、NO.31)组成,是来自广东的地方品种。能明显与其他品种分开,可能是这些地方品种保留了较为丰富的遗传变异。类群II除NO.54外其他5个材料均来自云南,人工接种芋头疫霉菌显示该类群大多数表现为抗性。类群III以多子芋为主,IV以魁芋为主,V为来自海南的多头芋,VI以香芋为主,VII以多子芋为主(表3)。从聚类图可以发现,除I类群和II类群的地方品种外,其他来自全国各地的的芋头品种能够按类别分别聚在一起,比如,浅蓝色大多为多子芋,紫色部分为香芋,橙色部分为多子芋。说明本研究选择的引物多态性好,区分度强,而地理来源对其聚类影响不明显。这与前人研究结果相似[7,21]。
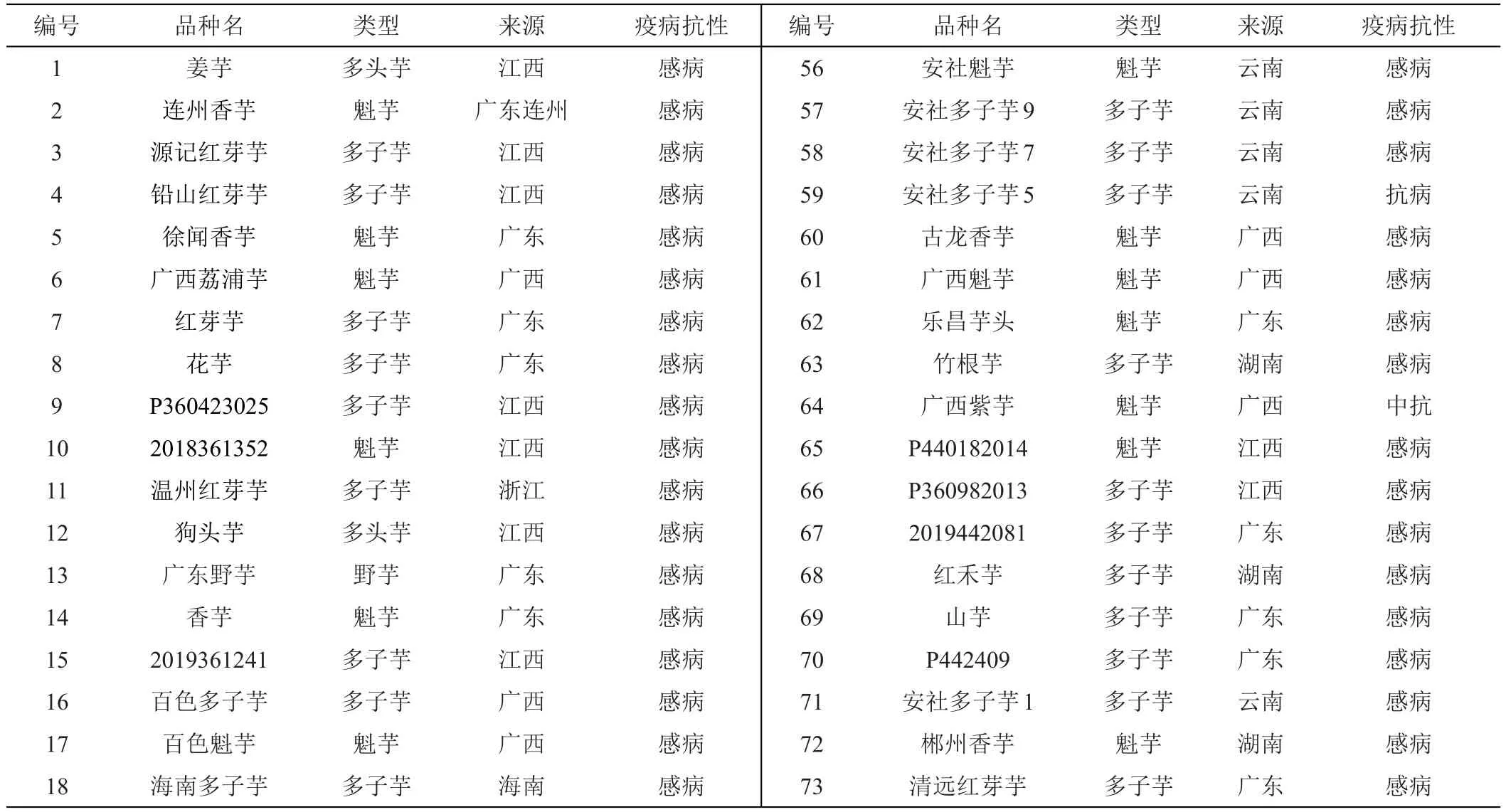
表3 109份芋资源信息

续表3

图1 109份芋种质资源SSR分析聚类图
3 讨论
3.1 芋头资源遗传多样性分析
芋头资源丰富,全世界芋头品种有700多种。作为芋头的起源地之一,中国也有芋头品种400多种[22],虽然拥有丰富的种质资源,但是由于芋头大都采用无性繁殖,或者农户自留种,导致种性退化严重,大量资源流失严重[23]。及时有效的对种质资源评价和分析,对芋种质资源的保护和利用具有重要的意义。以往研究者大多采用 RAPD[5]、AFLP[4]、ISSR[11]标记进行遗传聚类分析。SSR作为稳定高效、多态性高、准确快速的分子标记已经被广泛用于植物多样性分析、品种鉴定、指纹图谱构建等多种方面。然而,由于芋资源研究基础薄弱,目前在芋资源开发的分子标记仍旧较少。有研究者[12,15]以少量SSR标记对芋资源进行遗传多样性分析,没有达到很好的效果。本研究利用新开发的100对SSR引物,从中筛选重复性好,多态性高的引物21对,对109份芋资源进行多样性分析,将不同类型的芋资源进行了很好的区分。
本研究所收集芋资源主要为球茎用芋类型。从上述遗传聚类可以看出,大部分的芋头资源遗传距离较近,相似度大。虽然来自不同的地区,但是种性差异不明显,遗传背景较窄。例如:来自浙江温州多子芋NO.11与来自云南的多子芋NO.103具有相近的遗传距离,遗传分类聚在一起。这跟目前物流发达,各地资源交流频繁有关,但是频繁交流也限制了地方特色品种的发展。另外,前人研究野生资源与栽培种的亲缘关系较远,只有个别野生资源与栽培种聚在一起,本研究中搜集的2个野生芋种(NO.13、NO.103)均与栽培种聚在一起。其原因可能是该野生种资源数量较少,不具有代表性;另外,可能这些栽培种就是通过该野生种不断演化而来,这与沈镝等[6]研究结果相似。同时我们研究得出大部分资源不以地域差异进行分类,但是少部分地方性材料却与地理来源紧密相关。像来自广东的NO.43、NO.19、NO.31来自海南的NO.44与NO.18具有明显的地域特点。特别是NO.43、NO.19和NO.31与其它芋种质资源亲缘关系较远,说明这3个品种在长期的遗传进化过程种保留了自身独特的遗传背景,具有很好的利用价值。
3.2 遗传聚类与品种抗性的关系
芋疫病在世界范围内均有发生,是芋头生产上最具破坏性的病害之一[24]。国外研究者对鉴定方法,病原菌的多样性均有研究[25-28],在中国对芋疫病研究起步较晚,大都集中在芋疫病的发生和防治方面[29-30]。资源抗性鉴定相关报道较少,目前仅有周清平和莫俊杰等在芋头抗性鉴定方面进行了研究,但是两者采用了不同的鉴定方法和评价标准,无法对其结果进行比较。本研究采用了莫俊杰等相同的鉴定方法,均发现广东地区存在抗性品种。由于本研究搜集芋资源范围更广,因此还发现云南八达也具有抗病品种。同时在本研究还发现,在供试的109份芋资源中抗性材料虽然不多,仅占10%,但是绝大部分抗性材料集中在第I类(NO.43和 NO.19)和第 II类(NO.59、NO.97、NO.64、NO.40),占抗性资源的60%,占两类群资源的75%。说明这两个来自地方品种的类群具有优良的抗性基因,具有很高的利用价值。
3.3 存在问题
芋资源丰富多样,本研究搜集资源虽然来自全国各地,但是其并不能包含所有芋类型。由于搜集者专业知识有限,描述性状标准不一,加之不同地方对同一资源的叫法不同,造成很多资源重复命名的现象,这也给后续分子标记分析带来许多困扰。随着种质资源保护越来越受重视,芋资源基础研究也会不断得到重视。建议建立国内统一的评价标准,加强基础研究及种质资源的精深鉴评,对芋资源的保护和利用至关重要。
4 结论
本研究利用21对SSR引物对109份芋种质资源进行遗传多样性分析,同时利用离体叶片人工接种芋头疫霉菌的方法对109份芋资源进行了抗病性鉴定。在遗传距离0.49处可以将供试材料分为3个大类群。人工接种芋疫霉菌鉴定结果发现大部分抗性材料集中在第I类和第II类群中。这些抗性资源是来自广东和云南的地方品种,以魁芋类型较多。这对中国芋头资源的利用和抗性育种具有重要的意义,同时也为我们寻找抗性关联基因奠定了基础。
