鸡场铜绿假单胞菌外毒素A 基因遗传变异分析
2022-02-21穆英丽李玉荣刘聚祥王学静陈立功
穆英丽,张 芳,解 佳,李玉荣,刘聚祥,3,王学静,4,陈立功,3
(1.河北农业大学 动物医学院,河北 保定 071001;2.保定市动物疫病预防控制中心,河北 保定 071051; 3.农业农村部动物疫病病原生物学华北科学观测实验站,河北 保定 071001;4.河北省畜牧兽医研究所, 河北 保定 071000)
假单胞菌科、假单胞菌属的铜绿假单胞菌(Pseudomonas aeruginosa,PA)是一种革兰氏阴性、条件致病菌[1],广泛分布于空气、水、土壤中、健康人和动物的肠道和皮肤上,也易从尿道感染、烧伤、外伤、长期使用免疫抑制剂或放化疗患者发现[2]。感染PA 的伤口可形成蓝绿色脓液,故俗称其为绿脓杆菌。PA 不仅可感染、损伤禽类、哺乳动物、爬行类和鱼类的多种组织、器官[3],还能致人的脓胸和烧伤患者的院内感染[4-5]。PA 能产生外毒素A(Exotoxin A,ETA)、内毒素、弹性蛋白酶、胶原酶、胰肽酶等多种与毒力有关的物质,其中ETA 是一种毒力很强的致死性外毒素,也是该菌最主要的致病因子[6]。ETA 是由toxA 基因编码,成熟的ETA 分子是由613 个氨基酸组成的单链蛋白。Allured 等[7]研究发现,ETA 含3 个不同结构功能区:氨基端由Ia(1-252 AA)和Ib(365- 404AA)组成的I 区,具受体识别功能,与靶细胞表面受体蛋白的结合有关;由253- 364 AA 组成的中央部分为II 区,与毒素跨膜转运有关;羧基端由405-613 AA 组成的III 区,具ADP 核糖基转移酶活性(ADP-ribosyltransferase,ADPRT)[8-9],抑制靶细胞中的蛋白质合成。近年来,有关鸡PA 的报道逐渐增多[10-12],但鲜见关于鸡场铜绿假单胞菌毒力因子的研究报道。本研究在对PA分离鉴定的基础上,分析了鸡场PA 的ETA 蛋白基因变异情况,该结果可为PA 致病机理研究及其防控措施制定提供参考依据。
1 材料与方法
1.1 生物材料
自2014 年1 月至2018 年2 月从河北省及周边地区鸡场采集水样、鸡鼻腔分泌物、气囊、心脏、肝脏等病料。铜绿假单胞菌标准菌株(ATCC27853)为河北农业大学张伟教授惠赠。
1.2 主要试剂
营养琼脂培养基、营养肉汤、麦康凯培养基、十六烷三甲基溴化铵琼脂(CA)、绿脓菌素测定用培养基(PDP)均购自杭州天和微生物试剂有限公司。细菌基因组DNA 小量纯化试剂盒(MiniBEST Bacterial Genomic DNA Extraction Kit Ver.2.0)、Tks GflexTM Polymerase 等试剂均购自大连宝生物(TaKaRa)工程有限公司。
1.3 细菌分离、鉴定
参照文献[10]方法对采集的水样及病料进行细菌分离培养。
1.4 16S rRNA 基因与ETA 蛋白基因的扩增及测序
根据铜绿假单胞菌16S rRNA 序列(GenBank 登录号:HQ202541.1)和国际标准产毒菌PA103 株的ETA 基因序列(GenBank 登录号:K01397.1)各设计1 对引物(见表1)。2 对引物均由生工生物工程(上海)股份有限公司合成。

表1 PCR 相关引物Table 1 PCR related primers
参照细菌基因组DNA 小量纯化试剂盒说明书进行PA 分离菌的基因组DNA 提取。16S rRNA 基因PCR 扩增体系为50 μL:10×PCR Buffer 5 μL、上下游引物各2 μL、dNTPs 4 μL、DNA 模板2 μL、Taq DNA 聚 合 酶 0.5 μL,dH2O 34.5 μL。PCR 程序:94 ℃预变性5 min; 94 ℃变性45 s,52 ℃退火30 s,72 ℃延伸75 s,循环35 次;72 ℃延伸10 min。ETA 基因PCR 扩增体系为25 μL:2× Gflex PCR Buffer 12.5 μL、上下游引物各1 μL、DNA 模板2 μL、Tks Gflex DNA Polymerase 0.5 μL,加 入dH2O 至总体积为25 μL;PCR 扩增程序为:94 ℃ 1 min;98 ℃ 10 s、60 ℃ 15 s、68 ℃ 2 min,进行30 个循环。PCR 扩增产物经1.0%琼脂糖凝胶电泳分析后,将PCR 阳性产物送生工生物工程(上海)股份有限公司进行双向基因测序。
1.5 16S rRNA 基因与ETA 蛋白基因遗传进化分析
PA 分离菌16S rRNA 基因测序结果经拼接验证,应用DNAStar 分析软件对7 株PA 分离菌的16S rRNA 基因序列(基因登录号分别为MZ707717.1、MZ707718.1、 MZ707719.1、 MZ707720.1、MZ707721.1、 OK298396.1、 OK298395.1)与10株PA 参考菌株(基因登录号分别为AY905552.1、KF447771.1、EU081518.1、HM036358.1、HQ023428.1、KT869138.1、NR_113599.1、NR_114471.1、NR_117678.1、DQ864493.1)、1 株大肠杆菌(基因登录号为AJ567540.1)、1 株沙门菌(基因登录号AB188789.1)、1 株巴氏杆菌(基因登录号AY078998.1)、1 株鸡副嗜血杆菌(基因登录号为GU737687.1)、1 株金黄色葡萄球菌(基因登录号L37597.1)和1 株链球菌(基因登录号LC613243.1)的16S rRNA 基因序列进行比较和同源性分析,用MEGA7 软件绘制针对16S rRNA 基因序列的遗传进化发生树,并进行遗传进化分析。
PA 分离菌ETA 基因测序结果经拼接、验证,截取成熟的ETA 结构蛋白基因全长,应用DNAStar分析软件对7 株PA 分离菌的ETA 基因序列及其推导的氨基酸序列与GenBank 中27 株PA 参考菌株相应序列进行比较和同源性分析;用MEGA7 软件绘制针对ETA 基因序列的遗传进化发生树,分析PA ETA 基因遗传变异情况。
2 结果与分析
2.1 细菌的分离、鉴定结果
自2014 年1 月至2018 年2 月从河北省及周边地区鸡场水样和病鸡分离、纯化7 株细菌分离物,根据培养特性、菌落特征初步判定为PA。经PCR方法扩增7 株分离菌的16S rRNA 基因序列,电泳条带与预期目的条带大小相符(见图1)。测序结果经拼接、验证得到7 株分离菌的16S rRNA 基因序列。序列分析结果表明,7 株分离菌之间的16S rRNA 基因序列同源性为99.9%~100.0%;7 株分离菌与10 株PA 参考菌株之间核苷酸序列同源性为99.4%~100.0%,与大肠杆菌、沙门菌、巴氏杆菌、鸡副嗜血杆菌、金黄色葡萄球菌和链球菌之间核苷酸序列同源性仅为79.9%~86.4%。遗传进化分析结果表明,7 株分离菌的16S rRNA 基因与10 株PA 参考菌株遗传距离较近;与大肠杆菌、沙门菌、巴氏杆菌、鸡副嗜血杆菌、金黄色葡萄球菌和链球菌遗传距离均较远(见图2),因此,判定7 株分离菌均为PA。

图1 铜绿假单胞菌16S rRNA 基因PCR 产物电泳结果Fig. 1 The electrophoresis result of PCR product of 16S rRNA gene of PA

图2 铜绿假单胞菌16S rRNA 基因遗传发生树Fig.2 Phylogenetic tree of 16S rRNA gene of PA
2.2 ETA 蛋白基因PCR 及测序结果
经PCR 方法成功地扩增出7 株PA 分离菌的ETA 基因序列,电泳均可见长约2 000 bp 的特异条带,其大小与预计的相吻合(见图3)。

图3 铜绿假单胞菌ETA 基因PCR 产物电泳结果Fig. 3 The electrophoresis result of PCR product of ETA protein gene of PA
测序结果经拼接、验证得到7 株PA 分离菌成熟的ETA 结构蛋白基因:PA-47 株ETA 结构蛋白基因长1 824 bp,编码608 个氨基酸;其余6 株分离菌均为1 839 bp,编码613 个氨基酸。
2.3 ETA 蛋白基因遗传进化分析结果
2.3.1 ETA 蛋白基因序列分析结果 7 株PA 分离菌的ETA 基因之间核苷酸和氨基酸同源性分别 为99.0% ~100.0%,99.0% ~100.0%, 其 中PA-47 株与PA-49 株的核苷酸和氨基酸同源性均最高,为100.0%;PA-1 与PA-4 株之间氨基酸同源性最高,为100.0%。与27 株PA 参考菌株之间核苷酸和氨基酸同源性分别为98.9%~100.0%,98.5%~100.0%。序列分析结果表明,7 株PA 分离菌成熟的ETA 结构蛋白基因共有多处碱基位点发生了变异,其中包括PA-47 株第106-110 位15 个碱基的连续缺失和10 处错义突变(见表2)。
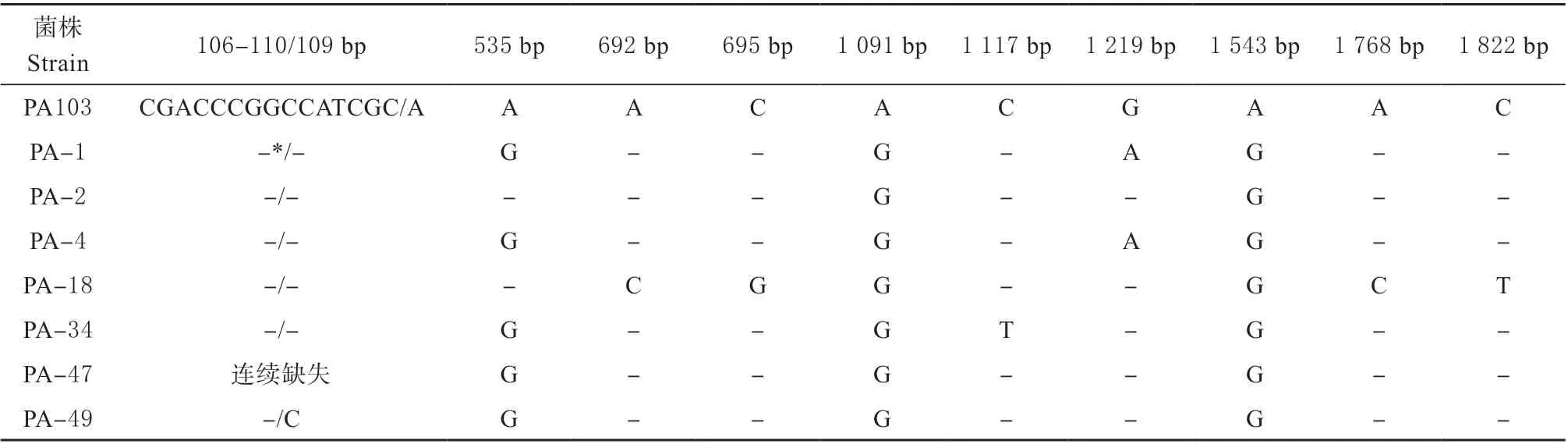
表2 铜绿假单胞菌ETA 基因核苷酸突变比较结果Table 2 Comparison of nucleotide mutations of PA ETA gene
氨基酸序列分析表明,PA-1 和PA-4 株的ETA 氨基酸变异位点(T179A、N364S、V407I、S515G)与NCTC10299 株完全相同;PA-47 株的氨基酸变异位点(33-37 位连续缺失、T179A、N364S、S515G) 与AR458、A681 和PAAK088 株完 全 相 同;PA-49 株(T37P、T179A、N364S、S515G)与SE5416 和NCTC10728 株 完 全 相 同;PA-2 株 存 在N364S 和S515G 变 异;PA-34 存 在T179A、N364S、P373S 和S515G 变 异;PA-18 存在N231T、P232R、N364S、S515G、K590Q 和P608S 变异(见表3)。此外,7 株PA 分离菌第426 位(H)、第440 位(H)、第470 位(Y)、第481 位(Y)、第553 位(E)和第558 位(W)氨基酸残基均未发生突变。

表3 铜绿假单胞菌ETA 氨基酸残基比较结果Table 3 Comparison of ETA amino acid residues of PA
2.3.2 ETA 蛋白基因遗传进化分析结果 遗传进化分析结果表明,34 株PA ETA 基因可分成2 个群(Ⅰ~Ⅱ),除P49 London 株位于Ⅱ群外,7株PA 分离菌与其余26 株参考菌株均位于Ⅰ群。PA-47、PA-49 株 与AR458、A681、PAAK088、NCTC10728、PA99、SE5416、DVT779 株均位于第1 大分支;PA-1、PA-4 株与NCTC10299、PAG5、SE5443、PABCH13 株均位于第4 大分支;PA-34、PA-2、PA-18 株分别位于第2、3、5 大分支(见图4)。

图4 铜绿假单胞菌ETA 基因遗传发生树Fig.4 Phylogenetic tree of PA ETA gene based on its encoded amino acid sequences
3 结论与讨论
近年来,关于从发病动物分离的铜绿假单胞菌报道越来越多,该细菌组织嗜性广泛、致病力较强,给动物健康养殖和人类健康均带来了巨大威胁。16S rRNA 基因扩增与序列分析结果证实,从河北省及周边地区鸡场水样和病料纯化的7 株细菌分离物均为PA。高 GC 模板形成的稳定二级结构可阻抑DNA 聚合酶在模板上的推进,此类模板上可能存在的多个非特异性引物局部复性位点会产生非特异性扩增[13],这就使PCR 过程中用普通DNA 聚合酶从高GC 模板中扩增长片段 DNA 序列较困难。鉴于铜绿假单胞菌基因组GC 含量较高[14],由 toxA 基因编码的ETA 基因长度大于1 500 bp,故本研究对7 株ETA 蛋白基因进行PCR 扩增时选用了Tks Gflex DNA Polymerase。
研究表明,第426 位组氨酸[15]、第553 位谷氨酸及558 位色氨酸[16-17]对于ETA Ⅲ区的ADPRT 活性是必须的。其他研究[18-21]证实,第440 位组氨酸、470 位和481 位酪氨酸对ETA 的酶活性及细胞毒性是重要的。本研究结果表明,7 株PA 分离菌ETA 酶活区上述位点的氨基酸均未发生突变,这与李雅林等[22]报道结果一致。值得注意的是,来自鸡场的PA-18 株分离菌ETA Ⅲ区氨基酸存在S515G、K590Q 和P608S 突变,这3 个位点的突变与从脓胸病人痰液中分离的PA-SD 株均完全一致[22]。第590 位由碱性氨基酸变成了酸性氨基酸,这种变化很可能改变ETA 蛋白的α 螺旋,从而改变其功能。Claude 等[4]和李雅林等[22]曾先后报道,第515 位氨基酸突变(S515G)与铜绿假单胞菌脓胸分离株的ADPRT 活性减少密切相关。与标准产毒菌PA103 株相比,本研究中7 株PA 分离菌酶活区氨基酸序列均存在S515G 突变,该突变是否与PA 的ADPRT 活性有关?此外,鸡场分离的PA-18 株的P608S 突变与ETA 的致病特性之间的关系如何?以上问题值得进一步深入研究。
本研究遗传进化分析结果显示,自辽宁大连地区某鸡场分离的PA-49 株ETA 基因与河北石家庄地区分离的PA-47 株遗传距离较近,与河北衡水、保定、沧州和邯郸地区分离的其他5 株PA 分离菌遗传距离较远,ETA 基因遗传进化是否与地域相关?这些问题尚需进一步研究。
河北及周边地区鸡场鉴定的7 株PA 分离菌成熟的ETA 结构蛋白基因多处碱基位点发生变异,包括PA-47 株第106-110 位15 个碱基的连续缺失和10处错义突变;其ETA 蛋白共有6 种不同的氨基酸变异位点模式;第426 位(H)、第440 位(H)、第470位(Y)、第481 位(Y)、第553 位(E)和第558 位(W)氨基酸残基均未发生突变,均为有毒形式。
