高效液相色谱法快速测定大黄鱼中非法染料硫代黄素
2022-02-21郑文静赵慧男孙珊珊薛霞刘艳明张艳侠
郑文静,赵慧男,孙珊珊,薛霞,刘艳明*,张艳侠*
1. 山东省食品药品检验研究院(济南 250101);2. 山东省食品药品安全检测工程技术研究中心(济南 250101)
大黄鱼作为我国特有的经济鱼类,因其肉鲜味美,蛋白质、微量元素以及ω-3脂肪酸含量丰富,且具有较高的药用价值,深受消费者喜爱[1]。由于其保鲜期短、产量低,大黄鱼尤其是野生黄鱼往往供不应求。硫代黄素也称为碱性黄1、硫磺素T,是一种苯并噻唑类化工染料,主要用于生物领域的组织染色[2],其化学结构见图1。根据《食品中可能违法添加的非食用物质和易滥用的食品添加剂品种名单(第五批)》的相关规定,硫代黄素为禁止用作食品添加剂的化学制品[3]。但其由于价格低廉、染色效果好,受利益驱使、不法商贩使用硫代黄素等黄色化工染料对劣势黄鱼或伪黄鱼进行染色,染色后鱼体色泽鲜艳,不易褪色,从而达到以次充好、以假乱真的目的。近年来“黄鱼造假”食品安全事件屡屡发生。过量食用此类问题黄鱼,会对人体肾脏、肝脏造成损伤,具有致癌、致畸变性的风险,严重威胁消费者的身体健康[4]。为有效监控大黄鱼中硫代黄素的违法添加,建立快速准确的相关检测方法尤为必要。
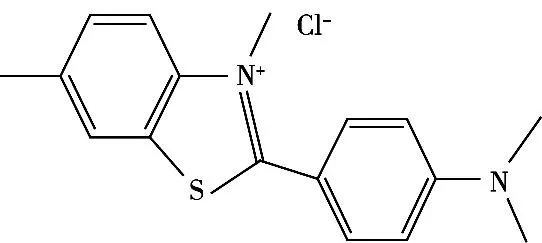
图1 硫代黄素的化学结构
关于大黄鱼中硫代黄素的检测尚无统一的相关国家、行业检验标准,相关的分析检测也少有报道,仅有一篇文献报道,且在样品提取和净化方面存在一定局限性[2]。食品中合成色素和工业染料的分析方法主要有分光光度法[5-6]、薄层色谱法[7]、液相色谱法[8-10]和液相色谱-串联质谱法[11-14]等。分光光度法设备简单,操作方便,但存在特异性低、灵敏度低的问题。薄层色谱法自动化程度低,定量精度和重现性较差。液相色谱-串联质谱法灵敏度高,但成本较高,样品处理要求严格,影响了方法的普及应用。相比之下,高效液相色谱法具有分析速度快、检测灵敏度高、定量分析准确及适用性好等特点,是目前食品领域量化分析合成色素和工业染料最常用的检测方法。
试验建立一种简便、灵敏、准确的高效液相色谱测定大黄鱼中非法染料硫代黄素的方法,对目标物稳定性进行了考察,优化提取溶剂及净化方式,同时优化色谱条件,提高目标物的回收率及方法稳定性。该方法的建立为有效遏制大黄鱼中硫代黄素的非法添加行为和产品安全风险预警提供技术支持。
1 材料与方法
1.1 材料与仪器
Waters 2695高效液相色谱仪(配备Waters 2998二极管阵列检测器,美国Waters公司);AB204-S型电子天平(瑞士Mettler Toledo公司);SB-800DTD型超声波清洗器(中国宁波新芝生物科技股份有限公司);3-18K型冷冻离心机(德国Sigma公司);Milli-Q超纯水制备器(美国MILLIPORE公司);涡旋混合器(德国IKA公司);XBridge C18色谱柱(150 mm×4.6 mm,3.5 μm,美国Waters公司)。
标准品:硫代黄素(纯度≥99%,天津阿尔塔科技有限公司)。甲醇、乙腈、正己烷(色谱纯,德国Merck公司);甲酸(分析纯,国药集团化学试剂有限公司)。
大黄鱼样品(均为市售)。
1.2 试验方法
1.2.1 标准溶液的配制
准确称取10 mg(精确至0.01 mg)硫代黄素标准品,用80%乙腈水(V/V)溶解并定容至10 mL,配制成质量浓度为1 mg/mL的标准储备溶液,转移至密闭棕色容器中,置于4 ℃冰箱中避光贮存。
将硫代黄素标准储备溶液用80%乙腈水(V/V)逐级稀释,配制成质量浓度为0.05,0.1,0.2,1,5,10,20和50 μg/mL的标准中间液,转移至密闭棕色容器中,置于4 ℃冰箱中避光贮存。
1.2.2 样品前处理过程
称取2 g(准确至0.01 g)样品于50 mL离心管中,加入20 mL 80%乙腈水(V/V)溶液,涡旋混匀,超声提取15 min;加入10 mL乙腈饱和正己烷,振摇1 min后,按8 000 r/min离心5 min,取下层清液,用0.22 μm微孔滤膜过滤后待测。
1.2.3 色谱条件
色谱柱Waters® XBridge(3.5 μm,150 mm×4.6 mm)。流动相:A甲醇,B 0.02%甲酸水;采用梯度洗脱程序,梯度条件见表1。流速0.8 mL/min;进样体积10 μL;检测波长418 nm;柱温35 ℃。

表1 流动相梯度程序
1.3 数据处理
通过与仪器配套的Empower 3色谱数据处理系统完成数据采集与处理,采用Origin 8.5分析软件进行数据处理和绘图。
2 结果与分析
2.1 硫代黄素稳定性考察
正确配制标准溶液是保证试验结果准确性的前提。在硫代黄素检测过程中,研究发现用水配制的硫代黄素标准中间液12 h内响应面积降低明显,导致定量不准,影响试验结果。同时,这种现象也可能会导致试验前处理过程中硫代黄素回收率失真,试验结果准确度降低。因此,对不同配制试剂中的硫代黄素的稳定性进行考察,保证试验结果准确可靠。
硫代黄素作为一种碱性苯并噻唑类化合物,在水中的稳定性可能与其pKa有关,分别用不同pH的水溶液配制10 μg/mL水平的硫代黄素标准工作液,对其稳定性进行考察。结果显示:硫代黄素在碱性水溶液中不稳定,在4 ℃冰箱内储存一周后响应面积降低20%;在pH 2~7的水溶液中较稳定,响应面积无明显变化。基于部分液相色谱仪的进样系统无法实现控温的条件,进一步比较室温下硫代黄素在pH 2~7范围内的水溶液中的稳定性。如图2所示,硫代黄素在pH 2条件下48 h内稳定。通过对硫代黄素结构(图1)分析可以看到,其结构为2-苯并噻唑环与1个对二甲氨基苯基相连,推测可能是在一定的pH范围内2-苯并噻唑环处容易开环降解,造成其在不同pH下的稳定性不同,而低温可能会延缓其降解过程。
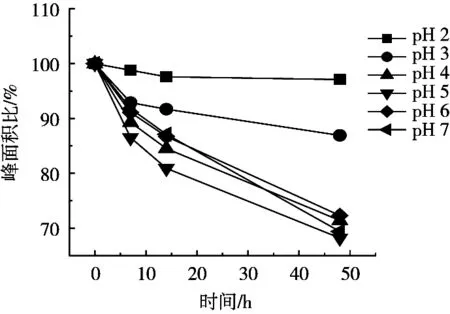
图2 不同pH水溶液中硫代黄素含量变化图
pH过低会影响色谱柱的使用寿命,考虑到色谱柱的pH耐受性,试验考察乙腈-水中的硫代黄素的稳定性,对超纯水,20%,50%和80%(V/V)乙腈水溶液,纯乙腈配制的硫代黄素标准液48 h内的响应面积进行分析,结果如图3所示。乙腈比例高于50%的硫代黄素标准液均稳定。分析原因是乙腈本身不易解离,有利于硫代黄素中苯并噻唑环结构的稳定,因此,乙腈比例高时硫代黄素呈现稳定的状态。由于纯乙腈配制的硫代黄素标准液在液相色谱分析中存在溶剂效应,出现峰变形的现象,最终采用80%乙腈水溶液配制硫代黄素标准液。
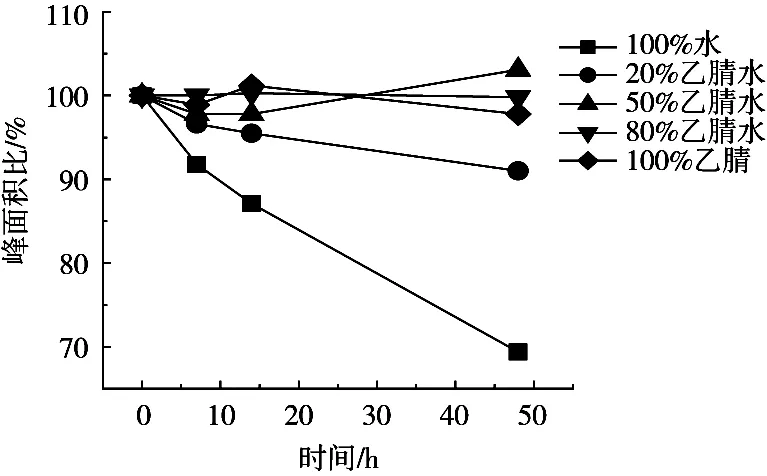
图3 不同比例乙腈水溶液中硫代黄素含量变化图
2.2 仪器条件的优化
2.2.1 色谱条件的选择
比较Waters® XBridge C18(3.5 μm,150 mm×4.6 mm),Waters Atlantis T3(5 μm,150 mm×4.6 mm)和Phenomenex Titank C18(5 μm,150 mm×4.6 mm)3种色谱柱对分离效果的影响。结果显示,在相同的色谱条件下Atlantis T3、Titank C18对目标物保留较强,出峰时间较晚,导致分析时间延长,易产生残留。最终选择XBridge C18色谱柱。
2.2.2 流动相的选择
对不同流动相体系进行研究,比较甲醇-水、甲醇-20 mmol/L醋酸铵、甲醇-0.01%甲酸水溶液、甲醇-0.02%甲酸、甲醇-0.05%甲酸溶液对目标物分离情况。结果显示:甲醇-水的流动相出峰较晚,且拖尾严重,对称因子为1.56。在水相中加入醋酸铵后,出峰时间明显缩短,但仍存在拖尾现象,对称因子为1.46。在水相中加入甲酸后能够缩短出峰时间,甲酸体积分数为0.01%存在拖尾,甲酸体积分数为0.02%和0.05%时峰形得到改善,峰形尖锐,对称性好,两者响应峰面积无明显区别,考虑甲酸体积分数过高影响色谱柱寿命,因此选择甲醇-0.02%甲酸作为流动相。
2.2.3 检测波长的选择
硫代黄素经液相色谱分离,二极管阵列检测器扫描检测,在200~500 nm范围内测定硫代黄素的吸光度,得到的紫外光谱图如图4所示。硫代黄素的最大吸收峰为418 nm,在该条件下,可获得较高的灵敏度,特异性好,可获得较好基线及较少干扰,选择418 nm作为定量的检测波长。
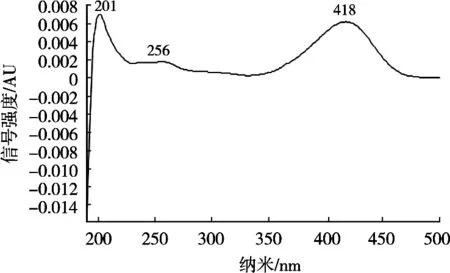
图4 硫代黄素在200~500 nm范围内的光谱图
2.3 前处理方法的优化
2.3.1 提取溶剂的选择
分别考察乙腈、甲醇、水作为提取溶剂对目标物的提取效率,结果表明以纯水作为提取溶剂,目标物的回收率约为20%,且提取液浑浊,样品净化困难,不适用于大黄鱼高蛋白基质的处理。乙腈和甲醇都具有沉淀蛋白质的作用,但纯乙腈或甲醇易使蛋白质快速凝结成团,不利于目标物的释放,向提取液中加入一定比例水相会提高样品分散程度,有利于目标物的提取。因此,比较不同配比甲醇-水、乙腈-水溶液的提取效果。同一配比下,乙腈的提取效果比甲醇好。分析原因是甲醇和乙腈沉淀蛋白的效率和分子量不同,针对大黄鱼中的蛋白质种类,乙腈沉淀蛋白的效果比甲醇好,更具有选择性,使得硫代黄素更容易同基质释放出来。乙腈比例高于50%,均可达到较好的回收率,回收率在90%以上。采用80%乙腈水作为提取剂时目标物的回收率最高,达到95%左右;有机相比例低于50%时,回收率开始下降,可能与硫代黄素在溶剂中的存在形式有关。样品经80%乙腈水(V/V)提取,蛋白沉淀效果好,提取液更澄清,回收率高,因此选择80%乙腈作为提取溶剂。
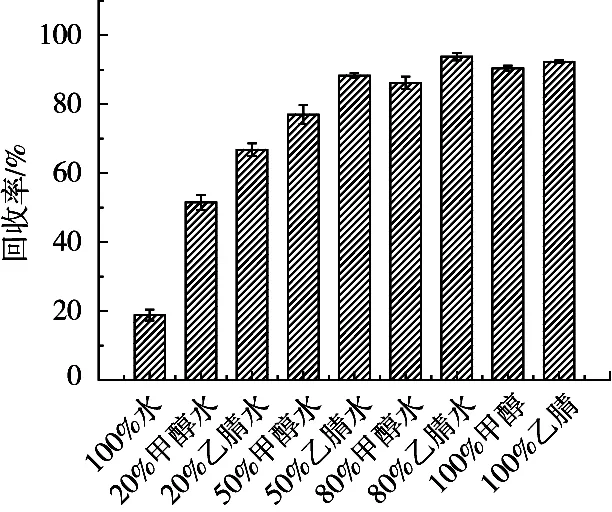
图5 不同提取溶剂对硫代黄素回收率的影响
2.3.2 提取体积及次数的优化
对提取次数和提取体积进行优化。以80%乙腈水作为提取溶剂,提取体积分别为10,20和25 mL,提取次数为1次的结果表明,提取体积10 mL时的回收率为90%,提取体积增大到20 mL时,回收率有所升高,进一步增大提取体积后提取效率无明显变化。考虑到经济成本,选择用20 mL 80%乙腈水(V/V)进行提取。进一步对提取次数进行考察,增加提取次数,回收率无明显提高,基于节约时间成本的角度,选择提取次数为1次。
2.3.3 净化方式的比较
针对大黄鱼高蛋白、高脂肪的的复杂基质,分别考察亚铁氰化钾-乙酸锌、氢氧化钠-硫酸锌、乙腈3种沉淀蛋白的净化方式。由图6可见,前2种净化方法的回收率较低,回收率低于10%,推测原因可能是2组无机盐沉淀剂对目标物存在吸附现象,或提取液的pH对硫代黄素的稳定性影响较大。第3种净化方式样品经水分散,乙腈沉淀蛋白后,可获得较高水平的回收率。
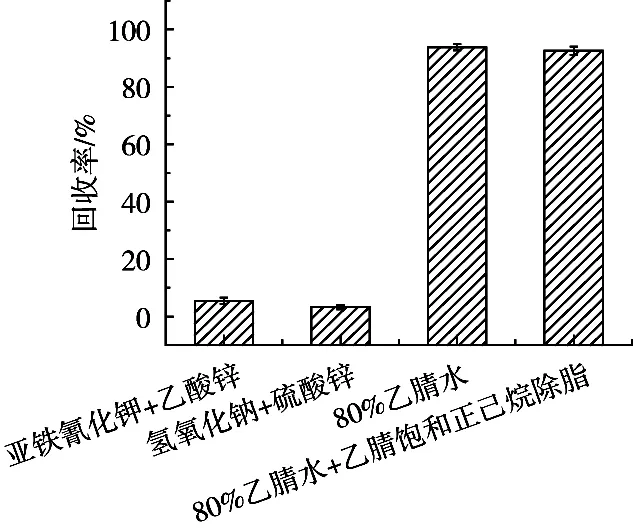
图6 不同净化方式硫代黄素回收率的比较
为清除基质中的脂肪类杂质,利用乙腈饱和正己烷除脂,除脂后的样品溶液更加澄清,且除脂前后回收率无明显差别,能够保证较高而稳定的回收率。因此,选用乙腈水提取目标物,乙腈饱和正己烷除脂,达到对样品净化的目的。
2.4 方法学评价
2.4.1 线性范围、检出限和定量限
取适量标准储备溶液,用80%乙腈水(V/V)稀释,配制成质量浓度分别为0.05,0.1,0.2,1,5,10,20和50 μg/mL的系列标准工作溶液。将系列标准工作溶液按浓度从低到高的顺序,按1.2.3液相色谱条件进行测定,以硫代黄素峰面积(Y)对其质量浓度(X)作标准曲线。采用空白基质加标的方法,以信噪比S/N=10得到目标物的定量限(SLOQ),以信噪比S/N=3得到目标物的检出限(SLOD)。硫代黄素在0.5~50 μg/mL之间线性关系良好,线性回归方程为Y=6.11×104X-2.32×103,线性相关系数(R)大于0.999,SLOD为0.2 mg/kg,SLOQ为0.5 mg/kg。硫代黄素标准物质色谱图以及阴性加标试样色谱图见图7和图8。
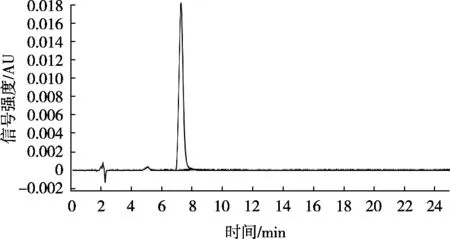
图7 硫代黄素标准溶液(5 μg/mL)色谱图
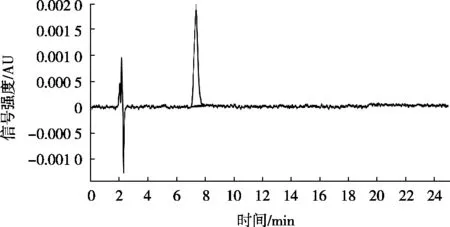
图8 阴性加标试样(5 mg/kg)色谱图
2.4.2 回收率和精密度
采取向大黄鱼空白样品中添加低(0.5 mg/kg)、中(1 mg/kg)、高(5 mg/kg)3个加标水平,每个浓度水平平行测定6次,得到方法的回收率及精密度,见表2。在GB/T 27404—2008检测方法的确认要求中规定,加标量在1~100 mg/kg,回收率范围为90%~110%[15]。该方法3个浓度水平的加标回收率在91.6%~97.8%。GB/T 27404—2008中实验室内变异系数随待测组分含量的减小而增加,待测组分含量10 mg/kg时,实验室内变异系数为7.5%[15]。该方法的相对标准偏差在1.5%~2.1%。结果表明,方法的回收率和精密度均满足标准要求。
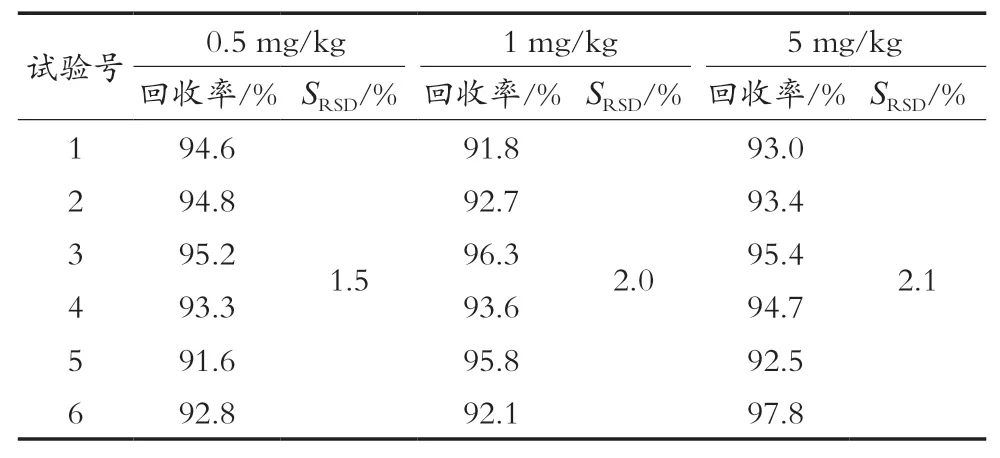
表2 方法的回收率及精密度(n=6)
2.5 实际样品测定
应用所建方法对市售20批次大黄鱼样品进行检测,结果均未检出硫代黄素,今后可持续跟进大黄鱼中非法添加的监测。
3 结论
试验建立大黄鱼中硫代黄素的高效液相色谱定性定量方法,对提取溶剂、净化方式及色谱条件进行优化。同时对硫代黄素稳定性进行系统性考察,从而保证试验结果的准确度。该方法的前处理只需乙腈水超声提取,乙腈饱和正己烷除脂,简单快速,同时出峰时间短,准确度、精密度等符合要求,适用于大黄鱼中硫代黄素的快速测定,能够更好地为此类产品的市场监管提供服务。
