广西天桃木土壤细菌群落多样性特征
2022-02-20陆炎松黄旭光杨思霞黄丽丹赵建文姜立甫
陆炎松,黄旭光,杨思霞,黄丽丹,赵建文,姜立甫
(1.南宁市园林科研所,广西 南宁 530011;2.南宁市绿化工程管理中心,广西 南宁 530011)
植物生长离不开土壤,土壤微生物作为土壤生态系统中十分重要的一部分,在土壤养分转化循环、抗干扰能力、系统稳定性以及可持续利用中占据主导地位[1]。根际作为连接土壤与植物的桥梁,其所含微生物种类众多,按对植物的作用可分为有益微生物和有害微生物[2]。根际有益微生物通常通过产生激素类物质、促进植物养分吸收、诱导植株增强抗性等直接作用方式和抑制病原菌生长的间接作用方式促进植物生长[3]。
天桃木Mangifera persiciformis为漆树科Anacardiaceae杧果属Mangifera常绿阔叶乔木[4],树形优美,是优良的街道绿化树种,作为南宁市市树,被广泛应用在南宁市市政绿化工程中。但由于天桃木苗木从苗木基地移植至苗圃假植时成活率较低,而且愈后不良率高,造成除市政工程以外很少有住宅区、公园等种植天桃木[5]。近年来,国内外学者对于天桃木的研究主要集中在移植技术及水分利用效率等方面[6-7],而对于天桃木土壤微生物方面的研究还未见报道。本研究采用第三代高通量测序技术,比较了不同地区原生天桃木土壤细菌群落的多样性和优势菌群,并通过测定土壤化学性质,探究土壤化学性质对天桃木土壤细菌群落多样性的影响,为挖掘有益微生物功能促进天桃木复壮提供理论依据和技术支撑。
1 材料与方法
1.1 研究区概况
广西南宁、崇左、百色等地为种植天桃木较多且适宜天桃木生长的区域,本研究在以上地区共设置4个样地。研究区位于广西壮族自治区西南部,地理坐标为22.522°~ 23.758° N,106.796°~ 108.663° E,属亚热带季风气候,夏季气温高、降雨多、日照时间长,冬季日照时间短、天气干暖。年均温为21.7~ 22.1℃,年均降水量为1 093~ 1 295 mm。研究区概况见表1。
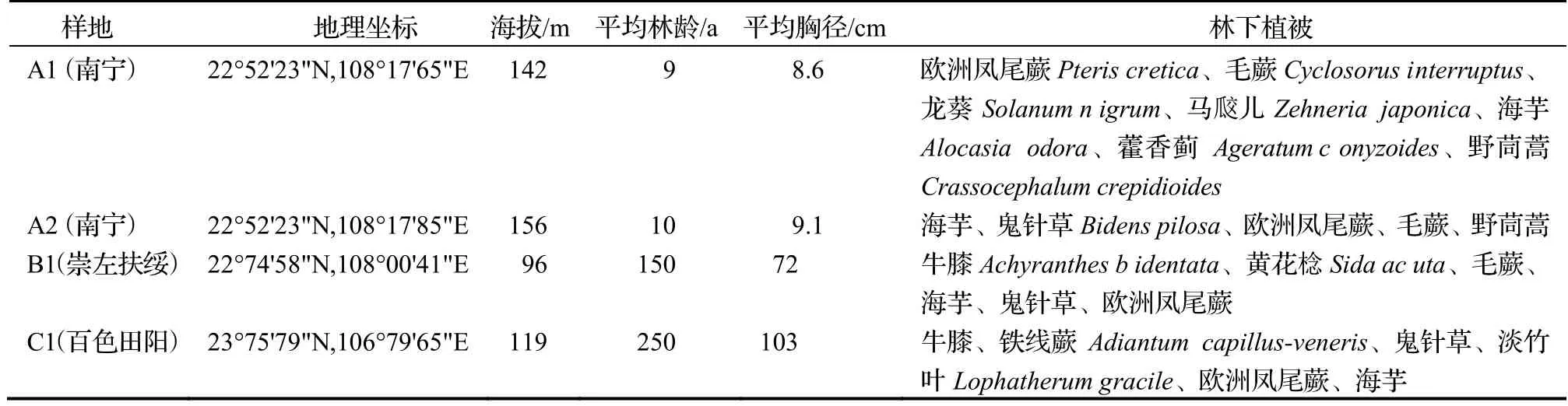
表1 研究区概况Table 1 Information of research areas
1.2 土壤样品采集与处理
2020年6月,分别在每个样地设置3个20 m×20 m典型样方,先去除样方内的地表杂物,然后以天桃木的主茎为中心在50~ 80 cm半径范围内取土。采用土钻法在每个样方内用“S”形采集5个点的0~ 20 cm土壤样品,每个样地共采集15个土样,挑去石块、根系等杂物,将其混匀后用“四分法”取得1 kg的鲜土作为1个混合土样,4个样地共得到4个混合土样。将混合土样装入无菌自封袋中,于冰盒中带回实验室。每份混合土样一部分自然风干后过2 mm筛,供土壤理化性质测定使用;另一部分鲜样置于-80℃冰箱保存,供微生物测序分析使用。
1.3 测定方法
土壤理化性质测定:土壤pH采用水土比例1∶2.5玻璃电极法测定;土壤有机碳(Soil organic carbon,SOC)含量采用重铬酸钾-水合加热法测定;土壤全N(Total nitrogen,TN)含量采用凯氏定氮法测定;土壤全P(Total phosphorous,TP)含量采用钼锑抗比色法测定;土壤碱解N(Available nitrogen,AN)含量采用碱解扩散法测定;土壤有效P(Available phosphorous,AP)含量采用氟化铵—盐酸浸提,钼锑抗比色,紫外分光光度法测定;土壤速效K(Available potassium,AK)含量采用中性乙酸铵溶液浸提,火焰光度计法测定[8]。
土壤DNA提取纯化:采用CTAB方法提取样本总DNA[9]。用Qubit2.0检测DNA浓度,琼脂糖凝胶电泳检测DNA完整性。DNA样品浓度>10 ng·μL-1,样品纯度有明显条带;琼脂糖凝胶电泳检测条带清晰,无降解,符合接下来的测序条件。
PCR扩增及测序:细菌的PCR扩增及测序服务由北京擎科生物科技有限公司完成。扩增引物为27F(16S-F):AGRGTTTGATYNTGGCTCAG和1492R(16S-R):TASGGHTACCTTGTTASGACTT。扩增条件设置:95℃预变性5 min,95℃变性30 s,55℃退火30 s,72℃延伸60 s,30个循环,72℃延伸7 min。提取样品总DNA后,根据16S全长引物27F和1492R,合成带有Barcode的特异引物,进行PCR扩增并对其产物进行纯化、定量和均一化,形成测序文库(SMRTBell),对建好的文库先进行文库质检,并对质检合格的文库用PacBioSequel平台进行测序。
1.4 物种注释与丰度计算
使用Limav 1.7.0软件,通过Barcode对CCS进行识别,得到Barcode-CCS序列数据;对Barcode-CCS序列数据进行过滤,得到有效序列;使用UCHIMEv 4.2软件,鉴定并去除嵌合体序列,得到Optimization-CCS序列。使用Usearch软件对Tags在97%的相似度水平下进行聚类,获得OTU,并基于Silva(细菌)分类学数据库对OTU进行分类学注释。使用Mothur(Version V.1.30)软件计算Chao 1指数和Simpson指数等Alpha多样性指数。利用QIIME软件生成不同分类水平上的物种丰度表,再利用R语言工具绘制成样品各分类学水平下的群落结构图。
1.5 数据分析
数据用Excel 2010进行处理,用DPS 9.01进行单因素方差分析、多重比较分析(LSD法)。使用Canoco 4.5软件对土壤环境因子和细菌群落进行冗余分析(Redundancy analysis,RDA)。
2 结果与分析
2.1 土壤化学性质分析
由表2可见,4个样地的土壤pH均呈弱酸性,A1、A2、B1的土壤pH之间差异均不显著,但其与C1之间均差异显著(P<0.05)。B1、C1的土壤SOC、TN、AP含量之间均差异不显著,其土壤SOC、TN含量均显著高于A1和A2的(P<0.05),但土壤AP含量却显著低于A1和A2的(P<0.05)。4个样地的土壤TP、AN含量差异均达到显著水平(P<0.05)。
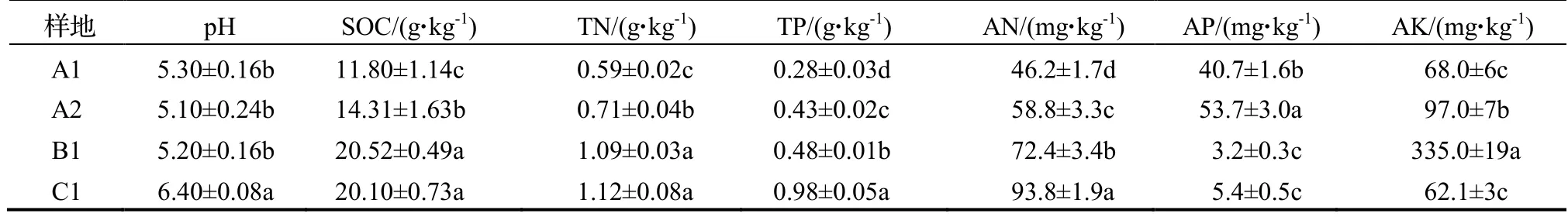
表2 不同样地土壤的化学性质Table 2 Chemical properties of the soil at different research areas
2.2 细菌多样性指数
通过高通量测序技术对土壤样品的微生物细菌部分进行测序,共获得有效序列27 017条,片段长度在1 454~ 1 457 bp,测序覆盖度在97.90%~ 99.13%之间。基于其测序深度基本能够反映该区域所涵盖的细菌群落的结构以及种类等特性,可以定量比较整个群落组成和多样性的相对差异。
不同样品的Alpha多样性指数,如Chao1指数和ACE指数代表群落物种丰富度,其数值越大,说明菌群的丰度越高;Shannon丰富度指数代表群落物种多样性,Simpson优势度指数代表常见物种[10]。研究结果表明(表3),Simpson指数,A2与C1之间差异不显著;ACE指数,A1与A2、B1之间差异不显著,但均显著高于C1(P<0.05);Chao1指数,A1、A2、B1之间差异不显著,但均显著高于C1(P<0.05);Shannon指数,A1、A2、B1之间差异不显著,均与C1之间差异显著(P<0.05)。这说明在4个样地中C1的细菌群落丰富度和多样性均为最低。在4个样地中,C1的土壤pH值最高,林龄最大,这可能是导致细菌群落结构丰富度和多样性低的主要原因。
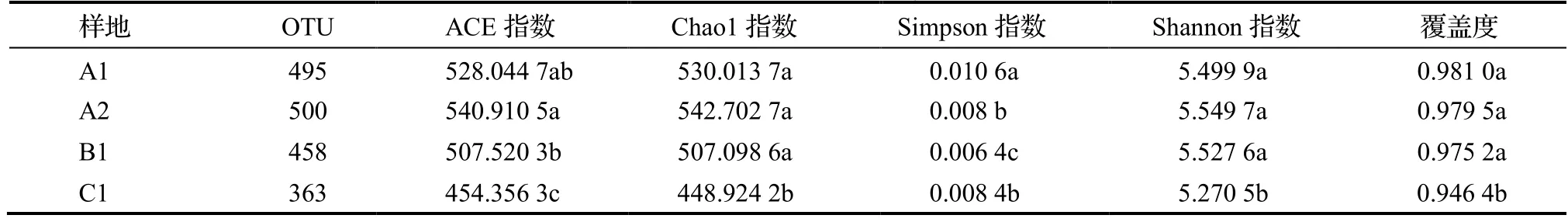
表3 土壤微生物多样性指数Table 3 Soil bacterial diversity index
2.3 门水平上土壤细菌群落结构相对丰度分析
在门水平上,4个样地的土壤中共检测出23门细菌,其中在A1样地土壤中有21门,在A2样地土壤中有21门,在B1样地土壤中有20门,在C1样地土壤中有21门。由图1可知,相对丰度排名前10位的依次为变形菌门Proteobacteria、酸杆菌门Acidobacteriota、疣微菌门Verrucomicrobia、浮霉菌门Planctomycetota、拟杆菌门Bacteroidota、放线菌门Actinobacteria、绿弯菌门Chloroflexi、硝化螺旋菌门Nitrospirae、芽单胞菌门Gemmatimonadetes、Myxococcota。
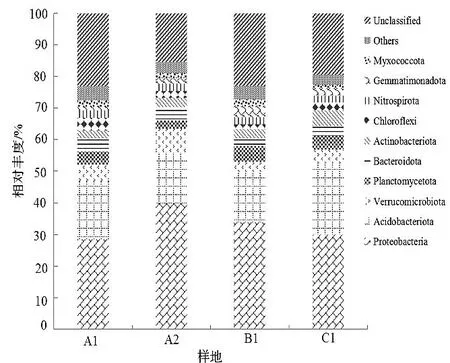
图1 土壤细菌门水平相对丰度Figure 1 Relative abundance of soil bacteria at the phylum level
2.4 属水平上土壤细菌群落结构相对丰度分析
在属水平上,4个样地的土壤中共检测出118属细菌。其中在A1样地土壤中有96属,在A2样地土壤中有100属,在B1样地土壤中有89属,在C1样地土壤中有70属。由图2可知,相对丰度排名前10位的物种依次为Vicinamibacter、疣微菌属Pedosphaera、硝化螺旋菌属Nitrospira、芽单胞菌属Gemmatimonas、Pseudolabrys、土生单胞菌属Terrimonas、Candidatus Udaeobacter、Ramlibacter、Gaiella、Aeromonas。其中Vicinamibacter在各样地中均具有绝对优势。
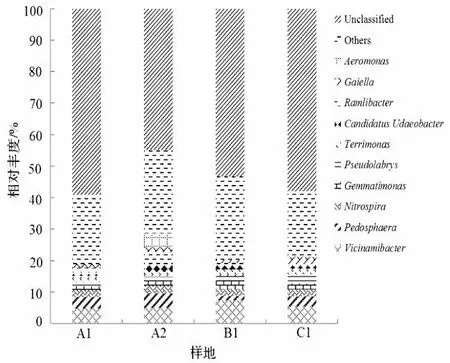
图2 土壤细菌属水平相对丰度Figure 2 Relative abundance of soil bacteria at the genus level
2.5 种水平上土壤细菌群落结构相对丰度分析
在种水平上,4个样地的土壤中共检测出123种细菌。其中在A1样地土壤中有92种,在A2样地土壤中有94种,在B1样地土壤中有85种,在C1样地土壤中有67种。Vicinamibacter silvestris、疣微菌Pedosphaera parvula、芽单胞菌Gemmatimonassp.、土生单胞菌Terrimonassp.、Candidatus Udaeobacter copiosus、Gaiella occulta、硝化螺旋菌Nitrospira japonica、Pseudolabrys taiwanensis是不同样地天桃木根际土壤细菌的优势菌群。
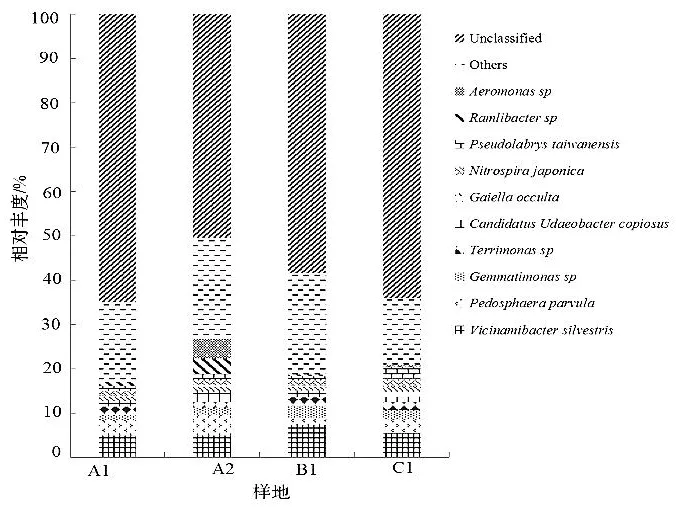
图3 土壤细菌种水平相对丰度Figure 3 Relative abundance of soil bacteria at the species level
2.6 优势细菌门、属、种相对丰度与土壤化学性质之间的相关性
对优势细菌门、优势细菌属和优势细菌种的相对丰度和土壤化学性质进行冗余分析(图4)。结果显示,轴Ⅰ和轴Ⅱ门、属、种的累计解释变异量分别达78.62%、82.42%和79.85%。在门和属水平上,土壤AP含量、AK含量、pH对细菌群落组成影响较大。在种水平上,土壤pH、AP含量、TP含量对细菌群落种水平组成影响较大。

图4 土壤化学因子和优势细菌门、属、种相对丰度冗余度分析Figure 4 Redundancy analysis on soil chemical properties and relative abundance of dominant bacterial phylum,genera and species
对优势细菌类群和土壤化学性质进行Pearson相关性分析(表4)。结果表明,在门水平上,酸杆菌门的相对丰度与土壤pH呈极显著正相关(P<0.01);疣微菌门的相对丰度与土壤AP含量呈显著正相关(P<0.05);拟杆菌门的相对丰度与土壤SOC、TN含量呈显著负相关(P<0.05),与土壤AP含量呈极显著正相关(P<0.01);放线菌门的相对丰度与土壤pH、土壤TP含量呈极显著正相关(P<0.01),与土壤AN含量呈显著正相关(P<0.05);硝化螺旋菌门的相对丰度与土壤AP含量呈极显著正相关(P<0.01);芽单胞菌门的相对丰度与土壤SOC、TN含量呈显著正相关(P<0.05);Myxococcota与土壤TP含量呈显著负相关(P<0.05)。在属水平上,Vicinamibacter的相对丰度与土壤AK含量呈显著正相关(P<0.05);硝化螺旋菌属的相对丰度与土壤AP含量呈极显著正相关(P<0.01);芽单胞菌属的相对丰度与土壤SOC含量呈显著正相关(P<0.05);Pseudolabrys的相对丰度与土壤pH呈极显著正相关(P<0.01),与土壤TP含量呈显著正相关(P<0.05)。在种水平上,Vicinamibactersilvestris的相对丰度与土壤AK含量呈显著正相关(P<0.05);芽单胞菌的相对丰度与土壤SOC含量呈显著正相关(P<0.05);硝化螺旋菌的相对丰度与土壤TP、AN含量呈极显著正相关(P<0.01);Pseudolabrys taiwanensis的相对丰度与土壤pH、土壤TP含量呈显著正相关(P<0.05)。

表4 优势细菌类群与土壤化学因子相关性分析Table 4 Correlation analysis between dominant bacteria groups and soil chemical properties
3 讨论
3.1 土壤化学性质对天桃木土壤细菌群落多样性的影响
不同土壤细菌类群的生存和繁衍需要不同的环境条件。冗余分析结果表明,土壤pH、AP含量和AK含量对细菌群落门水平及属水平影响较大,土壤pH、AP含量和TP含量对细菌群落种水平组成影响较大。土壤pH 在土壤生物地球化学循环过程中起着重要作用,对土壤中理化反应都具有重要的调节作用,是影响细菌分布的重要因子[11]。土壤中的P也是土壤细菌的重要营养来源,P的多少影响土壤细菌在土壤中的生存和繁殖。安然等研究发现土壤AP含量变化会引起土壤细菌群落的变化[12]。本研究中,土壤pH、AP含量对细菌群落门、属、种水平均影响较大,印证了这一说法。微生物分泌有机酸产生的溶磷作用,一方面与分泌的有机酸的种类和数量有关,另一方面与磷酸根结合的阳离子有关。如果微生物分泌的有机酸多,土壤中的Ca-P化合物也多,溶解释放的磷也相对较多[13]。本试验中A1、A2样地土壤中的TP含量显著高于B1、C1样地,AP含量却显著低于B1、C1样地,可能是由于A1、A2样地土壤中溶磷微生物分泌的有机酸较多,且A1、A2样地属同一地区,其土壤中可能含有较多的Ca-P化合物。
3.2 天桃木土壤样本高丰度微生物潜在功能探讨
在门水平上,变形菌门是4个样地土壤中的第一大优势菌群。变形菌门成员在生态环境中分布广泛。有研究表明,好氧甲烷氧化菌可分为14个属,包括研究较为深入的隶属于变形菌门Alpha和Gamma纲的细菌,以及属于疣微菌门的极端嗜热嗜酸甲烷氧化菌[14]。甲烷氧化菌是自然界中唯一的甲烷生物汇,其氧化作用可消耗大气中至少10%的甲烷[15]。本研究土样中鉴定的优势菌株Pseudolabrys taiwanensis隶属于Alphaproteobacteria纲,菌株Aeromonassp.隶属于Gammaproteobacteria纲,其可能具备氧化甲烷的功能。酸杆菌门为4个样地的第二大优势菌群。酸杆菌门菌株最早由Kishimoto等[16]在1991年分离自酸性矿山环境,并于1995年将酸杆菌划分为新的细菌类群[17]。目前,基于16SrRNA基因序列将酸杆菌门细菌划分为26个亚群,即Gp1~ 26[18]。酸杆菌广泛分布在自然界中,在土壤中的数量约占细菌总量的20%~ 50%,与变形杆菌不相上下[19]。酸杆菌门可培养菌株经研究发现,可以降解植物纤维素[20]、参与铁循环[21]及单碳化合物的代谢过程[22]。但相对于自然环境中酸杆菌的多样性而言,可培养菌株依然很少且大部分属于Gp1亚群[19]。本研究中的优势菌株Vicinamibacter silvestris属于Gp6亚群[23],其是否具备其它可培养菌株的功能还有待研究。优势菌株硝化螺旋菌隶属于硝化螺旋菌属。硝化螺旋菌属细菌可以将土壤中的亚硝酸氧化成硝酸盐,而硝酸盐是土壤中作物易吸收的氮源形式,因此,土壤中硝化螺旋菌的增加可以间接地增加土壤氮肥力[24]。放线菌作为一类具备生物防治潜力的微生物资源,其可以产生种类丰富的抗生素和其他生物活性代谢产物[25]。目前应用较多的放线菌隶属于链霉菌属[26],本研究中的优势菌株Gaiella occulta隶属于Gaiella属,最显著的特征是存在其他细菌中没有的iso内部支化脂肪酸[27]。根际促生菌(Plant growth-promoting rhizobacteria,PGPR)是一类能高密度定殖在植物根际的微生物,兼有抑制植物病原菌、根际有害微生物,以及促进植物生长并增加作物产量的作用。相关研究表明,Terrimonas属的T.aquatica、T.arctica、T.lutea等菌株具有促进根系发育、增加叶面积等改善植物农艺性状的功能[28]。本研究中的优势菌株土生单胞菌Terrimonassp.隶属Terrimonas属,其可能也具备促生功能。
马尾松Pinus massoniana[29]、香榧Torreya grandis‘Merrillii’[30]、盐穗木Halostachys caspica[31]根际土壤细菌群落组成主要是由变形菌门、酸杆菌门、放线菌门、疣微菌门、拟杆菌门、绿弯菌门、浮霉菌门等组成,与本研究结果相似,但在属水平上的细菌群落组成差异较大。以上树种根际土壤细菌微生物多样性分析均未在种水平上进行分析。本研究利用第三代高通量测序技术,可在种水平上对土壤细菌群落多样性进行分析,为天桃木根际土壤有益微生物的开发利用创造了条件。
广西不同地区天桃木土壤细菌优势门类群主要包括变形菌门、酸杆菌门,优势属类群主要包括Vicinamibacter、疣微菌属,优势种类群主要包括酸杆菌、疣微菌。土壤pH、有效P含量对不同水平的细菌群落组成均具有影响。
