达格列净对人单核细胞系THP-1细胞增殖、凋亡,脂质水平的影响及相关机制研究
2022-02-19罗恩斯董志会陈冬萍杨群峰万杰君
罗恩斯,董志会,陈冬萍,杨群峰,万杰君
单核细胞在动脉粥样硬化的发生发展中起关键作用。单核细胞中胆固醇流出的失衡最终导致转化为载脂泡沫细胞,这些泡沫细胞积聚在动脉壁成为动脉粥样硬化病变早期的标志[1-2]。过氧化物酶体增殖物激活受体c(peroxisome proliferator activated receptor c,PPARc)是一种核受体,在胆固醇稳态和动脉粥样硬化形成的关键生物学过程中起关键作用[3]。一旦被激活,PPARc 会诱导一系列参与单核细胞中胆固醇流出的基因。肝X 受体α(liver X receptor α,LXRα)被确定为PPARc 的一种靶基因[4]。LXRα 最典型的作用之一是促进胆固醇逆向转运(reverse cholesterol transport,RCT),即胆固醇从外周输送到肝脏进行排泄[5]。RCT的第一步是单核细胞的胆固醇流出,单核细胞的胆固醇通过三磷酸腺苷结合盒转运蛋白A1(adenosine triphosphate binding cassette transporter A1,ABCA1)和其他转运蛋白转移到载脂蛋白A-I(apolipoprotein A-I,apoAI)和高密度脂蛋白(high-density lipoprotein,HDL)[6]。ABCA1是最早发现的LXRα 靶基因之一,可促进单核细胞胆固醇外流并维持细胞甾醇稳态。ABCA1的突变消除了胆固醇流出并增加了发生动脉粥样硬化的风险[7]。miRNA 是小的(约19~22 nt)非编码RNA,主要通过与靶mRNA 的3’端非翻译的区域(3′-Untranslated Region,3’-UTR)结合来调节基因表达,从而导致mRNA降解或翻译抑制。miRNA在多种正常和疾病相关生物过程的细胞过程中发挥重要作用,包括代谢稳态、肿瘤发生和心脏发生。最近,越来越多的证据表明miRNA 参与胆固醇代谢。使用生物信息学分析,预测几种miRNA 可能靶向人LXRα 和ABCA1mRNA 的3’-UTR,并且miR-613具有较高的调节LXRα和ABCA1的概率[8]。先前的报道表明,miR-613 与甲状腺乳头状癌、胃癌、乳腺癌和脂肪生成有关。然而,尚不清楚miR-613 是否通过靶向人髓系白血病单核细胞(human myeloid leukemia mononuclear cells,THP-1)中 的LXRα 和ABCA1 参与调节胆固醇流出。达格列净是一种选择性钠依赖性葡萄糖转运蛋白2 抑制剂(sodium dependent glucose transporter 2 inhibitor,SGLT2i),作用于脏近端肾小管,抑制其对原尿中的葡萄糖重新吸收,降低肾糖阈值从而增加尿葡萄糖排出[9]。此外,动物实验表明达格列净导致单核细胞向粪便的逆向胆固醇转运增加,从而减轻动脉内膜中的低密度脂蛋白(low density lipoprotein,LDL)滞留[9]。同时,一些临床试验也表明[10],达格列净可以通过改善内皮功能或降低一些血脂相关指标来降低动脉粥样硬化风险。本研究拟探讨达格列净对人单核细胞系THP-1 细胞活性的影响及作用机制,为其抗动脉粥样硬化作用提供依据。
1 材料与方法
1.1 试剂及仪器 达格列净(阿法埃莎化学有限公司),Dulbecco 改良的Eagle 培养基(dulbecco modified eagle medium,DMEM,中国碧云天科技有限公司);胎牛血清(fetal bovine serum,FBS,中国大闽生物科技公司);细胞计数试剂盒(cell counting kit-8,CCK-8)(美国MerckKGaA 生物科技有限公司);结晶紫染色液(上海景天生物科技有限公司);膜联蛋白V-PE 凋亡检测试剂盒(美国Millipore);总胆固醇(total cholesterol,TC)、游离胆固醇(free cholesterol,FC)、胆固醇酯(cholesterol esters,CE)试剂盒(美国贝克曼);核糖核酸酶(ribonuclease,RNase)、碘化丙啶(propidium iodide,PI)(Sigma,USA);TRIzol 试剂;逆转录试剂盒;SYBR Green I Supermix(Takara);放射免疫沉淀法(radio-immunoprecipitation assay,RIPA)裂解缓冲液(美国Sigma-Aldrich);双金钱子酸(bicinchoninic acid,BCA)蛋白质测定试剂盒;钠盐聚丙烯酰胺凝胶电泳(sodium salt-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶硝酸纤维素膜;小鼠单克隆抗人LXRα 一抗(1:1000;Santa Cruz Biotechnology)、小鼠单克隆抗人ABCA1 一抗(1:500;Santa Cruz Biotechnology);小鼠单克隆抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗(1:5000;Santa Cruz Biotechnology),horseradish peroxidase(HRP)缀合的山羊抗小鼠免疫球蛋白(immunoglobulin,IgG)(1:5000;Santa Cruz Biotechnology);高效化学发光(efficient chemiluminescence,ECL)试剂盒。iCycler IQ PCR 多色检测系统、Quantity One软件(Bio-Rad,USA) ;Cell-QuestTM Pro软件(BD Biosciences,USA)。
1.2 细胞培养及分组 细胞培养:THP-1 细胞采用PRMI-1640(10%血清)在37℃,5% CO2 细胞培养箱中培养,100 ng/mL 佛波酯(phorbol ester,PMA)及100 mM 氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)诱导24 h后分别加入不同浓度达格列净(37.5 μg/L、75 μg/L、150 μg/L;前期的预实验求出达格列净对前述THP-1 细胞的LD50 为300 μg/L,本实验分别以1/2、1/4、1/8 LD50 作为高中低剂量),继续培养72 h后收集细胞。分组设计:A组:THP1+PMA+ox-LDL、B 组:THP1+PMA +ox-LDL +37.5μg/L 达格列净、C 组:THP1+PMA +ox-LDL +75μg/L 达格列净、D 组:THP1+PMA +ox-LDL +150μg/L达格列净。每组设计6个复孔。
1.3 细胞增殖测定 细胞培养结束后,将人单核细胞系THP-1 细胞以4×103个细胞/孔的密度接种到96 孔板中,培养24 h。每孔加入共10 μL CCK-8 溶液,置于37 ℃下孵育4 h。使用酶标仪在450 nm 处测量光密度(optical density,OD)值。通过吸光度值计算各组细胞存活率。
1.4 细胞单克隆形成数目水平测定 将细胞以800个细胞/孔接种到6 孔板中14 d,每3 d 用含有10%FBS 的培养基更新培养基,观察菌落形成,计数超过40 个细胞的集落,观察四个视野,获取平均值,应用结晶紫染色并拍摄代表性照片。
1.5 TC、FC、CE 水平测定 贝克曼AU-480 全自动生化仪测定各组细胞液中TC、FC、CE水平。
1.6 细胞凋亡水平测定 使用膜联蛋白V-PE 凋亡检测试剂盒检查凋亡细胞。收集细胞,用5 μL 膜联蛋白V-PE 和5 μL PI 染色。流式细胞仪检测细胞凋亡,使用Cell-QuestTM Pro 软件分析结果。收获预处理的细胞,在4 ℃下在冰冷的70%乙醇中固定过夜,然后重悬于含有1 mg/mL RNase 和50 μg/mL PI(Sigma)的1 mL PBS 中在暗箱中室温放置30 min。通过Cell-QuestTM Pro 软件计算细胞周期不同阶段的细胞百分比。
1.7 细胞miR-613、LXRα、ABCA1mRNA 水平测定 使用TRIzol试剂提取总RNA。使用RT-PCR系统及逆转录试剂盒进行逆转录。根据制造商的方案,使用SYBR Green I Supermix 在20 μL 最终反应体积中进行RT-PCR。所有反应均在iCycler IQ 多色检测系统上进行三次,miR-613、LXRα、ABCA1引物由GenePharma(中国上海)设计,序列如下:miR-613,反 向 5'-TCGCGCTAGCTAGCTAGCTAGCTAGCTAGCTAGCTAGCTAGCTGCTAC-3',正向5'-TGGGGCTAGTCAGCTAGTCGACTAGCTAGCTAGCTAGCTAGCTACTGCT-3';LXRα,正向5'-GTGGCTAGTCGTCGTCGATGCTGCTAGCTAGCTAGCTAGCTAGCTAGCTAGCC-3',反 向5'-GTGGTCGTAGCTAGTCGACTAGTCGATGCTAGCTAGCTAGTCGTAGCTAGCTGC-3';ABCA1,正 向 5'-TGGCTAGCTAGCTAGCTAGTCGATCGATCGTAGCTAGCTAGCTGACTAGTCC -3',反 向5'-GTGGGTCGATGCTAGCTAGCTAGCTAGTCAGTCGATGCTAGCGGT-3';U6,正 向5'-TGGGCTGATCGATGCTAGCTAGCTAGCTAGTCGATCGTC-3',反 向5'-GTGGGTCGATCGATCGATGCTAGCTAGCTAGCTGCTAGTCGATGC -TAGCTGCTCA-3'。循环参数如下:95 ℃10 s,然后40 个94 ℃15 s 循环,再55 ℃30 s,最后在70 ℃延伸30 s。所有定量均标准化为反应中人U6 的水平。比较阈值循环(CT)(2-DDCt)方法比较常见参考RNA 和靶基因RNA 之间的CT 值差异,用于获得基因表达的相对倍数变化。
1.8 细胞LXRα、ABCA1 蛋白水平测定 使用含有蛋白酶抑制剂的RIPA裂解缓冲液从人单核细胞系THP-1 细胞中提取蛋白质。使用BCA 蛋白质测定试剂盒测定蛋白质浓度。使用10% SDS-PAGE 凝胶分离等量的蛋白质裂解物(每个泳道20 μg),然后将印迹电解到硝酸纤维素膜上。用含有0.1%Tween-20的Tris缓冲盐水中的5%脱脂奶粉封闭膜2 h,并在4 ℃下与以下一抗孵育过夜:小鼠单克隆抗人LXRα、小鼠单克隆抗人ABCA1,小鼠单克隆抗人GAPDH 用作蛋白质加载的内部对照。24 h后将膜进一步与HRP 缀合的山羊抗小鼠IgG 在室温下孵育1 h,通过ECL试剂盒检测免疫复合物,条带的综合密度通过Quantity One软件进行量化。
1.9 统计学处理 采用IBM SPSS 24.0 软件统计分析,定量数据以均数±标准差()表示,多组数据差异使用单因素方差分析比较,多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组单核细胞系THP-1 细胞OD 值、存活率的比较 与THP-1细胞组(A组)比较,达格列净给药组(B、C、D 组)OD 值、存活率显著降低(P<0.05);且随着达格列净剂量的增加,达格列净低(B 组)、中(C 组)、高剂量组(D 组)OD 值、存活率逐渐降低(P<0.05)。见表1。
表1 各组单核细胞系THP-1细胞OD值、存活率比较()
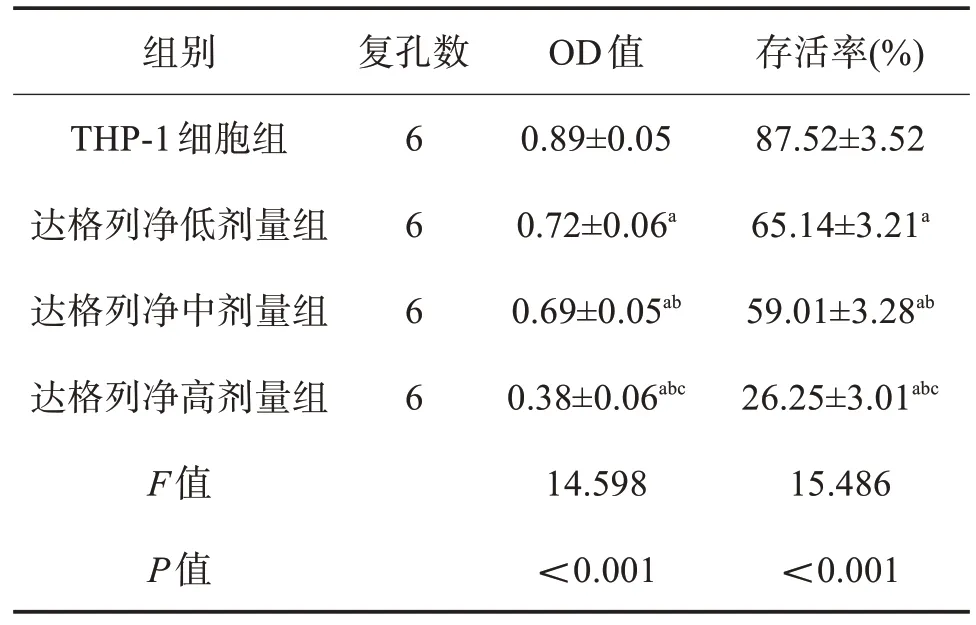
表1 各组单核细胞系THP-1细胞OD值、存活率比较()
与THP-1细胞组比较,aP<0.05;与达格列净低剂量组比较,bP<0.05;与达格列净中剂量组相比,cP<0.05。
2.2 各组单核细胞系THP-1 细胞单克隆形成数目的比较 与THP-1 细胞组(A 组)比较,达格列净低、中、高剂量组(B、C、D 组)单克隆形成数目降低(P<0.05);且随着达格列净剂量的增加,达格列净低(B组)、中(C 组)、高剂量组(D 组)单克隆形成数目逐渐降低(P<0.05)。见表2、图1。
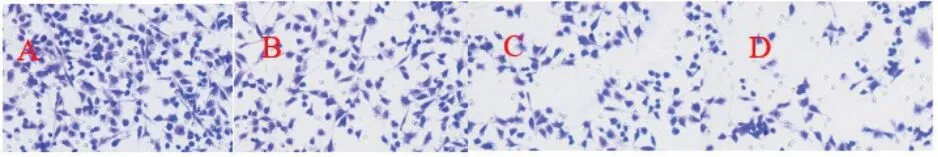
图1 各组单核细胞系THP-1 细胞单克隆形成数目比较(甲基紫染色,×200倍)
表2 各组单核细胞系THP-1细胞单克隆形成数目的比较()

表2 各组单核细胞系THP-1细胞单克隆形成数目的比较()
2.3 各组单核细胞系THP-1细胞凋亡率的比较 与THP-1 细胞组(A 组)比较,达格列净低、中、高剂量组(B、C、D组)凋亡率升高(P<0.05);且随着达格列净剂量的增加,达格列净低(B 组)、中(C 组)、高剂量组(D组)凋亡率逐渐升高(P<0.05)。见表3。
表3 各组单核细胞系THP-1细胞凋亡率的比较()
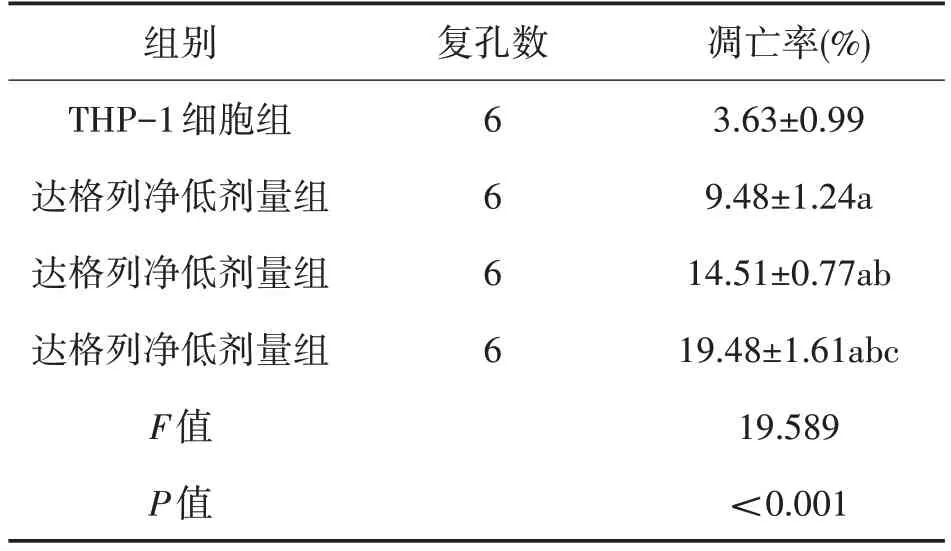
表3 各组单核细胞系THP-1细胞凋亡率的比较()
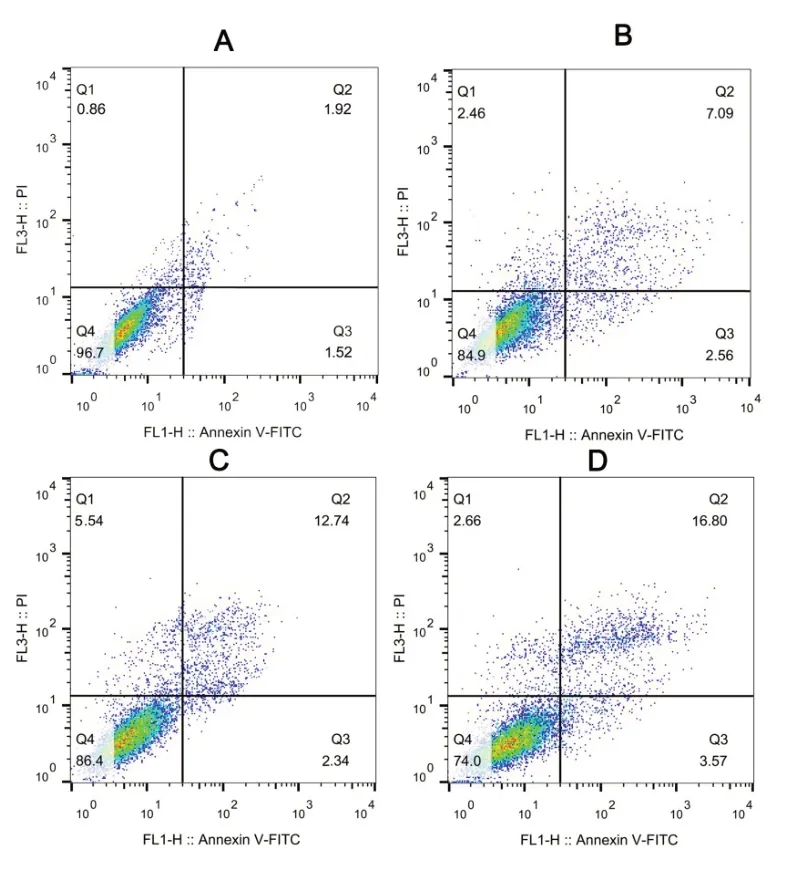
图2 各组单核细胞系THP-1细胞凋亡率比较
2.4 各组单核细胞系THP-1 细胞TC、FC、CE 水平比较 与THP-1细胞组(A组)比较,达格列净低、中、高剂量组(B、C、D 组)TC、FC、CE 水平降低(P<0.05);且随着达格列净剂量的增加,达格列净低(B 组)、中(C 组)、高剂量组(D 组)TC、FC、CE 水平逐渐降低(P<0.05)。见表4。
表4 各组单核细胞系THP-1细胞TC、FC、CE水平比较()
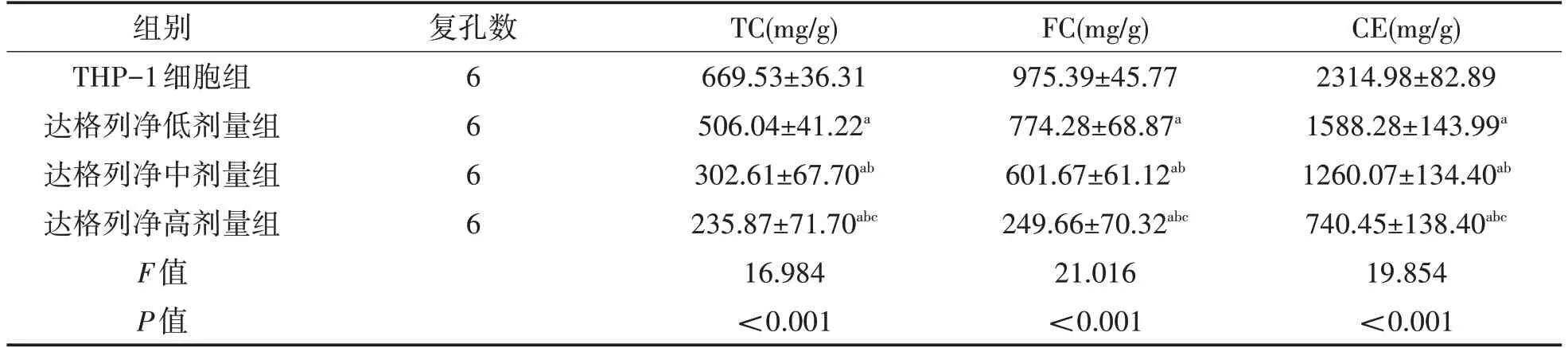
表4 各组单核细胞系THP-1细胞TC、FC、CE水平比较()
注:与THP-1细胞组比较,aP<0.05;与达格列净低剂量组比较,bP<0.05;与达格列净中剂量组比较,cP<0.05。
2.5 各组单核细胞系THP-1 细胞miR-613、LXRα、ABCA1 mRNA 转录水平比较 与THP-1 细胞组(A组)比较,达格列净低、中、高剂量组(B、C、D 组)miR-613 表达水平升高(P<0.05),LXRα、ABCA1 mRNA表达水平降低(P<0.05);且随着达格列净剂量的增加,达格列净低、中、高剂量组miR-613 表达水平逐渐升高(P<0.05),LXRα、ABCA1 mRNA 表达水平逐渐降低(P<0.05)。见表5。
表5 各组单核细胞系THP-1细胞miR-613、LXRα、ABCA1 mRNA表达水平比较()

表5 各组单核细胞系THP-1细胞miR-613、LXRα、ABCA1 mRNA表达水平比较()
注:与THP-1细胞组相比,aP<0.05;与达格列净低剂量组相比,bP<0.05;与达格列净中剂量组相比,cP<0.05。
2.6 各组单核细胞系THP-1细胞LXRα、ABCA1蛋白表达水平比较 与THP-1 细胞组(A 组)比较,达格列净低、中、高剂量组(B、C、D 组)LXRα、ABCA1 蛋白表达水平降低(P<0.05);且随着达格列净剂量的增加,达格列净低(B 组)、中(C 组)、高剂量组(D 组)LXRα、ABCA1 蛋白表达水平逐渐降低(P<0.05)。见表6、图3。
表6 各组单核细胞系THP-1细胞LXRα、ABCA1蛋白表达水平比较()

表6 各组单核细胞系THP-1细胞LXRα、ABCA1蛋白表达水平比较()
与THP-1细胞组相比,aP<0.05;与达格列净低剂量组相比,bP<0.05;与达格列净中剂量组相比,cP<0.05。

图3 各组单核细胞系THP-1 细胞LXRα、ABCA1 蛋白表达水平电泳图
3 讨论
单核细胞内皮下聚集和转化为泡沫细胞是动脉粥样硬化病变起始的关键事件。胆固醇及脂质流入和流出之间的不平衡是单核细胞泡沫细胞形成的原因。核酸内切酶VIII 样3 缺乏导致单核细胞胆固醇流出能力降低与加速动脉粥样硬化斑块形成有关。在载脂蛋白E(apolipoprotein E,apoE)缺陷(apoE-/-)小鼠模型中,单核细胞中胆固醇流出的药理学诱导可以防止动脉粥样硬化病变的发展[11]。因此,了解单核细胞胆固醇流出的机制对于开发有效的动脉粥样硬化治疗方法具有重要意义。
达格列净为钠依赖性葡萄糖转运蛋白2 抑制剂,选择性抑制钠依赖性葡萄糖转运蛋白2,使肾脏对尿糖的重新吸收减少,增加肾脏排出葡萄糖,发挥降糖作用。近年,国内外多个研究表明达格列净存在心脏肾脏的保护作用。有研究表明,达格列净可以降低糖尿病小鼠肝细胞中的炎症因子、FC、CE 水平,升高高密度脂蛋白胆固醇水平。既往有研究发现接受达格列净治疗的2 型糖尿病患者巨噬细胞的胆固醇流出能力较基线时有显著提高[12]。最近达格列净已被证明可有效改善内皮功能,减少氧化和促炎状态,并对心血管功能产生有益影响[13]。达格列净还可以通过改善胰岛素抵抗代谢紊乱来有效改善血脂和肝功能。重要的是,达格列净在各种疾病中表现出重要的抗炎能力。例如,达格列净通过抑制NOD 样受体家族3(NOD like receptor 3,NLRP3)炎性体形成和促炎细胞因子如肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-6 和IL-18 的产生来预防糖尿病肾病的发病机制[14];达格列净的给药通过诱导表达白细胞和CD8+淋巴细胞的独特变化来减轻血管紧张素II诱导的心脏舒张功能障碍、纤维化和炎症。在实验性心肌梗死动物模型中,达格列净可显著降低术后死亡率并恢复心脏功能。这些证据表明达格列净可能对心血管有益[15],我们通过将达格列净应用于培养的人单核细胞系THP-1 细胞来探索其生物学效应。本研究结果显示:与THP-1细胞组比较,达格列净低、中、高剂量组OD 值、存活率、单克隆形成数目、TC,FC,CE 水平降低,凋亡率升高,且具有剂量-效应关系(P<0.05)。这表明,达格列净能抑制人单核细胞系THP-1 细胞增殖,促进人单核细胞系THP-1细胞凋亡,降低人单核细胞系THP-1细胞脂质水平。
microRNAs(miRs)是一个小型非编码RNAs 大家族,可通过与mRNAs 的3′-非翻译区(3′-UTR)的部分互补结合来抑制多个靶基因的表达。表达谱研究表明,与正常动脉比较,许多miR 在动脉粥样硬化斑块中异常表达,这表明它们与动脉粥样硬化的进展有关[16]。越来越多的miR 被发现参与泡沫细胞的形成和动脉粥样硬化。例如,miR-328-5p显示出加速胆固醇从载脂单核细胞流出的能力[17]。最近一项研究表明,在脂多糖刺激后miR-613 在单核细胞中上调,并且可以抑制脂多糖诱导的炎症反应,同时miR-613 抑制肽聚糖刺激的单核细胞中促炎细胞因子的产生,表明miR-613 在单核细胞中具有抗炎抗脂活性[18]。LXRs 是孤核受体超家族的成员。两种同种型已经被表征,即LXRα 和LXRβ,前者的表达更局限在肝脏、肾脏、脾脏、脂肪组织、肺、肠、骨骼肌和巨噬细胞中,而后者被普遍表达。LXRα 被认为是关键的转录调节因子,参与细胞甾醇稳态的调节。ABCA1 是ATP 结合盒(ABC)家族之一,是PPARc-LXRα 信号通路的靶标[19]。ABCA1和ABCG1 在HDL 介导和载脂蛋白AI 介导的胆固醇流出中起主要作用。过往报道表明[20-21],PPARc通过在LXRα 的启动子区域内结合PPRE 直接上调LXRα 的表达,而LXRα 直接上调ABCA1 的表达。在本项研究中,我们发现,与THP-1细胞组比较,达格列净低剂量组、达格列净低、中、高剂量组miR-613 表达水平升高,LXRα、ABCA1 表达水平降低(P<0.05),这说明,达格列净低通过上调miR-613 间接降低LXRα 和ABCA1 的表达进而抑制LXRα/ABCA1通路的激活。
综上所述,达格列净能抑制人单核细胞系THP-1 细胞增殖,促进人单核细胞系THP-1 细胞凋亡,降低人单核细胞系THP-1 细胞脂质水平;其机制可能与达格列净低通过上调miR-613 间接降低LXRα 和ABCA1 的表达进而抑制LXRα/ABCA1 通路的激活有关。本研究未能直接证明miR-613 对LXRα、ABCA1 的靶向调节作用,这将在后续研究中通过萤光素酶报告基因实验来直接证明miR-613与LXRα、ABCA1的靶向调节关系。
